蔗糖梯度离心技术方法在提取内质网的应用
2011-05-16付政祺
付政祺 杨 莹 田 青
1 江汉大学医学院病理学与病理生理学教研室,湖北省武汉市 430056; 2 华中科技大学同济医学院基础医学院病理生理学系
借助离心机旋转所产生的离心力,使得不同大小、不同密度的物质进行分离的技术,称之为离心分离(centrifugation)[1],它被广泛应用于细胞的收集、细胞碎片和沉淀的分离等。随着超速离心机的问世,离心技术不再被简单地用于较大颗粒的粗略分离,细胞器的分离、纯化技术得以建立,使得对各细胞器特有化学组成、功能的研究变成可能。本文主要针对超速离心提取内质网的方法及质量控制进行详细介绍。离心分离的基本方法,包括差速离心(differential centrifugation)和密度梯度离心(density gradient centrifugation)[2]。差速离心是指在密度均一的介质中由低速到高速对大小不同的细胞和细胞器进行逐级离心。但由于各种细胞器在大小和密度上的相互重叠,以及某些慢沉降颗粒常常被快沉降颗粒裹到沉淀块中,使得细胞器的分离需要重复多次。因此,差速离心主要用于细胞器的初筛或分离大小、密度悬殊较大的细胞。密度梯度离心是指用一定的介质(氯化铯、蔗糖等)在离心管内形成一连续或不连续的密度梯度,将不同密度细胞的混悬液或经匀浆破膜的细胞混悬液置于介质的顶部,通过足够大的离心力、足够长时间,使得不同密度的细胞或细胞器沉降或漂浮到与自身密度相等的介质处,并停留在那里达到平衡,从而将其进行分层、分离。分离活细胞的介质除了要对细胞无毒外,并需能产生适当的密度梯度,且黏度不高、渗透压不大,pH中性或易调为中性,以防止引起细胞和细胞器的水肿或塌陷,影响细胞或细胞器的提取及其质量。
1 材料和方法
1.1 材料
1.1.1 实验细胞。本实验所用细胞为野生型人胚胎肾细胞瘤细胞(wild type Human Embryonic Kidney 293,HEK293/wt)由许华曦博士(Rockeller University,NY,USA)提供[3]。
1.1.2 主要仪器。电动匀浆器(Glas-Col,美国),超声仪(Sonics& Materials inc,美国),TP-200振荡器,低温高速离心机(日立),台式高速离心机(Sigma),DG-C型电泳仪(东方特力科贸中心),转膜仪(Bio-Rad,北京市六一仪器厂),垂直型电泳槽和湿式电转膜槽(Hoefer,美国),恒温水浴箱(武汉科学仪器厂),4℃恒温振荡摇床(武汉科学仪器厂),图像分析系统(Image pro-pluskodak,美国),Himac CS 150GX超速离心机(Hitachi,Tokyo,Japan)。
1.1.3 主要试剂。Bip/GRP78购自Abcam公司。羊抗兔过氧物酶结合二抗、羊抗鼠过氧物酶结合二抗、增强化学发光(enhanced chemiluminescence,ECL)显色液、过硫酸铵(ammonium persulfate,AP)和二喹啉甲酸(Bicinchoninic acid,BCA)蛋白测定试剂盒均从Pierce公司购买。丙烯酰胺/N,N-二甲基甲叉双丙烯酰(Acrylamide/Bis-Acrylamide,Acr/Bis)、四甲基乙二胺(tetramethylethylenediamine,TEMED)、十二烷基磺酸钠(sodium dodecylsulpHate,SDS)、甘氨酸(Glycine,Gly)、小牛血清白蛋白(bovine serum albumin,BSA)、三羟甲基氨基甲烷(trishydroxymethylaminomethane,Tris)、脱氧胆酸钠(sodium deoxycholate,DOC)、Tris、矾酸钠(Na3VO4)、β-磷酸甘油 (β-PG)、氟化钠(NaF)、苯甲磺酰氟(pHenylmethylsulfonyl fluoride,PMSF)、胰蛋白酶抑制剂(aprotinin)、亮肽酶(leupeptin)、胃蛋白酶抑制(pepstatin)、二甲基亚砜(Dimethyl Sulfoxide,DMSO)和尿酸(uric acid)均购自Sigma公司(St Louis,MO,USA)。DMEM 和胎牛血清(fetal bovine serum,FBS)从Gibico公司购买。免疫印迹所用抗体稀释液为含0.02%NaN3的3%牛血清蛋白(BSA)。硝酸纤维素膜(nitrocellulose,NC)为Hybond公司产品。醋酸钠、冰醋酸、氢氧化钠、氯化钠、蔗糖、高氯酸、硼酸和二甲基甲酰胺均为国产分析纯。
1.2 方法
1.2.1 细胞培养。HEK293/wt细胞培养基为DMEM 和10%FBS[4,5]。DMED用Zeiss滤器真空负压过滤除菌,FBS分装成20ml/瓶,-20℃保存。细胞在5%CO2、37℃培养箱内培养。每2~3d更换培养液1次,细胞达约70%~80%丰度时,传代或用于实验。
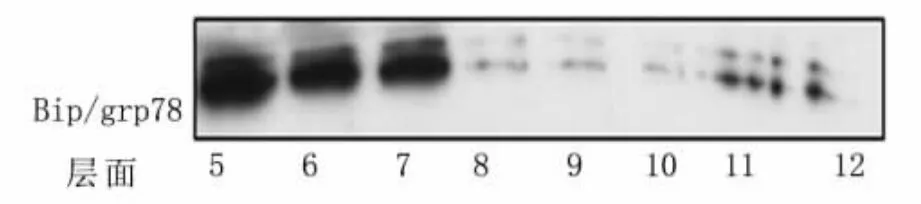
图1 运用蔗糖离心技术提取内质网
1.2.2 蔗糖梯度离心提取内质网[6~8]。(1)收集细胞。用1×PBS收集细胞,离心3 000×g,2min,去上清。(2)将收集到的细胞破膜。①将收集到的细胞中加入匀浆液0.5ml,混匀。[匀浆液配方:0.25M 蔗糖,10mM Tris-HCI(pH7.4),1mM 醋酸镁,PMSF0.174mg/L蛋白酶抑制剂];②手动匀浆器匀浆30~60下。(3)将破膜的细胞加入到已建立好蔗糖密度梯度的离心管上。蔗糖密度梯度的建立:由下至上,2M 蔗糖0.2ml,1.3M 蔗糖0.8ml,1.16M 蔗糖0.7ml,0.8M 蔗糖0.4ml。且可以根据具体离心管的大小,按比例增加/减少各层次不同浓度的蔗糖体积。加入时,沿管壁缓慢加入,也可以将中号枪头套在大枪头外缓慢加入,以减少冲击力,依次建立蔗糖密度梯度。(4)离心100 000×g,3h。(5)将离心管中的液体由上至下、轻柔地分12次等体积取出,分别加入到12个EP管中,做好标记。(6)准备样品。将取出的12层液体加入1/3体积的4×buffer,煮10min,超声,加入β巯基乙醇和溴芬兰煮10min。(7)Western blot[9,10]。将依次取出的12管液体等体积上样。孵育一抗内质网特异性抗体Bip/GRP78,显色。
2 结果
运用蔗糖梯度离心技术从HEK293/wt细胞(不含tau蛋白)中提取内质网。选用杆状玻璃匀浆器手动匀浆法破膜后,将破膜细胞加入到已建立好的蔗糖密度梯度上,离心100 000×g,不同时间,应用Western blot技术检测内质网所在层面。离心2h,内质网分散于蔗糖梯度的不同层面(8~12层),特别是5~7层(图1)。因为此处介质密度较低,无法确定处于此处的内质网是破膜所致的内质网碎片;还是离心力场不够,使得完整的内质网未沉降、平衡到与自身密度相等的介质中。延长离心时间到3h发现,内质网聚集于10、11和12层(图2)。
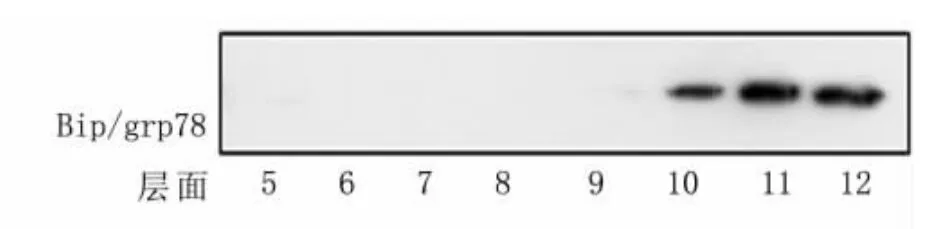
图2 通过调整离心时间、利用蔗糖梯度离心技术提取内质网
3 讨论
内质网在提取过程中质量控制的关键因素有以下几种。
3.1 恰当的破膜方法和强度是成功提取细胞器(内质网)的关键 目前,用于破碎细胞的方法主要有杆状玻璃匀浆器手动匀浆法、电动匀浆器匀浆法、超声波处理法、化学裂解法和反复冻融法。其中,杆状玻璃匀浆器手动匀浆法和电动匀浆器匀浆法为细胞破膜提取细胞器的首选。但操作时须注意,由于旋转、与接触器皿摩擦产热可导致细胞或细胞器中活性物质的降解,因此匀浆时须用冷却水降温。超声波发生器可经其较强的冲击和振动产生的剪力致使细胞破碎,但由于其作用力较强,除了打破细胞膜外,也易将各细胞器打碎。且超声时大量产热,生物大分子如核酸和酶对超声敏感,一般不宜采用。化学裂解法是在细胞悬液中加入 Triton-100、NP-40、SDS、去氧胆酸钠使细胞裂解,此方法对细胞内环境破坏较为严重,且往往仍须机械辅助破膜,一般不宜采用。反复冻融法,细胞经反复多次冻融周期(-70℃或液氮冷冻,37℃融化)不适合用于提取细胞器。
3.2 适当的介质、离心力和离心时间是提取高浓度、高质量内质网的关键 本方法所采用的蔗糖密度梯度离心是首先利用介质(蔗糖)建立合适的不同浓度的介质密度(介质的最高密度大于被分离组分内质网的密度)。通过足够大离心力和足够长时间,使得细胞器(内质网)在连续梯度的蔗糖介质中沉降,漂浮并停留到与自身密度相等的介质处并停留达到平衡,从而将其进行分离提纯。因此,离心力和离心时间的选择尤为重要。此方法所需要的力场较大,往往需要使用超速离心,且离心的时间也较长。离心力和离心时间不够会使得被分离细胞器(内质网)不足以沉降、平衡到与自身密度相等的介质中,而分散分布于密度低于自身密度的介质中(图1)。但过大的离心力、过长的离心时间又对细胞、细胞器不利。因此,选择适当的离心力和离心时间是提取高浓度、高质量内质网的关键。
总之,蔗糖梯度离心提取细胞器的技术还处在不断完善的过程中。在实际工作中我们要不断总结经验,改进技术,降低破膜方法、提取方法和环境对细胞器的损伤,从而提取高浓度、高质量的细胞器,拓宽细胞器提取、活体培养的应用范围。
[1] 尹辉.离心分离技术及其在中学生物学中的应用〔J〕.华章,2010,10:121-122.
[2] 林楚伟,周胜华,杜优优 .全骨髓贴壁并差速传代分离纯化大鼠骨髓间充质干细胞:与密度梯度离心法的比较〔J〕.中国组织工程研究与临床康复,2010,14(14):2508-2512.
[3] Ling ZQ,Tian Q,Wang L.Constant illumination induces Alzheimer-like damages with endoplasmic reticulum involvement and the protection of melatonin〔J〕.J Alzheimers Dis,2009,16(2):287-300.
[4] Li HL,Wang HH,Liu SJ.Phosphorylation of tau antagonizes apoptosis by stabilizing beta-catenin,a mechanism involved in Alzheimer’s neurodegeneration〔J〕.Proc Natl Acad Sci USA,2007,104:3591-3596.
[5] Liu XA,Liao K,et al.Tau dephosphorylation potentiates apoptosis with the mechanisms Involving a failed dephosphorylation/activation of Bcl-2〔J〕.J Alzheimers Dis,2010,19(3):953-962.
[6] Xu H,Sweeney D,Wang R,et al.Generation of Alzheimer betaamyloid protein in the trans-Golgi network in the apparent absence of vesicle formation〔J〕.Proc Natl Acad Sci USA,1997,94(8):3752.
[7] Greenfield JP,Tsai J,Gouras GK,et al.Endoplasmic reticulum and trans-Golgi network generate distinct populations of Alzheimer beta-amyloid peptides〔J〕.Proc Natl Acad Sci USA,1999,96:742-747.
[8] Cai D,Zhong M,Wang R,et al.Phospholipase D1corrects impaired beta APP trafficking and neurite outgrowth in familial Alzheimer’s disease-linked presenilin-1mutant neurons〔J〕.Proc Natl Acad Sci USA,2006,103(6):1936-1940.
[9] Fu ZQ,Yang Y,Song J,et al.LiCl attenuates thapsigargin-induced tau hyperphosphorylation by inhibiting GSK-3βin vivo and in vitro〔J〕.J Alzheimers Dis,2010,21:1107-1117.
[10] Hong XP,Peng CX,Wei W,et al.Relationship of adult neurogenesis with tau phosphorylation and GSK-3βactivity in subventricular zone〔J〕.Neurochem Res,2011,36:288-296.
