白芍总苷对实验性关节炎大鼠足爪组织基质金属蛋白9表达及关节浸液一氧化氮和地诺前列酮水平的影响
2011-05-14李宜川张玉霞刘国玲高明灿常景芝陈晓琦
李宜川,张玉霞,刘国玲,高明灿,常景芝,陈晓琦
(商丘医学高等专科学校生物化学与分子生物学教研室,河南商丘 476100)
类风湿性关节炎(rheumatoid arthritis,RA)是一种以对称性多关节炎病变为主的全身炎症性自家免疫疾病。其显著的病变以滑膜组织炎症细胞浸润、滑膜细胞增生、血管翳形成及软骨和软骨下骨质破坏为主,最终导致受累关节发生畸形而出现关节废用和致残。其发生机制涉及细胞因子、遗传和感染等多种因素。白芍总苷(total glucosides of paeonia,TGP)是从亳白芍干燥根中提取的有效成分,长期中医实验未发现TGP对人体有毒性,TGP的动物毒性研究也显示TGP无明显毒性损害,安全范围大[1]。目前有关RA受损局部组织基质金属蛋白酶(matrix metalloproteinases,MMPs)表达及关节浸液炎症介质在RA发生和发展过程中的作用受到人们的关注。本实验在成功建立大鼠实验性关节炎模型的基础上,观察TGP对实验性关节炎即胶原Ⅱ型诱导的实验性关节炎大鼠足爪组织MMP-9表达及关节浸液中一氧化氮(nitric oxide,NO),地诺前列酮(前列腺素 E2,dinoprostone,prostaglandin E2,PGE2)含量的影响,从根本上寻求其对实验性关节炎大鼠治疗的可能机制,为临床使用TGP治疗RA提供新的实验依据。
1 材料与方法
1.1 实验动物
Sprague-Dawley(SD)大鼠,雌雄各半,体质量(150±20)(±s)g,由商丘医学高等专科学校实验动物中心提供,动物合格证号:2009A01。
1.2 药品与试剂
TGP购自安徽医科大学临床药理研究所;弗氏完全佐剂、鸡胶原Ⅱ型购自上海本草生物医学工程所;多聚赖氨酸购自美国Sigma公司;地塞米松盐酸注射液购自河南确山龙渊药业有限公司;氯化钠注射液购自石家庄四药股份有限公司;冰醋酸购自广州化学试剂二厂;MMP-9小鼠单克隆抗体免疫组化SP试剂盒购自北京中山公司;NO试剂盒购自南京建成生物工程研究所;PGE2试剂盒购自解放军总医院科技开发中心放射免疫研究所。
1.3 实验性关节炎模型的制备及药物分组
大鼠60只,雌雄各半,随机分为6组:正常对照组,模型对照组,地塞米松 2 mg·kg-1组,白芍总苷100,50 和 25 mg·kg-1组,每组 10 只。将鸡胶原Ⅱ型15 mg 溶于7.5 ml预先配制好的醋酸0.1 mol·L-1中,浓度为2 mg·kg-1,4℃过夜,充分溶解。次日,与弗氏完全佐剂等体积于冰浴中混合,使之充分乳化,制成稳定的乳化剂15 ml,每ml含1.0 g胶原Ⅱ型,置4℃冰箱保存备用。SD大鼠除正常对照组外,在大鼠的左后肢足跖皮内sc给予胶原乳剂0.1 ml致炎,第7天在大鼠尾、背多点sc给予0.1 ml该胶原乳剂作为激发注射。正常对照组大鼠注射等剂量生理盐水作为致炎物质。操作时,先将注射部位以75%乙醇棉球消毒,然后再进行注射。白芍总苷组大鼠于造模后第7~27天ig给予白芍总苷25,50和100 mg·kg-1;阳性对照地塞米松组大鼠也于造模后第7~27天每天ip给予地塞米松2 mg·kg-1;正常对照组和模型组ig给予等容积生理盐水。
1.4 体质量及关节炎指数[2]测量
致炎前(第0天)及致炎后第7,14,21,28和35天分别测量大鼠体质量。同时在致炎后第7天,第14天,第18天,第22天,第26天,第30天和第34天,采用关节评分法,得出关节炎指数(arthrits index,AI),具体评分标准如下:0分,无红肿;1分,趾关节红肿;2分,趾关节和足趾肿胀;3分,踝关节以下的足爪肿胀;4分,包括踝关节在内的全部足爪肿胀;每肢AI最高分数为4分,四肢AI之和代表每只大鼠的AI,最高值为16分。
1.5 免疫组化法测定大鼠足爪组织中基质金属蛋白酶9的表达
实验第35天采集足跖部位的组织,用4%甲醛及时固定,石蜡包埋,切片,贴片。将切片浸入PBS 0.1 mol·L-1(pH 7.4)浸泡、微波修复抗原。滴加封闭液羊血清。滴加1∶50的羊抗MMP-9抗体。滴加链霉抗生物素-过氧化物酶溶液。滴加链霉亲和素-生物素(SABC)。二氨基联苯胺(DAB)显色。⑧滴加苏木素轻度复染后,依次进行脱水、透明、中性胶封片及显微镜观察。
光学显微镜下观察,每组随机计数500个细胞,以胞浆出现淡黄至褐黄色细颗粒状着色为阳性细胞,计算阳性百分率。
1.6 硝酸还原法测定关节浸液NO含量和放免法测定地诺前列酮含量
大鼠处死后,迅速采集左足肿胀足爪,纵向切开足爪组织,放入5 ml冷生理盐水中,于4℃浸泡过夜,3200×g离心 10 min,取上清液过滤除菌,-20℃冻存待测。NO含量的测定采用硝酸还原法,PGE2含量测定采用放免法,均按试剂盒说明进行操作。
1.7 统计学分析
2 结果
2.1 白芍总苷对实验性关节炎大鼠体质量的影响
与正常对照组相比实验性关节炎大鼠于造模后第7天表现四肢关节红肿、活动量减少、食欲下降、毛发灰暗无泽和明显消瘦体质量减轻。TGP 50和100 mg·kg-1和地塞米松 2 mg·kg-1可有效缓解 CIA大鼠体质量的减轻(表1)。
2.2 白芍总苷对实验性关节炎大鼠多发性关节炎指数的影响
如表2所示,各组大鼠致炎后第l4天开始大鼠多发性关节炎指数升高。与正常对照组相比,CIA模型组各时间点AI有非常显著性差异(P<0.01);与CIA模型大鼠相比,白芍总苷50和100 mg·kg-1组及地塞米松组从第18天开始AI有明显降低(P <0.05,P <0.01),白芍总苷25 mg·kg-1组与 CIA模型大鼠相比差异有显著性(P<0.05)。

表1 白芍总苷(TGP)对胶原Ⅱ型诱导的类风湿性关节炎(CIA)大鼠体质量的影响Tab.1 Effects of total glucosides of paeonia(TGP)on body mass of rats with arthritis induced by collagen typeⅡ
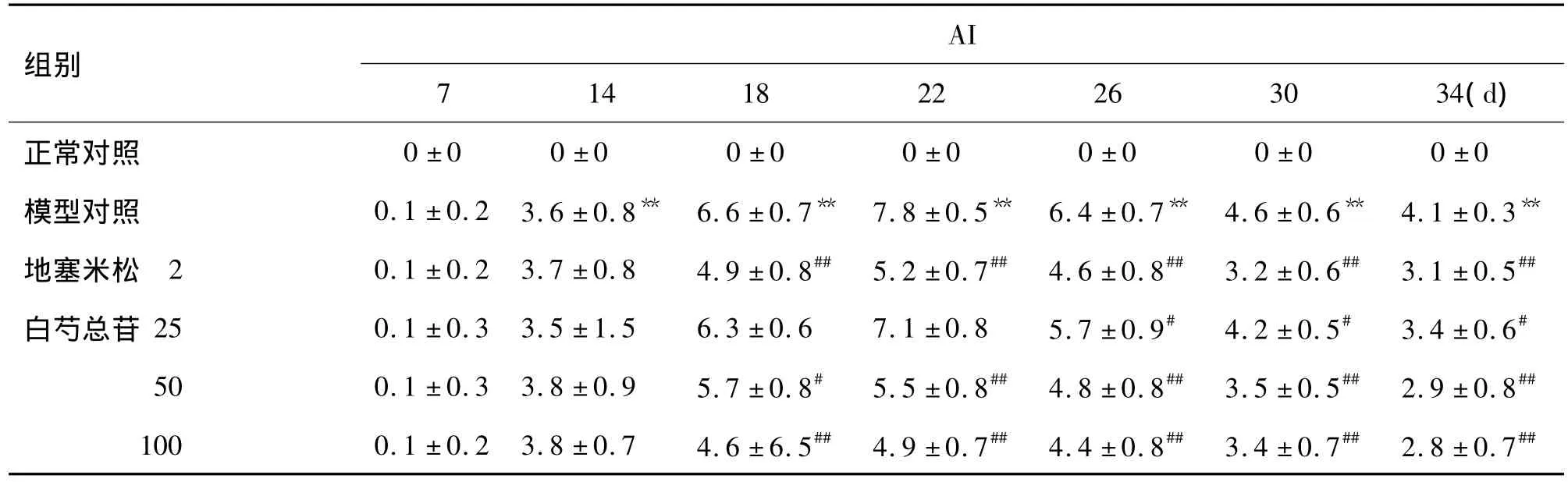
表2 TGP对实验性关节炎大鼠足爪关节指数(AI)的影响Tab.2 Effect of TGP on arthritis index(AI)in rats with arthritis induced by collagen typeⅡ
2.3 白芍总苷对实验性关节炎大鼠足爪基质金属蛋白酶9蛋白表达的影响
如表3和图1所示,MMP-9蛋白表达阳性部位主要在细胞浆中,在高倍镜下可见细胞浆内棕黄色染色小颗粒。正常对照组细胞浆内未见阳性染色区域;模型对照组阳性染色细胞明显,染色程度为棕黄色,MMP-9蛋白表达强阳性;地塞米松阳性对照组胞浆内略见棕黄色染色小颗粒,与模型对照组比较有非常显著性意义;与模型对照组比较,白芍总苷50和100 mg·kg-1组胞浆内 MMP-9阳性表达细胞百分率明显降低(P<0.05,P<0.01);白芍总苷25 mg·kg-1胞浆内阳性表达无显著性差异。

表3 TGP对实验性关节炎大鼠足爪组织中基质金属蛋白酶9(MMP-9)表达的影响Tab.3 Effect of TGP on MMP-9 expression in paws of rats with arthritis induced by collagen typeⅡby immunohistochemistry

图1 TGP对实验性关节炎大鼠足爪组织中基质金属蛋白酶-9(MMP-9)表达的影响 (HE ×400).动物分组、造模和给药见表1.A:正常对照组;B:模型对照组;C:地塞米松2 mg·kg-1组;D-F:白芍总苷25,50和100 mg·kg-1.胞浆为淡黄至褐黄色者为MMP-9阳性细胞.Fig.1 Effect of TGP on matrix metalloproteinase 9(MMP-9)protein expression in paws of rats with arthritis induced by collagen typeⅡby immunohistochemistry(HE ×400).
2.4 白芍总苷对实验性关节炎大鼠关节浸液内一氧化氮和地诺前列酮含量的影响
如表4所示,与正常对照组比较,CIA模型组大鼠关节浸液中NO和 PGE2含量明显增高(P<0.01);与 CIA 模型组比较,TGP 25,50和100 mg·kg-1组、地塞米松 2 mg·kg-1组治疗后关节浸液内 NO和 PGE2含量明显下降(P<0.01,P <0.05)。

表4TGP对实验性关节炎大鼠关节浸液中一氧化氮(NO)和地诺前列酮(PGE2)含量的影响Tab.4 Effect of TGP on the concent of nitric oxide(NO)and dinoprostone(PGE2)in articular infusion of rats with arthritis induced by collagen typeⅡ
3 讨论
本研究发现鸡胶原Ⅱ型诱导的实验性关节炎大鼠模型,原发病变主要表现为致炎足爪肿胀,继发性病变一般于致炎后14 d左右出现,表现为非炎性足爪红肿、肿胀、耳和尾部出现“关节小节”及体质量下降,第22~27天病变达高峰。TGP 25,50和100 mg·kg-1可明显抑制实验性关节炎大鼠的足爪肿胀和多发性关节炎程度;TGP 50和100 mg·kg-1可促进实验性关节炎大鼠体质量的恢复;表明TGP对实验性关节炎大鼠具有明显的治疗作用。
MMPs是一类分解细胞外基质组分(除多糖)的锌蛋白酶,在RA的细胞外基质降解中起着重要作用。MMPs水平升高,使得细胞外基质成分发生不可逆降解及关节破坏。在MMPs家族中MMP-9是明胶酶,在滑膜组织浸润的炎症细胞中表达,包括巨噬细胞、淋巴细胞和肥大细胞等[3]。Ahrens等[4]证实滑膜为MMP-9的产生部位。MMP-9在RA过程中的作用机制可能是:MMP-9不仅被动地作为炎症反应的下游产物而出现,它还对许多促炎因子发挥正反馈作用,是炎症反应重要的“调节剂”[5]。Schonbeck等[6]研究发现MMP-9可以在白细胞介素1β转换酶作用位点裂解 IL-1,使无活性的前体IL-1β向有活性IL-1β转化。IL-1β是炎症的始动因素,与关节局部炎症反应加重有关[7],具有多种促炎活性,能诱导滑膜细胞产生PGE和胶原酶,能上调其他促炎因子的产生。本实验研究发现模型对照组足爪中MMP-9阳性表达率极高,给予TGP治疗可显著抑制实验性关节炎大鼠足爪组织MMP-9的表达,与MMP-9可破坏成熟血管壁的基底膜,从而允许内皮细胞的迁移,与血管翳的形成有关[8]的研究报道相符合。提示TGP可能通过抑制RA滑膜细胞分泌MMP-9,从而可以抑制血管新生,减缓滑膜血管翳形成与增殖而减轻其对关节软骨及骨的侵蚀破坏作用,同时由于MMP-9的表达受到抑制,使得活性IL-1β转化受阻,促炎症细胞因子、PGE和胶原酶生成减少,关节局部炎症反应得到缓解。
NO是一种重要的炎症介质,动物实验性关节炎时,体内NO水平异常升高,特别是关节浸液中有大量NO[9],其机制是NO能促进释放IL-1和TNF-α,而IL-1和TNF-α的异常增高可导致细胞毒性作用,介导免疫损伤,直接或间接刺激滑膜细胞和软骨细胞合成并释放PGE2[10]和胶原酶增多形成恶性循环,引发滑膜炎症反应,软骨基质崩解,软骨吸收和骨破坏;同时NO还能影响成纤维细胞样滑膜细胞诱导产生MMPs,加重关节损伤。本实验研究发现,实验性关节炎大鼠关节浸液中NO和PGE2含量明显增高,但TGP治疗后实验性关节炎大鼠关节浸液中NO和PGE2水平显著降低,提示NO和PGE2参与了RA的炎症过程,TGP可通过抑制NO和PGE2的产生,减轻局部炎症,改善关节肿胀、延缓关节损伤等症状。
TGP对实验性关节炎大鼠的多发性关节炎有明显的抑制作用,可能是与其下调MMP-9表达及降低炎症局部区域相关炎症介质NO和PGE2产生,从而抑制滑膜组织增生、关节软骨侵蚀、血管翳生成,减低致炎症细胞因子含量,使炎症细胞因子网络趋于平衡。
[1] 常 艳,魏 伟,张 磊,徐红梅.白芍总苷对IL-1α诱导胶原性关节炎大鼠成纤维样滑膜细胞功能的影响[J].中国药理学通报,2007,23(2):185-188.
[2] 朱 蕾,魏 伟.白芍总苷对大鼠胶原性关节炎及其免疫功能的影响[J].中国药学,2007,20(48):1547-1551.
[3] Hoashi T,Kadono T,Kikuchi K,Etoh T,Tamaki K.Differential growth regulation in human melanoma cell lines by TIMP-1 and TIMP-2[J].Biochem Biophys Res Commun,2001,288(2):371-379.
[4] Ahrens D, Koch AE, Pope RM, Stein-Picarella M,Niedbala MJ.Expression of matrix metalloproteinase 9(96-kD gelatinase B)in human rheumatoid arthritis[J].Arthritis Rheum,1996,39(9):1576-1587.
[5] Blackwell TS,Christman JW.The role of nuclear factorkappa B in cytokine gene regulation[J].Am J Respir Cell Mol Biol,1997,17(1):3-9.
[6] Persidsky Y,Limoges J,Rasmussen J,Zheng J,Gear-ing A,Gendelman HE.Reduction in glial immunity and neuropathology by a PAF antagonist and an MMP and TNFalpha inhibitor in SCID mice with HIV-1 encephalitis[J].J Neuroimmunol,2001,114(1-2):57-68.
[7] Vuolteenaho K,Moilanen T,Hämäläinen M,Moilanen E.Regulation of nitric oxide production in osteoarthritic and rheumatoid cartilage.Role of endogenous IL-1 inhibitors[J].Scand J Rheumatol,2003,32(1):19-24.
[8] 莫汉有,周润华,王晓桃,杨 敏,覃 央,陈蓓莉,等.血管内皮生长因子对佐剂性关节炎滑膜细胞基质金属蛋白酶3及基质金属蛋白酶9表达的影响[J].中国组织工程研究与临床康复,2007,11(27):5307-5310.
[9] 吕丽萍,张永忠.雷公藤内酯酮对大鼠类风湿性关节炎的影响[J].中成药,2007,29(7):966-968.
[10] 王 斌,陈敏珠.一氧化氮与炎症性关节疾病[J].中华风湿病学杂志,1999,3(3):191-193.
