贝那普利对糖尿病大鼠心肌细胞外基质重塑中基质金属蛋白酶及转化生长因子表达的影响
2011-05-14符丽娟王洪新包翠芬隋海娟
符丽娟,王洪新,包翠芬,隋海娟
(辽宁医学院1.药理学教研室,2.科学实验中心,辽宁锦州 121001)
糖尿病心肌细胞外基质(extracellular matrix,ECM)重塑主要表现为心肌纤维化、细胞外基质中胶原沉积和细胞外基质胶原构型的改变。这种变化使活动于其中的心肌细胞代谢和功能紊乱,导致心肌细胞肥大、凋亡、变性和坏死[1]。细胞外基质重塑是导致糖尿病患者心室重构及心脏功能异常的主要病理基础。基质金属蛋白酶(matrix metalloproteinases,MMPs)是一组能特异性地降解ECM成分的Zn2+依赖的酶家族,目前发现作用于心肌胞外基质的MMPs主要有MMP-2、MMP-9和膜型1-MMP。金属蛋白酶类组织抑制剂(tissue inhibitor of metalloproteinases,TIMPs)是MMPs的特异性抑制因子,二者为ECM降解调节过程中一对重要的拮抗物,患糖尿病时各种病理因子可促进胶原合成分泌,打破MMPs和TIMPs间的平衡,改变胶原蛋白分子的结构,对糖尿病心肌细胞外基质重塑起重要作用[2]。转化生长因子 β1(transforming growth factor-β1,TGF-β1)是促进心肌间质纤维化形成与发展的关键因子,与多脏器间质纤维化有关;结缔组织生长因子(connective tissue growth factor,CTGF)则是纤维化过程中的下游效应因子,可促进纤维细胞的增生和ECM 的聚积[3]。贝那普利(benazepril,BZ)为血管紧张素转换酶抑制剂(angiotensin converting enzyme inhibitor,ACEI),其可通过抑制糖尿病心肌细胞凋亡,改善心室重构,保护心脏功能[4]。本研究建立糖尿病大鼠心肌病模型,观察BZ对糖尿病大鼠心肌 MMP-2,TIMP-2 及 TGF-β1,CTGF 表达的影响,进一步探讨BZ对糖尿病心肌细胞外基质重塑的作用机制。
1 材料与方法
1.1 药物、试剂及仪器
链脲佐菌素(streptozotocin,STZ),货号:H1027S,(Sigma公司)和BZ(美国Sigma公司)。多克隆兔抗鼠抗胶原Ⅰ型抗体(编号:bs-0578R)、抗胶原Ⅲ型抗体(编号:bs-0549R)、MMP-2抗体(编号:bs-0412R)、TIMP-2 抗体(编号:bs-0416R)、TGF-β1抗体(编号:bs-0103R)和 CTGF抗体(编号:bs-0743R)均购自北京博奥森生物技术有限公司;碱性磷酸酶标记的山羊抗兔抗体和β肌动蛋白和NBT/BCIP显色液购自碧云天试剂公司。DY-1型电泳仪,上海医疗仪器公司;Mini-REPOTEANⅡ型电泳槽,美国 Bio-Rad公司;DYY-Ⅲ型电转移槽,北京六一仪器厂;TGL-16G高速冷冻离心机,日本日立公司,JEOL-1200EX透射电镜,日本电子公司。
1.2 动物、模型制备及分组
SD大鼠,24只,♂,体质量200~250 g,2月龄,由辽宁医学院实验动物中心提供,动物许可证号SCXK(辽)2003-0007。16只大鼠一次性左下ip给予 1% STZ 溶 液 60 mg·kg-1[5],临 用 前 用 0.5 mmol·L-1的枸橼酸-枸橼酸钠缓冲液(pH 4.5)配制。另8只大鼠为正常对照组,注射等量容积枸橼酸-枸橼酸钠缓冲液 0.5 mmol·L-1(pH 4.5)。当天即让大鼠自由进食饮水。注射后72 h测血糖及尿糖,将血糖浓度 >16.7 mmol·L-1,尿糖阳性者定为糖尿病模型(diabetic model,DM)大鼠。然后将糖尿病大鼠随机分为DM和BZ组,BZ组ig给予BZ 10 mg·kg-1[6],共 12 周。
1.3 心脏质量指数检测及心室标本采集
开胸取出大鼠心脏,分别称取心脏质量(heart mass,HM)及左心室质量(left ventricular mass,LVM),计算心脏质量指数(HM index,HMI)及左心室质量指数(LVMI)。HMI(mg·g-1)=HM/BM,LVMI=LVH/BM。然后将左心室心肌一半置于4%多聚甲醛(pH 7.4)中固定24 h,常规石蜡包埋,制作切片;一半置于-70℃冰箱,用于Western印迹检测。
1.4 心肌组织病理检查
1.4.1 光镜观察
取各组大鼠左心室心肌组织块,4%多聚甲醛固定,梯度乙醇脱水,常规石蜡包埋,制备心肌石蜡切片,HE染色,中性树胶封片,镜下观察。
1.4.2 电镜观察
每组随机取2只大鼠,ip注射20%乌拉坦麻醉,取左室心肌组织块,切成1 mm3大小组织块,超微标本入3%戊二醛固定液固定2 h,1%锇酸固定1 h,逐级乙醇、丙酮脱水后,环氧树脂包埋,超薄切片,经铀、铅双重染色后,透射电镜观测各组大鼠心肌超微结构变化。
1.5 Western印迹法检测左心室心肌胶原Ⅰ型及Ⅲ型,MMP-2,TIMP-2,TGF-β1和 CTGF 蛋白表达
取约100 mg左心室心肌,立即放入预冷的Tris缓冲液中〔TBS,mmol·L-1:1%Triton,0.1%SDS,0.5%去氧胆酸,EDTA 1,Tris 20(pH 7.4),NaCl 150,NaF 10〕,4℃超声粉碎后,12 000×g离心30 min,取上清,用Lowry等[7]法测定蛋白质含量,以牛血清白蛋白(bovine serum albumin,BSA)为标准品,将各组蛋白浓度调成一致。用10%~12%SDSPAGE分离蛋白质,每个泳道蛋白上样量为20~50 μg。为了准确判断目的蛋白带的位置,一个泳道加Seeblue plus 2预染蛋白标记物。电泳后将PAGE凝胶中的蛋白质电转移至聚偏氟乙烯膜上,取出后将膜放入3%BSA阻断缓冲液中,封闭60 min,再用TBS〔Tris 10 mmol·L-1(pH 8.0),NaCl 150 mmol·L-1〕洗膜3次,每次10 min。将膜放入一抗中(所有一抗均1∶500稀释),4℃过夜。TBS冲洗后,将膜放入碱性磷酸酶标记的山羊抗兔二抗中(二抗均1∶500稀释),室温孵育1~2 h,然后用TBS洗膜3次,每次10 min,NBT/BCIP显色液中避光显色,直至出现,终止反应。对胶原Ⅰ型及Ⅲ型,MMP-2,TIMP-2,TGF-β1和CTGF进行测定。每个抗体测定时都进行β肌动蛋白测定,以保证蛋白上样量的一致性。将蛋白印迹显影图扫描,利用凝胶自动分析成像软件Chem Image 5500对蛋白带进行积分吸光度值(integrated absorbance,IA)分析,以β肌动蛋白为参照,计算二者IA比值表示胶原Ⅰ型及Ⅲ型,MMP-2,TIMP-2,TGF-β1和 CTGF 等的表达。
2 结果
2.1 贝那普利对糖尿病大鼠心脏质量指数和左心室质量指数的影响
表1结果显示,与正常对照组比较,DM组大鼠HMI和LVMI明显增高,BZ组大鼠HMI和LVMI均明显低于DM组(P<0.01)。表明糖尿病大鼠已出现心肌肥厚,主要表现为左心室心肌肥厚,BZ可减轻糖尿病所致心肌肥厚。
2.2 贝那普利对糖尿病大鼠心肌组织结构的影响
HE染色显示,正常对照组(图1A)左室心肌细胞排列有序,DM组大鼠心肌细胞排列紊乱,可见肌纤维断裂,心肌细胞肥大肿胀,心肌间质及小血管周围纤维增多(图1B);BZ组病变减轻(图1C)。

表1 贝那普利(BZ)对糖尿病模型(DM)大鼠心脏质量指数(HMI)和左心室质量指数(LVMI)的影响Tab.1 Effect of benazepril(BZ)on heart mass index(HMI)and left ventricular mass index(LVMI)of diabetic rats
图2透射电镜显示,DM组大鼠心肌肌丝成分减少,局部断裂,线粒体变性肿胀甚至空泡样改变;心肌间质纤维增多(图2B),毛细血管基底膜增厚。提示心肌超微结构明显损伤,心肌间质纤维增生。而BZ组大鼠肌原纤维及线粒体结构异常均有改善,间质胶原减少,基底膜增厚明显减轻。提示BZ可减轻心肌损伤,改善间质纤维化(图2C)。

图2 贝那普利对DM大鼠心肌超微结构的影响(×10 000).分组处理见表1.A:正常对照组;B:DM模型组;C:BZ组.Fig.2 Effect of benazepril on cardiomyocyte ultrastructure of DM rats.
2.3 贝那普利对糖尿病大鼠心肌胶原Ⅰ型及Ⅲ型表达的影响
与正常对照组比较,DM组大鼠心肌胶原Ⅰ型(1.09 ± 0.30 vs 0.35 ± 0.19)、胶 原 Ⅲ 型(1.73 ±0.25 vs 0.57 ±0.22)表达增加(P <0.05)。应用 BZ后,大鼠心肌胶原Ⅰ型(0.49±0.20)、胶原Ⅲ型(0.67 ±0.32)表达明显减少(P <0.05,P <0.01)(图3)。
2.4 贝那普利对糖尿病大鼠心肌 MMP-2和TIMP-2表达的影响
与正常对照组比较,DM组大鼠心肌TIMP-2表达增加,MMP-2表达减少(P<0.01),BZ组大鼠TIMP-2表达减弱,MMP-2表达增强(P<0.05)(图4)。
2.5 贝那普利对糖尿病大鼠心肌 TGF-β1和CTGF表达的影响
与正常对照组比较,DM组大鼠心肌TGF-β1及CTGF表达增加(P <0.05,P <0.01),BZ组大鼠心肌TGF-β1和 CTGF 表达减少(P <0.05)(图5)。
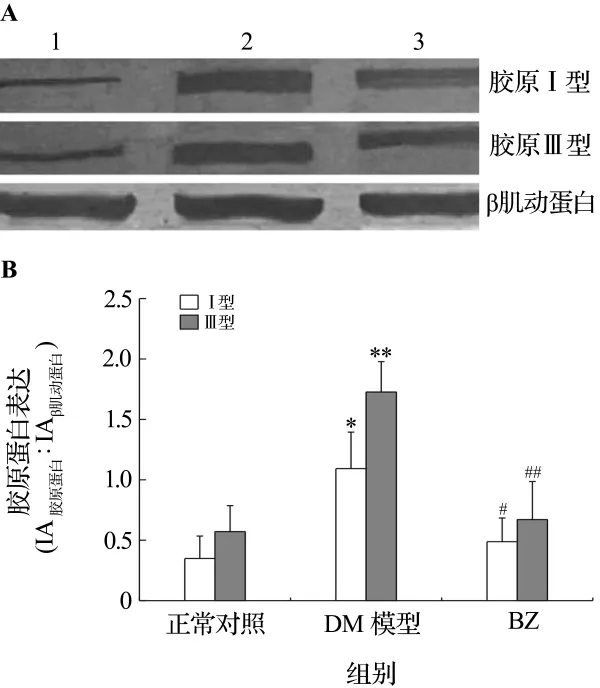
图3 Western蛋白印迹法检测贝那普利对糖尿病大鼠心肌的胶原Ⅰ型及Ⅲ型表达的影响(A)及定量分析结果(B).条带1:正常对照组;条带2:DM模型组;条带3:BZ组.IA:积分吸光度值.±s,n=3.*P<0.05,**P<0.01,与正常对照组比较;#P <0.05,##P <0.01,与 DM模型组比较.Fig.3 Effect of benazepril on cardiomyocyte collagen typeⅠcollagen and typeⅢexpression in diabetic rats by Western blotting(A)and semiquantitative results(B).
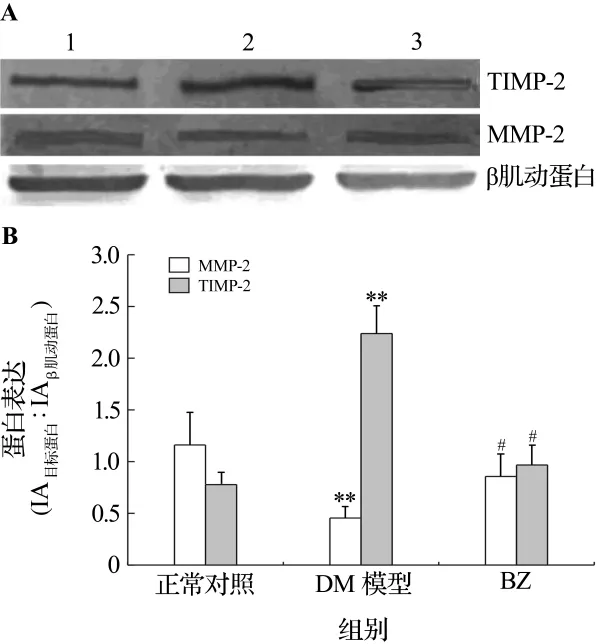
图4 Western印迹法检测贝那普利对糖尿病大鼠心肌的基质金属蛋白酶2(MMP-2)和金属蛋白酶组织抑制因子2(TIMP-2)表达的影响(A)及定量分析结果(B).条带1:正常对照组;条带2:DM模型组;条带3:贝那普利组.±s,n=3.**P <0.01,与正常对照组比较;#P <0.05,与 DM 模型组比较.Fig.4 Effect of benazepril on cardiomyocyte matrix metalloproteinases-2(MMP-2),tissue inhibitor matrix metalloproteinases-2(TIMP-2)expression in diabetic rats by Western blotting(A)and semiquantitative results(B).
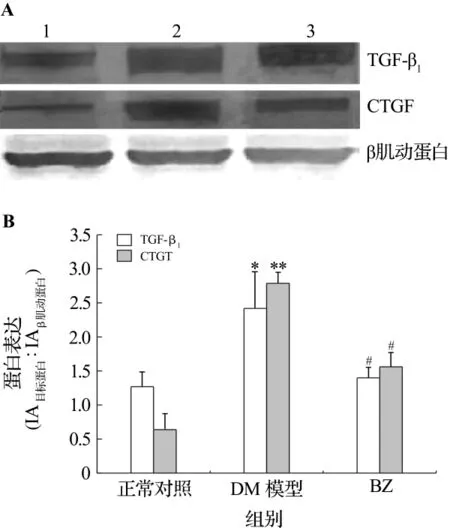
图5 Western蛋白印迹法检测贝那普利对糖尿病大鼠心肌组织的转化生长因子 β1(TGF-β1),结缔组织生长因子(CTGF)蛋白表达的影响(A)及定量分析结果(B).条带1:正常对照组;条带2:DM模型组;条带3:BZ组.±s,n=3.*P <0.05,**P <0.01,与正常对照组比较;#P <0.05,与DM 模型组比较.Fig.5 Effect of benazepril on cardiomyocyte transforming growth factor-β1(TGF-β1),connective tissue growth factor(CTGF)expression in diabetic rats by Western blotting(A)and semiquantitative results(B).
3 讨论
正常心脏细胞外基质的主要成分为胶原,由心肌间隙中成纤维细胞产生和分泌的胶原纤维组成,分布于心脏细胞外基质中的胶原主要为胶原Ⅰ型及Ⅲ型。Searls等[8]研究表明,糖尿病时心肌成纤维细胞过度增生,可导致胶原合成增多,表现为胶原Ⅰ型及Ⅲ型增多,比例升高。本实验中糖尿病病程12周时,糖尿病大鼠心肌胶原Ⅰ型及Ⅲ型表达明显增多,HMI和LVMI较正常对照组明显增高,病理结果显示心肌间质纤维增生;表明此时糖尿病大鼠已存在心肌间质纤维化及细胞外基质重构。
Van Linthout等[9]证实,在 STZ 诱导的糖尿病仓鼠中可观察到MMP-2 mRNA的表达、其前体以及活化的MMP-2的含量均有减少,同时伴TIMP-2含量增多。本研究显示,糖尿病大鼠12周时心肌MMP-2表达减少,同时TIMP-2表达增加。表明糖尿病病程12周时MMP-2的活性减弱,TIMPs的生物活性相对增强;并且左心室心肌胶原Ⅰ型及Ⅲ型含量明显增加。提示MMPs与TIMPs二者平衡的失调可使细胞外基质胶原合成和降解的平衡偏移,结果导致细胞外基质胶原含量的增多。
有研究显示糖尿病过程中心肌组织内TGF-β1含量增多[10]。增多的 TGF-β1在ECM 和毛细血管基底膜处与间质蛋白相结合,通过其Ⅰ型受体介导心脏成纤维细胞内DNA合成,增加各种ECM成分,包括胶原Ⅰ型及Ⅲ型等。此外,有研究发现TGF-β1可增加纤溶酶原激活物抑制剂PAI-1的分泌,抑制纤溶酶原激活而影响MMP活性,导致ECM降解减少[11-12]。本研究中病程12周时,糖尿病大鼠左心室心肌TGF-β1明显增多,提示TGF-β1在心肌组织中过表达是导致糖尿病大鼠心肌胶原含量增多的原因之一。TGF-β1可通过CTGF依赖性途径诱导胶原合成,刺激ECM合成,而CTGF则维持纤维化的发展[13],具体作用机制还有待进一步研究。Way等[14]研究发现,STZ诱导的糖尿病小鼠心肌中,CTGF mRNA的表达量是正常对照组动物的2.4倍。Cheng等[15]研究发现,糖尿病大鼠心肌细胞CTGF基因及蛋白表达亦增加,并参与了心肌纤维化进程。本研究显示,糖尿病大鼠左心室心肌CTGF与TGF-β1表达均明显增加,表明糖尿病心肌损害与CTGF过度表达有关,CTGF与TGF-β1参与了糖尿病心肌纤维化的发生。且 TGF-β1及 CTGF的上调,可影响MMP2,TIMP-2表达,促使细胞外基质胶原降解受抑制,导致细胞外基质中胶原沉积相对增多。
肾素-血管紧张素系统(renin-angiotensin system,RAS)的过度激活,血管紧张素Ⅱ(angiotensinⅡ,AngⅡ)的异常作用与糖尿病心肌病密切相关[16-18]。本课题前期研究结果显示,12周时糖尿病大鼠心肌AngⅡ明显升高[4];本实验发现糖尿病大鼠心肌 TGF-β1和 CTGF表达也随之增强,而MMP-2表达减少,TIMP-2表达增多,导致胶原Ⅰ型及Ⅲ型表达增加。应用BZ后,大鼠心肌组织TGF-β1和CTGF表达均明显降低,MMP-2表达增多,TIMP-2减少,且心肌中胶原I型及Ⅲ型含量降低。提示AngⅡ可通过刺激TGF-β1,CTGF的表达参与糖尿病心肌纤维化的发生发展。BZ通过减少AngⅡ形成[4],下调 TGF-β1及 CTGF 表达,增加 MMP-2 表达,从而减少心肌胶原含量,减轻心肌间质纤维化,改善糖尿病心肌细胞外基质重构。
综上所述,糖尿病心肌细胞外基质重塑与TGF-β1及CTGF过度表达有关,BZ通过减少AngⅡ的形成,抑制TGF-β1及CTGF表达减少,进而影响MMP-2和TIMP-2活性,抑制糖尿病心肌细胞外基质重构。
[1] Vaughan TB,Bell DS.Diabetic cardiomyopathy[J].Heart Fail Clin,2006,2(1):71-80.
[2] Li Q,Sun SZ,Wang Y,Tian YJ,Liu MH.The roles of MMP-2/TIMP-2 in extracellular matrix remodelling in the hearts of STZ-induced diabetic rats[J].Acta Cardiol,2007,62(5):485-491.
[3] Matsui Y,Sadoshima J.Rapid upregulation of CTGF in cardiac myocytes by hypertrophic stimuli:implication for cardiac fibrosis and hypertrophy[J].J Mol Cell Cardiol,2004,37(2):477-481.
[4] 符丽娟,王洪新,包翠芬.贝那普利对糖尿病大鼠心肌细胞凋亡及左心室重构的影响[J].中国药理学与毒理学杂志,2010,24(3):185-190.
[5] Thomas G,Ramwell PW.Streptozotocin:a nitric oxide carrying molecule and its effect on vasodilation[J].Eur J Pharmacol,1989,161(2-3):279-280.
[6] Singh VP,Le B,Khode R,Baker KM,Kumar R.Intracellular angiotensinⅡproduction in diabetic rats is correlated with cardiomyocyte apoptosis,oxidative stress,and cardiac fibrosis[J].Diabetes,2008,57(12):3297-3306.
[7] Lowry OH,Rosebrough NJ,Farr AL,Randall RJ.Protein measurement with the Folin phenol reagent[J].J Biol Chem,1951,193(1):265-275.
[8] Searls YM,Smirnova IV,Fegley BR,Stehno-Bittel L.Exercise attenuates diabetes-induced ultrastructural changes in rat cardiac tissue[J].Med Sci Sports Exerc,2004,36(11):1863-1870.
[9] Van Linthout S,Seeland U,Riad A,Eckhardt O,Hohl M,Dhayat N,et al.Reduced MMP-2 activity contributes to cardiac fibrosis in experimental diabetic cardiomyopathy[J].Basic Res Cardiol,2008,103(4):319-327.
[10] Khan R,Sheppard R.Fibrosis in heart disease:understanding the role of transforming growth factor-beta in cardiomyopathy,valvular disease and arrhythmia[J].Immunology,2006,118(1):10-24.
[11] Rosenkranz S.TGF-beta1 and angiotensin networking in cardiac remodeling[J].Cardiovasc Res,2004,63(3):423-432.
[12] Singh R,Song RH,Alavi N,Pegoraro AA,Singh AK,Leehey DJ.High glucose decreases matrix metalloproteinase-2 activity in rat mesangial cells via transforming growth factor-beta1[J].Exp Nephrol,2001,9(4):249-257.
[13] Brooks BA,Franjic B,Ban CR,Swaraj K,Yue DK,Celermajer DS,et al.Diastolic dysfunction and abnormalities of the microcirculation in type 2 diabetes[J].Diabetes Obes Metab,2008,10(9):739-746.
[14] Way KJ,Isshiki K,Suzuma K,Yokota T,Zvagelsky D,Schoen FJ,et al.Expression of connective tissue growth factor is increased in injured myocardium associated with protein kinase C beta2 activation and diabetes[J].Diabetes,2002,51(9):2709-2718.
[15] Cheng M,Gao HQ,Xu L,Li BY,Zhang H,Li XH.Cardioprotective effects of grape seed proanthocyanidins extracts in streptozocin induced diabetic rats[J].J Cardiovasc Pharmacol,2007,50(5):503-509.
[16] Connelly KA,Boyle AJ,Kelly DJ.AngiotensinⅡ and the cardiac complications of diabetes mellitus[J].Curr Pharm Des,2007,13(26):2721-2729.
[17] Tsutsui H,Matsushima S,Kinugawa S,Ide T,Inoue N,Ohta Y,et al.AngiotensinⅡ type 1 receptor blocker attenuates myocardial remodeling and preserves diastolic function in diabetic heart[J].Hypertens Res,2007,30(5):439-449.
[18] Xu J,Carretero OA,Lin CX,Cavasin MA,Shesely EG,Yang JJ,et al.Role of cardiac overexpression of ANGⅡin the regulation of cardiac function and remodeling postmyocardial infarction[J].Am J Physiol Heart Circ Physiol,2007,293(3):H1900-H1907.
