大豆根瘤促生剂对费氏中华根瘤菌产结瘤因子影响
2011-04-30王梦亮
王梦亮,张 婧
(山西大学应用化学研究所,山西太原030006)
大豆是我国主要的粮食和油料作物,同时也是重要的饲料作物,但是,近年来我国大豆呈现出产量低、品质差的特点,我国从大豆的净出口国变成了大豆的净进口国[1]。山西省耕地面积少、耕地质量差,同时人口众多,因此,提高大豆的产量和质量迫在眉睫。近年来,山西省对于大豆的研究有了较大的发展,并且发现山西省土壤中99.4%以上的根瘤菌为费氏中华根瘤菌[2]。对此,山西大学应用化学研究所经过几年的努力,利用植物仿生学原理,研制出了一种大豆根瘤促生剂,经过3 a大面积田间试验后发现,在底肥中添加大豆根瘤促生剂后,可以使大豆产量提高30%~50%,中期取样时发现,施加后的大豆植物体根部产生的根瘤明显多于未施加的,且多为有效瘤。大量的研究也表明,大豆结瘤受很多外在因素的影响[3-4]。
结瘤因子作为豆科植物结瘤过程中的信号分子,在豆科植物结瘤和根瘤菌的专一性方面起着举足轻重的作用,它是根瘤菌在根系分泌物(主要为类黄酮类物质)的诱导下产生的一种脂寡糖类化合物[5-6]。同一根瘤菌在不同诱导剂的作用下产生的结瘤因子的种类和数量均不同[7]。侯卫国等[7-8]均用高效液相色谱对结瘤因子进行了检测,所用的检测器均为紫外检测器,但此方法比较复杂,因此,本研究中决定以合适的诱导剂对根瘤菌培养液进行诱导后,以紫外分光光度计对结瘤因子进行检测[9]。
本研究通过大豆根瘤促生剂对费氏中华根瘤菌产结瘤因子的影响,初步确定大豆根瘤促生剂的作用机理,进而使大豆根瘤促生剂可以更好地应用于大豆生产中。
1 材料和方法
1.1 材料
费氏中华根瘤菌,购自中国科学院微生物研究所。晋豆25号,由山西省农业科学院作物科学研究所提供。大豆根瘤促生剂、752型紫外分光光度计,由山西大学应用化学研究所提供。染料木黄酮,购自sigma公司。
培养基(1000mL):葡萄糖15g,K2HPO40.39g,(NH4)2SO41.5 g,KH2PO40.61 g,MgSO40.6 g,豆芽200 g,琼脂 15~20 g,NaCl0.1 g,pH 值 7.0(液体培养时不加琼脂)。
1.2 方法
1.2.1 大豆根瘤促生剂对费氏中华根瘤菌生长的影响 向50mL液体培养基中加入费氏中华根瘤菌进行摇床培养,培养2 d后得到种子液。向50mL液体培养基中加入0.5mL种子液和0.05mL大豆根瘤促生剂进行培养,每1 h取样1次,于600 nm处测定吸光度值。每个样品取3个重复求平均值,以菌体培养基为对照,分别绘制添加根瘤促生剂和不添加根瘤促生剂菌体的生长曲线。同时采用平板菌落计数法对施用过根瘤促生剂的田间土壤样品中的根瘤菌进行计数。
1.2.2 费氏中华根瘤菌产结瘤因子检测波长的确定 (1)结瘤因子的诱导:向培养至对数期的菌液中加入0.1%的染料木黄酮后继续培养2 d。(2)结瘤因子的提取:将培养液在10 000 r/min下离心30min,取上清液;用1/4体积的正丁醇抽提上清液3次,取正丁醇相;减压蒸发去有机相,以双蒸水溶解剩余物;以等体积乙酸乙酯洗涤3次,取水相。(3)结瘤因子检测波长的确定:将处理过的添加染料木黄酮的培养液(以处理过的不加染料木黄酮培养液为空白对照)进行全波长扫描后,即可得到费氏中华根瘤菌结瘤因子的检测波长。
1.2.3 大豆根瘤促生剂对费氏中华根瘤菌产结瘤因子的影响 根系研磨物的制备:大豆水培5 d后选取数颗,剪下根部,加10mL无菌水和少量石英砂在研钵中进行研磨,研磨均匀后用滤纸进行过滤,得到的滤液用0.22μm滤膜过滤后冷藏备用。
分别向培养至对数期的菌液中加入0.1%大豆根瘤促生剂、0.1%的根研磨液、0.1%大豆根瘤促生剂+0.1%的根研磨液,于1.2.2确定的检测波长处进行比对。
1.2.4 大豆根瘤促生剂作用下费氏中华根瘤菌产结瘤因子培养条件的优化
1.2.4.1 培养基对费氏中华根瘤菌产结瘤因子的影响 分别以市售绿豆芽、黄豆芽及实验室培养的黄豆芽配制培养基,在培养至对数期时分别向3种不同的培养基中加入0.1%的根研磨液后再培养2 d,诱导处理后于1.2.2确定的检测波长处进行比对,结瘤因子的诱导方法同1.2.2。
1.2.4.2 诱导剂对费氏中华根瘤菌产结瘤因子的影响 将菌液培养至对数期时分别加入0.1%全豆芽研磨液+0.1%大豆根瘤促生剂、0.1%全豆芽研磨液、0.1%大豆根瘤促生剂、0.1%根研磨液,继续培养2 d,进行诱导处理后,于1.2.2确定的检测波长处进行比对。
1.2.4.3 诱导剂用量对费氏中华根瘤菌产结瘤因子的影响 分别向培养至对数期的菌液中加入 0.1%,0.5%,1.0%,1.5%,2.0%由 1.2.4.2确定的诱导剂培养2 d,诱导处理后于确定的波长处进行比对。
1.2.4.4 温度对费氏中华根瘤菌产结瘤因子的影响 将培养至对数期的费氏中华根瘤菌置于10,15,20,25,30,35,40,45,50 ℃下培养,2 d 后处理,于1.2.2确定的检测波长处进行比对。
2 结果与分析
2.1 大豆根瘤促生剂对费氏中华根瘤菌生长的影响
2.1.1 实验室条件下大豆根瘤促生剂对费氏中华根瘤菌生长的影响 通过添加大豆根瘤促生剂和未添加过的取样后绘制出的菌体生长曲线(图1)可以看出,添加大豆根瘤促生剂后,费氏中华根瘤菌的对数期提前,稳定期持续时间延长,且在相同的培养时间内,添加大豆根瘤促生剂的培养液中的菌体浓度明显高于对照组。

2.1.2 大豆根瘤促生剂对土壤中费氏中华根瘤菌生长的影响 从表1可以看出,添加过不同用量大豆根瘤促生剂的土壤中费氏中华根瘤菌的数量明显高于对照组,且大豆根瘤促生剂的用量越大,费氏中华根瘤菌的数量越多。

表1 大豆根瘤促生剂对土壤中费氏中华根瘤菌生长的影响
2.2 费氏中华根瘤菌产结瘤因子检测波长确定
将添加过染料木黄酮的费氏中华根瘤菌菌液处理后(以未添加过任何诱导剂的菌液(进行相同的诱导处理)为空白对照)进行全波长扫描,得出费氏中华根瘤菌产生的结瘤因子在218 nm处具有吸收峰,即费氏中华根瘤菌产生的结瘤因子的检测波长为218 nm。
2.3 大豆根瘤促生剂对费氏中华根瘤菌产结瘤因子的影响
由图2可知,未添加任何诱导剂的菌液中结瘤因子的OD218为0.018,加入0.1%大豆根瘤促生剂的菌液中结瘤因子的OD218为0.479,加入0.1%根研磨液的菌液中结瘤因子的OD218为0.510。同时,添加0.1%大豆根瘤促生剂和0.1%根研磨液的菌液中产生的结瘤因子的OD218为0.798。可以得出,大豆根瘤促生剂可以诱导费氏中华根瘤菌产生结瘤因子,且大豆根瘤促生剂与根系研磨液对费氏中华根瘤菌产结瘤因子具有相同的作用效果。

2.4 在大豆根瘤促生剂作用下,费氏中华根瘤菌产结瘤因子培养条件的优化
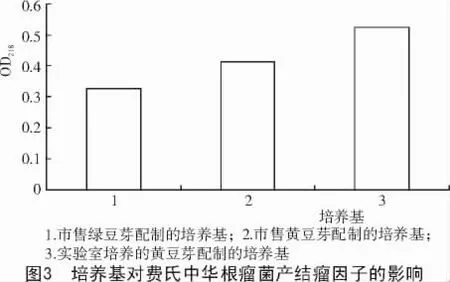
2.4.1 不同培养基对费氏中华根瘤菌产结瘤因子的影响 从图3可以看出,市售绿豆芽配制的培养基产生的结瘤因子的OD218为0.325,市售黄豆芽配制的培养基产生的结瘤因子的OD218为0.413,实验室培养的黄豆芽配制的培养基产生的结瘤因子的OD218为0.525。这可能是因为:(1)绿豆中含有抑菌成分;(2)市售黄豆芽中大部分是添加过尿素的,在制作培养基的过程中并不能完全清除沾染在豆芽上的尿素,而尿素对根瘤菌的生长可能有一定的影响。
2.4.2 不同诱导剂对费氏中华根瘤菌产结瘤因子的影响 从表2可以看出,以不同诱导剂诱导产生的结瘤因子的量不同,从多到少依次为:0.1%全豆芽研磨液+0.1%大豆根瘤促生剂、0.1%全豆芽研磨液、0.1%根研磨液、0.1%大豆根瘤促生剂。由于全豆芽研磨液中含有的类黄酮类物质多于豆芽根研磨液,所以全豆芽研磨液可以诱导产生更多的结瘤因子。

表2 诱导剂对费氏中华根瘤菌产结瘤因子的影响
2.4.3 诱导剂用量对费氏中华根瘤菌产结瘤因子的影响 从图4可以看出,虽然随着诱导剂用量的增加,费氏中华根瘤菌产生的结瘤因子的量也在增加,但是,从1.0%开始,结瘤因子量的涨幅变小,从经济和实用的角度考虑,选用1.0%的诱导剂比较合理。而造成这一情况的原因是在相同的培养环境中可以存在的根瘤菌数是动态平衡的,所以可以利用的诱导剂用量是一定的,过多的诱导剂反而会造成浪费。
2.4.4 温度对费氏中华根瘤菌产结瘤因子的影响 由图5可知,随着温度的升高,费氏中华根瘤菌产生的结瘤因子的浓度逐渐增加;但30℃以后,随着温度的升高,结瘤因子的浓度逐渐减小。这可能是因为,结瘤因子的产生与酶的作用有关,随着温度的升高,酶的活性逐渐提高;但过高的温度可能会使酶失活,从而导致根瘤菌产生的结瘤因子的量减少。同时,30℃时菌体活力较高,也可能会促进根瘤菌产生和分泌结瘤因子。


3 结论
本研究得出,大豆根瘤促生剂不仅可以促进费氏中华根瘤菌的生长,而且可以在一定程度上诱导费氏中华根瘤菌产生结瘤因子;作为大豆结瘤中的关键因子,结瘤因子量的增加对大豆结瘤具有促进作用。当然,由于一些因素的影响,本试验只进行了很小一部分的研究,还不能完全确定该根瘤促生剂的作用机理。添加大豆根瘤促生剂后对费氏中华根瘤菌产生的结瘤因子的结构是否有影响、根瘤促生剂能否对其他豆科植物或非豆科植物的结瘤及固氮具有影响等均是以后研究的重点。为使大豆根瘤促生剂更好地应用于农业生产,还需要进行更深入和彻底的研究。
[1] 瞿商,赵德馨.中国大豆进出口形势的逆转与粮食安全——百年间中国大豆国际贸易地位的逆转及其历史启示 [J].贵州财经学院学报,2011(2):43-48.
[2] 史清亮,白成云,温月香,等.山西省费氏中华根瘤菌数量分布及特性探析[J].中国生态农业学报,2007,15(3):120-122.
[3] 史清亮,马玉珍,贺跃武,等.山西土著花生根瘤菌的数量分布及其共生结瘤固氮特性 [J].山西农业科学,1999,27(2):49-51.
[4] 王树起,韩晓增,乔云发,等.施氮对大豆根瘤生长和结瘤固氮的影响[J].华北农学报,2009,24(2):176-179.
[5] 王逸群,赵仁贵,王玉兰,等.豆科植物结瘤及其结瘤的分子基础[J].吉林农业科学,2001,26(5):20-25.
[6] 张林维.根瘤菌脂壳寡糖结瘤因子研究概况[J].微生物学通报,1999,26(6):440-442.
[7] 侯卫国.慢生根瘤菌结瘤因子的研究[D].南京:南京师范大学,2007.
[8] 王安兆.结瘤因子诱导紫花苜蓿根毛变形过程中钙与微丝作用的初步研究[D].北京:中国农业大学,2004.
[9] 杨国平,朱军,徐苏芸,等.根瘤菌结瘤因子的微量生物检测法[J].微生物学通报,1996,23(1):56-57.
