疏水性农药对费氏弧菌毒性的微板发光测定法研究
2019-01-09阳辛凤葛会林李萍萍刘春华
阳辛凤, 葛会林, 李萍萍, 张 群, 刘春华
(中国热带农业科学院分析测试中心/农业部热带农产品质量监督检验测试中心(海口)/海南省热带果蔬产品质量安全重点实验室,海南海口 571101)
农产品农药残留引起的质量安全问题是国内外普遍关注的焦点,仪器分析是对农产品农药残留进行检测的重要手段。然而,仪器分析常常是对一定范围内的特定农药进行检测,在残留农药不明确的情况下,发光菌检测法(luminescence bacteria test,简称LBT)以其快速、简单和可进行综合毒性评价而比仪器分析更具优势。发光细菌(luminescence bacteria)是一类能在生长过程中发出450~490 nm可见荧光的非致病性革兰氏阴性菌,发光菌法是通过发光菌与有毒物直接接触而引起发光值发生变化的直接生物毒性测试方法[1]。该方法最初被应用于饮用水安全评价,例如,国际标准组织(international organization for standardization,简称ISO)颁布了ISO 11348-3—2007《水质水样对弧菌类光发射抑制影响的测定(发光细菌试验)》[2],我国颁布了应用发光菌明亮发光杆菌进行水质毒性测试的国家标准GB/T 15441—1995《水质急性毒性的测定 发光细菌法》[3]。LBT还可应用于水质状况评价[4-5]、环境污染毒性评价和检测[6]、重金属毒性评价[7]、农产品农药兽药残留检测[8-10]、食品中食品添加剂检测[11-12]和农产品生物毒素检测[13]等。利用发光细菌对农产品中农药、兽药、抗生素等污染物进行风险评估是目前农产品质量安全研究领域新热点,与仪器分析相比,LBT具有操作简单、快速、灵敏和成本低等优点,在农产品农药残留快速检测中有着广泛应用的前景,对农产品质量安全具有指导意义。
在农产品质量安全风险评估领域,目前LBT多用于亲水性农药的检测,如敌百虫、乐果、乙酰甲胺磷、抗蚜威、甲霜灵等[10,14]。发光菌菌悬液是以水为连续相的混合体系,亲水性农药溶液与菌悬液混合后,农药通过与发光菌直接接触抑制发光。然而,在农业生产中常用农药多数是疏水性的,在建立LBT方法时,以水为溶剂配制疏水性农药溶液时须要添加助溶剂,常用的是二甲基亚砜(DMSO)[14-15]。杨洁等以1%二甲基亚砜(dimethyl sulfoxide,简称DMSO)为助溶剂溶解疏水性农药莎稗磷、高效氯氰菊酯、氰戊菊酯时得到的溶液呈乳浊液状态[14]。这表明疏水性农药在1% DMSO溶液中溶解性差,由此可能造成LBT结果与真实毒性有差异。本研究发现,以1% DMSO为溶剂时,多菌灵等疏水性农药溶解性很弱,浓度越高,溶液越浑浊,伴有沉淀析出,在1~500 μg/mL的宽广浓度范围,费氏弧菌与疏水性农药作用后其发光抑制率变化幅度小,不能获得发光抑制率在0~100%范围的剂 量- 效应曲线(dose-response curve,简称DRC);而以甲醇为溶剂时,可以在较窄的浓度范围获得发光抑制率在0~100%范围的DRC。以甲醇作为疏水性农药的溶剂进行LBT测定目前未见报道,甲醇在众多有机溶剂中对发光菌的毒性是最小的[16-17],而且对农药溶解性能极佳,是潜在的可用于LBT的溶剂。
本研究旨在通过分析以甲醇为溶剂时疏水性农药对费氏弧菌发光的抑制效应,探索疏水性农药影响费氏弧菌发光的规律,为初步建立利用发光细菌快速检测农产品中疏水性农药残留的方法提供理论依据。
1 材料与方法
1.1 仪器与试剂
Synergy 2多功能微孔板检测仪(美国Bio-Tek)、HVE-50全自动高压灭菌锅(日本Hirayama)、Milli-Q®超纯水系统(美国Millipore公司)、QYC-2012C 全温培养摇床(上海福马实验设备有限公司)、Eppendorf移液器(德国Eppendorf)、96微孔板(美国Corning)。
标准品多菌灵、溴氰菊酯、毒死蜱(纯度均为98.5%)均购自德国Dr Ehrenstorfer GmbH公司;甲醇、乙腈均为色谱纯(美国Fisher);Difco海生菌肉汤2216购自美国BD公司。
1.2 试验菌种
菌种为1H00021费氏弧菌(Vibriofisheri),购自中国海洋微生物菌种保藏管理中心。
费氏弧菌液体培养基:称取2216海生菌肉汤粉末 37.4 g,加水1.0 L,加热搅拌使充分溶解,分装至三角瓶,121 ℃ 条件下高压灭菌20 min。
费氏弧菌的摇瓶培养:挑取1环费氏弧菌斜面培养物,接入海生菌肉汤2216液体培养基中,于22 ℃、120 r/min条件下摇瓶培养16 h。培养好的菌液在暗室内以肉眼可见明亮的荧光,取100 μL菌液于96微孔板中,放入多功能微孔板检测仪上检测,菌液发光值(relative light unit,简称RLU)不低于100万光子数。
1.3 农药对发光菌毒性的测定
多菌灵、溴氰菊酯、毒死蜱分别溶解于甲醇中,再以甲醇进行稀释,配制得到系列浓度的溶液,通过预备试验获得适宜的浓度范围,确保系列浓度的农药溶液对费氏弧菌1H00021的发光抑制率在0~100%之间均匀分布。
3种疏水性农药对费氏弧菌发光毒性作用体系总体积为200 μL。移取系列浓度的农药溶液各30 μL,分别加入到96微孔板中(第1横排),以同体积甲醇为空白对照,每个浓度重复3次(即第2、第3横排为第1横排的重复),最后加入 170 μL 费氏弧菌1H00021菌悬液,立即将96微孔板放入多功能微孔板检测仪,振板5 min,测定毒物与发光菌作用 20 min 时的发光强度。
采用空白样品发光强度平均值I0与农药各浓度样品对应的发光强度平均值I计算对费氏弧菌的毒性,以发光抑制率E表示[8]:E=(1-I/I0)×100%。
1.4 剂量-效应曲线(DRC)模拟
采用Origin 8.5统计软件进行数据处理和统计分析,拟合剂量-效应曲线,根据拟合模型利用Origin 8.5 “From Y to X”功能计算得到农药与费氏弧菌1H00021作用20 min时的半效应浓度(EC50),并以此判断农药对费氏弧菌1H00021毒性的大小。
2 结果与分析
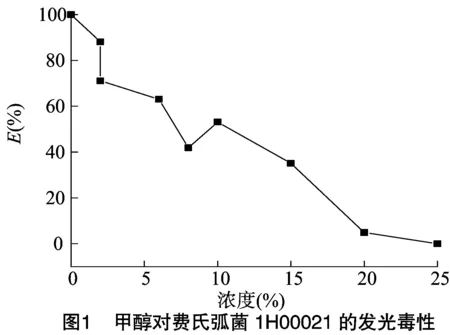
2.1 甲醇对费氏弧菌的发光毒性
LBT毒性测定时,低浓度二甲基亚砜水溶液(DMSO≤1%)常被用于溶解疏水性农药,如阿维菌素等[14]。但在本试验中发现,多菌灵等3种目标农药在1% DMSO水溶液中均有颗粒析出现象,因此未采用1% DMSO作为本试验的溶剂。甲醇对农药溶解性能极佳,而且有研究表明[16-17],常用有机溶剂中,乙腈、甲醇、乙醇、丙酮、乙醚、四氢呋喃、异丙醇等7种有机溶剂对淡水发光菌青海弧菌Q67均有抑制毒性,其中甲醇毒性最小,因此甲醇是潜在的可用于LBT的溶剂,但甲醇对费氏弧菌毒性尚未见报道。本研究测定甲醇对费氏弧菌发光强度的影响(图1),结果表明,LBT检测体系中随着甲醇浓度的增加,费氏弧菌的发光强度减弱。甲醇为亲核试剂,具有负电性,是氢键的接受体,当发光细菌接触到甲醇时,甲醇能与发光菌体细胞内的黄素单核苷酸发生氢键键合,从而阻碍氢的传递,进而抑制发光菌的发光[16]。
2.2 疏水性农药对费氏弧菌发光毒性检测体系的建立
毒物进入发光菌生长环境中后,通过直接抑制细菌发光反应过程的酶活性,或是抑制细菌胞内发光反应相关的代谢反应进而抑制发光强度。本试验设置LBT体系总体积为 200 μL 及作用于费氏弧菌时间为20 min,通过测定不同体积比的农药溶液作用于费氏弧菌的发光毒性,确定检测体系中疏水性农药溶液与费氏弧菌菌悬液的适宜体积比(图2);通过测定不同浓度农药溶液与费氏弧菌接触时间在5、10、15、20、25、30 min下的发光抑制率,确定几种疏水性农药与费氏弧菌接触反应的适宜时间(图3)。

由图2可知,检测体系总体积为200 μL及作用时间为 20 min 时,在疏水性农药溶液与费氏弧菌菌悬液的体积比分别为10/190、25/175、30/170、40/160这4种不同比例下(甲醇比例依次增加),各稀释度的多菌灵溶液(0.2~100.0 μg/mL)对费氏弧菌1H00021的发光抑制强度有明显区别。总体来说,4种比例下费氏弧菌1H00021的发光值均随着多菌灵浓度的增加而下降;随检测体系甲醇比例的增加,费氏弧菌发光值降低。比例为10/190费氏弧菌的发光值最高,但发光值曲线较为平直,即使多菌灵浓度大幅度升高,发光值也仅有微弱下降;发光值最高的原因可能是体系中甲醇比例最低(5%),对发光抑制作用弱;发光值曲线变化较为平缓,原因可能是对费氏弧菌产生发光毒性抑制的仅仅是溶解状态的多菌灵,当水相比例较高,超过一定比例时,多菌灵会沉淀析出,析出的这部分多菌灵对费氏弧菌发光无抑制作用。比例为40/160时,费氏弧菌发光值最低,发光值曲线亦较为平直,原因可能是体系中甲醇浓度过高(20%),甲醇对费氏弧菌产生了强烈抑制。比例为30/170时,费氏弧菌发光值较高,且介于10/190和40/160之间,发光值曲线具有较适宜的斜率,表现为随着多菌灵浓度的升高,发光值也相应降低;发光值较高的原因可能是尽管体系中甲醇达到了15%,但由于费氏弧菌初始发光值高,以及15%甲醇对费氏弧菌发光作用影响有限,故发光值仍然较高;发光值曲线具有较适宜的斜率,原因可能是在30/170的比例下,多菌灵保持了良好的溶解,溶解状态的多菌灵均能充分地与费氏弧菌接触,抑制其发光。可见,体积比30/170是一个平衡点,既不会大幅度抑制费氏弧菌的发光作用,又能兼顾疏水性农药的良好溶解性及毒性,因而农药浓度与发光率之间有良好的相关性。袁东星等认为,即使农药浓度与发光强度的相关性不呈严格的线性关系,在农药残留的实际检测中仍具有实际意义。因为现场快速检测经常要求半定量即可[18]。图2的曲线完全符合这一要求。综合上述结果,以30/170作为疏水性农药LBT方法中农药溶液与费氏弧菌菌悬液的体积比。
图3-a至图3-c分别为多菌灵、溴氰菊酯、毒死蜱与费氏菌接触时间为5~30 min的发光抑制作用曲线。总体来说,费氏弧菌1H00021的相对发光强度随作用时间的延长而下降,多菌灵、溴氰菊酯和毒死蜱与费氏弧菌接触时间为10、15、20、25、30 min的发光抑制作用曲线接近,且略高于接触时间5 min时的发光抑制作用曲线。鉴于不同毒性物质对费氏弧菌发光产生影响的速度不同,本研究以作用20 min时的测定值作为定量研究的数据。

综合以上结果,建立疏水性农药对费氏弧菌1H00021短期微板发光毒性测定方法。疏水性农药溶解于甲醇中,每个微孔的毒性测定体系为200 μL,包括30 μL农药溶液,170 μL费氏弧菌菌悬液,最佳检测时间为20 min。
2.3 3种疏水性农药对费氏弧菌的发光毒性
对发光菌毒性研究表明,在一定质量浓度范围内,农药的质量浓度与发光细菌的发光强度变化呈函数关系,可据此拟合剂量-效应曲线(DRC)对农药进行定量或半定量。本研究应用Origin 8.5线性拟合功能和非线性拟合功能拟合3种农药对费氏弧菌1H00021的剂量-效应关系,拟合模型及相关参数见图4、表1。线性拟合时,毒死蜱相关系数最低,为0.842 8。非线性拟合时,3种疏水性农药拟合模型的相关系数r均大于0.97,DRC都可用Log3P1函数有效表征。因此,虽然线性拟合函数和Log3P1函数都能较好地描述脂溶性农药对费氏弧菌的发光毒性,但Log3P1函数优于线性拟合函数。
利用Origin8.5的“从y至x”功能可计算各个效应下的浓度,如半数抑制浓度EC50等。EC50是农药毒性大小的表征。由表1可知,无论是线性拟合函数,还是Log3P1函数,3种脂溶性农药对费氏弧菌毒性大小顺序均为多菌灵>溴氰菊酯>毒死蜱。然而,由于拟合函数的差异,当函数的相关系数高时,由线性拟合和Log3P1函数计算得到的EC50相同或接近,如多菌灵EC50均为0.024 μg/mL。然而,随着相关系数降低,相关性逐渐减弱,由线性拟合和Log3P1函数计算得到的EC50的差异逐渐增大,如溴氰菊酯、毒死蜱。
有毒物质对发光细菌发光的抑制,主要源于对发光反应核心荧光素酶活性的抑制,其遵循酶活性抑制动力学原理,因此以毒物浓度对发光抑制率作线性回归方程不一定是最适合的[19]。本试验同样表明线性拟合的局限性如多菌灵,线性拟合与非线性拟合结果是一致的,但对于溴氰菊酯和毒死蜱,非线性拟合得到的函数具有更好的相关性。
3种疏水性农药对费氏弧菌的发光抑制率随污染物浓度的增加而逐渐增大。与溴氰菊酯、毒死蜱相比,多菌灵对费氏弧菌的EC50最小,毒性效应最强,这可能是因为多菌灵属于杀菌剂,而溴氰菊酯和毒死蜱属于杀虫剂,费氏弧菌对杀菌剂毒性更为敏感。
已报道的毒物DRC具有多种形状,主要类型有线性[14]、S形[8,16,20]和J形[16]等。郭柔杉等采用费氏弧菌评价果汁中亚硝酸钠、食用色素的生物毒性时[11-12]、李翔等评价黄曲霉毒素对费氏弧菌发光毒性时[13],以毒物浓度为横坐标绘制的DRC曲线是非线性的,而以毒物浓度对数(lgC)为横坐标绘制的DRC曲线则是线性的。本研究拟合得到的DRC呈S形,与汤淼等的研究结果[8]一致。
以上结果表明,3种疏水性农药的浓度与费氏弧菌发光的抑制存在定量关系,因此可以利用费氏弧菌发光法快速评价其生物毒性。
3 结论
建立疏水性农药对费氏弧菌1H00021短期微板发光毒性测定方法。疏水性农药溶解于甲醇中,每个微孔的毒性测定体系为200 μL,包括30 μL农药溶液、170 μL费氏弧菌菌悬液,最佳检测时间为20 min。拟合得到疏水性农药对1H00021毒性的DRC,以EC50为表征的3种疏水性农药对费氏弧菌1H00021的发光毒性顺序为多菌灵﹥溴氰菊酯﹥毒死蜱。3种疏水性农药对费氏弧菌1H00021的发光毒性存在良好的剂量-效应关系,可以利用费氏弧菌微板发光法快速评价疏水性农药的生物毒性。

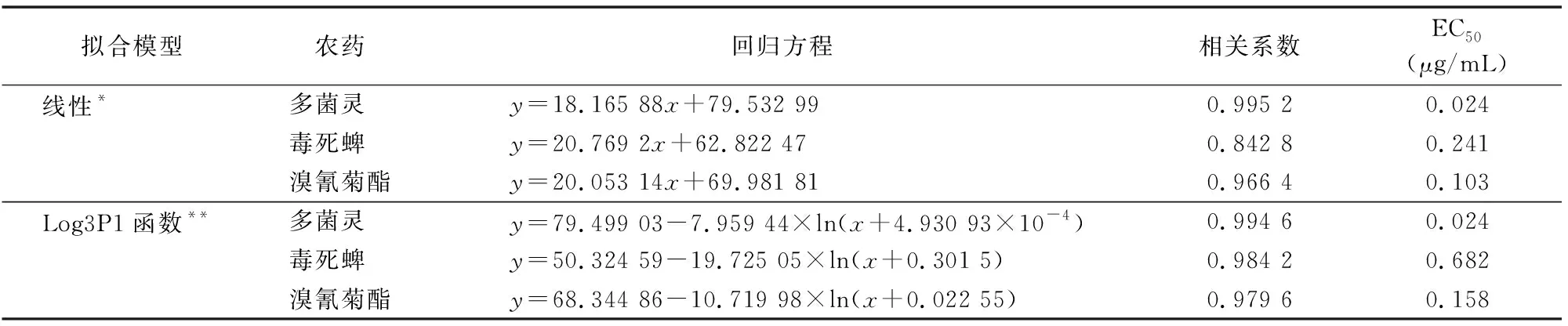
表1 3种农药的线性拟合和Log3P1函数拟合结果
注:y=a+b×x,其中,x为浓度值(C)的对数,a、b分别是用Origin 8.5对效应y和浓度x进行拟合得到的参数。y=a-b×ln(x+c),其中a、b、c分别是用Origin 8.5对效应y和浓度x进行拟合得到的参数。
