甘肃中华羊茅内生真菌形态多样性
2011-04-25李春杰
杨 洋,陈 娜,李春杰
(农业部草地农业生态系统学重点开放实验室 兰州大学草地农业科技学院, 甘肃 兰州 730020)
禾草内生真菌是一类在植物体内度过大部分或全部生命周期,而寄主植物不显示外部症状的一类真菌[1],其依靠寄主获得养分,寄主也因为受到内生真菌刺激而增强抗逆性[2],宿主与植物之间有着错综复杂的共生关系[3],与周围环境之间有着密切的相互作用[4]。内生真菌作为一类新的微生物资源引起了各国科研工作者的广泛关注。大量对禾草内生真菌共生体的研究表明,内生真菌增强了共生体的生态适应性[5],同时能够为植物带来多种有益特性,如增强宿主植物抗病虫害能力[6-7]、抗旱[8]、抗寒[9]以及促进植物生长发育[10],提高植物产量,增强其竞争力等[11]。因此,发掘和探索新的禾草内生真菌共生体是内生真菌这一新的微生物资源有效利用的前提条件。
中华羊茅(Festucasinensis)是禾本科多年生疏丛型草本植物,为我国西北、华北、东北和青藏高原等地的常见野生牧草[12],由于其耐寒冷,适应性强,适口性好,耐放牧,是卓越的混播用草种,现已作为高寒牧区草地生产建设的优良栽培牧草。并且中华羊茅在整个生长期内耐热、耐旱、耐寒,许多品种具有草坪草的特征,如植株低矮、叶丛发达、春季返青早,秋季枯黄晚,耐践踏,再生性强,抗病性强[13],是很好的草坪建植草种,尤其在寒地型草坪群落中利用较多[14]。尽管中华羊茅感染内生真菌早已报道[15],但其感染的内生真菌的分离培养及形态学鉴定至今仍是空白。因此对这些特性的深入研究有助于了解内生真菌在植物体内的共生机制,了解禾草-内生真菌共生体的共生特征,为内生真菌在草地农业系统中的应用提供基础[16]。
研究表明,不同植物体内分离得到的内生真菌数量和种类不同,少则几种,多则几十甚至上百种[17],然而从同种植物不同个体分离到的内生真菌种类和数量也有差异。禾草内生真菌形态多样性的相关研究有很多,但对中华羊茅内生真菌的研究报道仅见于金文进等[18]对其菌落生长的生物学与生理学特性的研究,而其多样性的研究尚属空白。因此,作为高寒地区的重要牧草,对其内生真菌的研究亦十分必要。
本研究通过对中华羊茅内生真菌的分离培养,从菌落形态指标和个体形态指标等方面对中华羊茅内生真菌各个菌株之间的形态多样性作了初步探讨,旨在为进一步研究中华羊茅-内生真菌共生体及内生真菌与宿主之间的关系奠定基础。
1 材料与方法
1.1试验材料 中华羊茅成熟植株及种子于2008年9月采集自甘肃甘南的甘加草原(甘加)和桑科草原(桑科),并将采回的种子在5 ℃条件下保存于农业部牧草与草坪草种子质量检测中心种子贮藏室。成熟的中华羊茅植株用于进行内生真菌检测,种子用于内生真菌的分离培养。
1.2方法
1.2.1内生真菌的检测 参照李春杰[19]的方法,通过对400份植物样本的种子和茎髓部的检测,加苯胺蓝染液染色,在显微镜下观察生长于植物组织间的菌丝体。同时,收集带菌植物样本的种子用于播种,检测4周龄幼苗的带菌率。
1.2.2供试菌株的分离培养 将中华羊茅种子先于70%乙醇消毒5 min,再浸于6%的次氯酸钠中消毒10 min,最后用无菌水冲洗 3次,将消毒好的种子播种于PDA培养基中,每皿20粒,置于25 ℃条件下恒温培养。每日观察,及时移除生长快,易被杂菌污染的种子。40 d后培养基上陆续出现生长缓慢的白色菌落,将其转入新鲜PDA培养基中进一步纯化,保种待用。分离得到的菌株在PDA平板上25 ℃培养4周,观察菌落特征,记录生长速度。在水琼脂培养基中,25 ℃恒温条件下进行产孢,3周后观察分生孢子的着生特点,测量并记录分生孢子及孢子梗的形态学特征。
1.2.3内生真菌的形态学鉴定和聚类分析 聚类分析是根据研究对象的特征对其进行分类的一种分析技术,将相近性质的个体分为一类,使得高度同质性的个体成为一类,则不同类间有着较高异质性。在对分离菌株进行聚类的过程中,将菌落形态、分生孢子大小、分生孢子梗长度等可甄别不同菌株的观测指标作为统计量,根据这些指标作为聚类的依据,将相似度不同的菌株进行依次划分,直到聚合完所有指标。采用UPGMA法进行聚类分析,建立亲缘关系树图。在解剖镜及显微分析系统下观察菌落特征和生殖器官的显微结构,参考与分离菌株相似种的原始文献对其进行形态学的初步鉴定,并结合宿主植物的特性,参照模式菌株的特征鉴定其分类地位。
2 结果与分析
2.1中华羊茅内生真菌的检测与分布 在对400份植物样品的所有地上部分的检测中,发现带菌率达到了98%,叶鞘、茎秆、种子里都检测到了内生真菌的存在。在叶鞘及茎秆组织中,菌丝细长,单行,粗细均匀,分隔明显,少分叉,呈波浪状弯曲,平行于细胞长轴排列在细胞间隙中,未发现菌丝体穿透植物细胞或细胞层(图1)。在种子中,菌丝体分布于糊粉粒细胞之间,菌丝粗细不均匀,分布无序,弯曲程度较高(图2)。所有植物材料中均未见有真菌子座产生,也没有观察到菌丝体周围的植物细胞有坏死、变色等症状。真菌菌丝体生活在宿主细胞间隙,并不破坏宿主细胞。初步认为是禾本科植物的Neotyphodium内生真菌菌丝。对采集到的野生中华羊茅样品的叶片、叶鞘和茎秆部位的内生真菌进行分离,都能得到相应的菌株,这表明中华羊茅内生真菌在其宿主植物的各组织内普遍存在,且在植物地上部分也有着系统的分布。此外,在感染内生真菌的种子当中发现大量典型的内生真菌菌丝体,并且对带菌样本的种子播种后的4周龄幼苗进行检测后发现,幼苗的带菌率分别为90.4%和89.5%(表1),说明中华羊茅中所带的内生真菌能够通过宿主植物的种子进行垂直传播,这也证明了中华羊茅-内生真菌共生体在自然界中形成了稳定的共生体系。



表1 中华羊茅成株、种子及幼苗内生真菌带菌率
2.2中华羊茅内生真菌的分离培养及形态学特征 本研究中的供试菌株分离自甘肃甘南主要牧区天然草地采集的中华羊茅,共得到菌株48株,在PDA培养基上25 ℃培养4周后可形成具有典型特征的菌落,获得表型稳定的菌株,菌落特征及孢子形态见表2。

表2 分离菌株的主要形态学特征
在PDA培养基上,菌落在外观和生长特征上均存在着一定差异。菌落颜色多为白色,少数为浅灰色;质地有的呈棉状,有的为更加致密毡状,有的菌落产生少量的气生菌丝,有的则无;从菌落正面有的中心高度隆起、表面的菌褶如同脑状,有的则紧贴培养基生长呈蜡状。分离得到的48个菌株无论从菌落颜色、质地等表型特征,还是从孢子形态及孢子大小,都呈现出了丰富的多样性(表2)。最终根据培养物的形态学特征,可以将分离菌株划归为3个形态群,聚类结果见图3,具体形态特征描述如下:
ZHYM-Ⅰ型:25 ℃培养4周,菌落直径为12~16 mm,生长速度缓慢。菌落正面白色,棉状,质地紧密,中央隆起如脑状,表面褶皱或有回沟,背面深褐色或近黑,有龟裂(图4)。水培养4 周后,Ⅰ型菌株菌丝体可产生成熟孢子。分生孢子单个顶生,呈弯钩形或镰刀形,孢子平均大小(7.5~17.9)μm×(1.4~2.3) μm。菌丝基部生出分生孢子梗,直立或略弯曲,顶部较细,大小(10.5~18.1) μm×(1.3~2.1) μm,底端无隔,营养菌丝光滑透明,直径1.0~2.1 μm (图5)。
ZHYM-Ⅱ型:25 ℃培养4周,菌落直径为17~23 mm,生长速度较快。菌落正面白色棉状,质地紧密光滑,紧贴培养基生长,菌落背面褐色,有龟裂(图4)。菌丝体水培养4周后产生成熟孢子。分生孢子单个顶生,呈半月形、舟形或肾形,孢子平均大小为(5.0~13.0) μm×(1.9~3.0) μm。分生孢子梗略弯曲,顶部较细,大小为(18.0~27.5) μm×(0.9~2.5) μm,底部无隔,营养菌丝光滑透明,直径为0.9~2.6 μm (图5)。
ZHYM-Ⅲ型:25 ℃培养4周,菌落直径为15~26 mm,生长速度较快。菌落正面白色或灰白色,蜡状,紧密光滑,菌落背面褐色(图4)。菌丝体水培养4周后产生成熟孢子。分生孢子单个顶生,无色透明呈椭圆或肾形,孢子平均大小为(4.5~8.0)μm×(2.0~4.6) μm。分生孢子梗直立,顶端变尖,为(8.5~20.3) μm×(1.5~2.0) μm,基部无隔膜,营养菌丝光滑透明,直径1.3~2.5 μm (图5)。

图3 基于形态性状的48株内生真菌菌株聚类分析

图4 从中华羊茅中分离出的内生真菌菌落
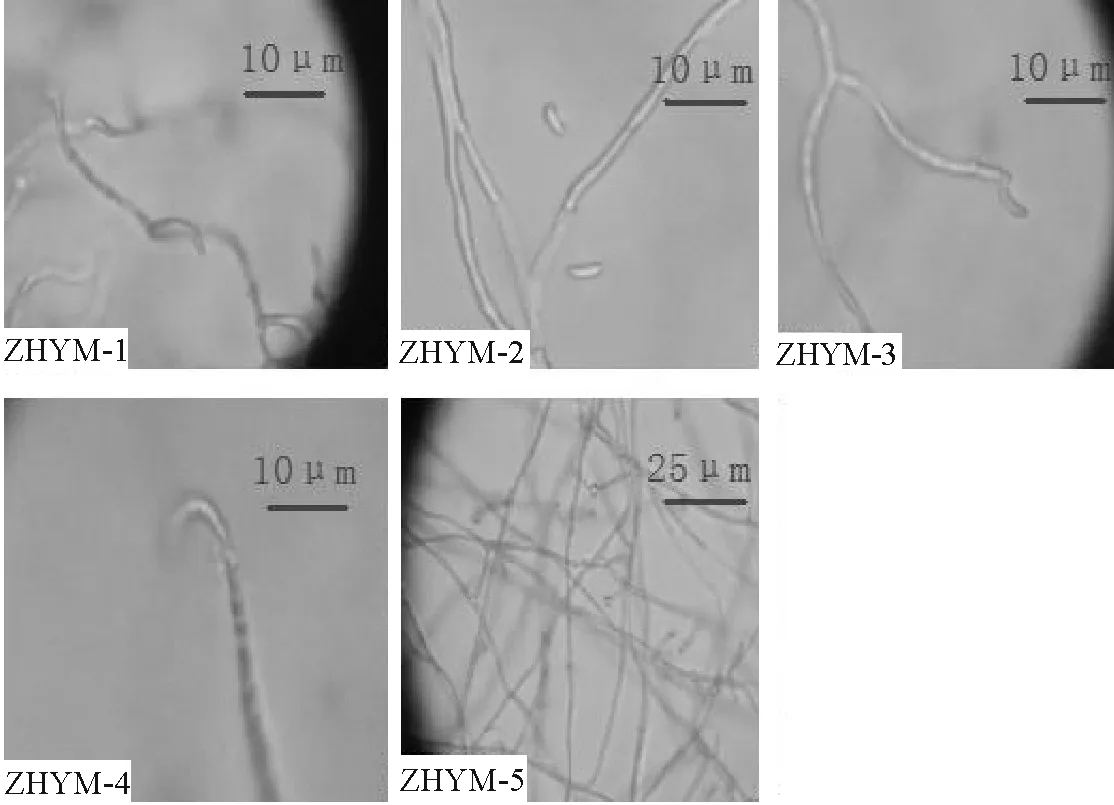
图5 中华羊茅内生真菌的孢子及孢子梗形态
3 讨论
本研究利用形态学的方法对从野生中华羊茅中分离出的内生真菌做了初步鉴定,48个菌株可能均属Neotyphodium属内生真菌,具体种的分类地位有待进一步进行系统发育学分析后加以确定。
禾本科植物内生真菌具有一定的组织特异性,只存在于植物的叶鞘、茎秆和种子糊粉层中,并且在不同部位的菌丝形态有一定的差别[20-21]。由于Neotyphodium属内生真菌数量较多,因此其不同种的内生真菌,在菌落颜色、质地、分生孢子及分生孢子梗的形态和大小上差异明显,能够显示出丰富的形态多样性[22-23]。本研究对分离得到的所有菌株进行了植物体内分布特征、培养特性、形态学特征以及表型特征的比较,并根据这些信息进行了聚类分析。结果表明,试验中分离得到的Neotyphodium属内生真菌在分生孢子和孢子梗的形态和大小范围均有变化;在菌落形态、生长速度等方面也存在差异。说明内生真菌在与植物长期的相互作用中显示出了丰富的多样性。金文进等[18]曾对中华羊茅内生真菌不同菌株之间,在相同温度和pH值下,菌落生长的差异、对碳源和氮源的利用能力以及不同培养基上的产孢能力、产孢数量等方面做了研究,进一步体现了中华羊茅内生真菌的生物学与生理学特性方面的多样性。在同种宿主植物中一般可分离到多种内生真菌菌株[24]。本研究在野生中华羊茅中共分离出3个不同形态群的内生真菌菌株,表明天然禾草中内生真菌有着较高的多样性,体现了中华羊茅内生真菌丰富的种质资源。在内生真菌的分离过程中也发现,由于分离株间存在的基因异质性导致同一分离株的内生真菌在纯化过程中会产生多个形态群,且同一形态群内的不同分离株的菌落形态也不相同。基因突变引起基因异质性,这种现象在内生真菌中广泛存在,导致了同菌种不同分离株在形态和生物碱等代谢物的产生上有很大程度的不同[25]。菌落形态的差异同样也是对基因异质性的反映,48株中华羊茅内生真菌菌株在PDA培养基上的形态与生长特性表现出了较高的多样性,菌株的表型特征除了受到培养基的营养成分组成影响之外,主要决定于自身的遗传组成特征[26],本研究中的菌株在相同条件下表现出各异的外部特征,很可能也是其遗传多样性的外在表现。
[1] Siegel M R,Latch G C M,Johnson M C.Fungal endophytes of grasses[J].Annual Review of Phytopathology,1987,25:293-315.
[2] Elbersen H W,West C P.Growth and water relations of field-grown tall fescue as influenced by drought and endophytes[J].Grass and Forage Science,1996,51(4):333-342.
[3] 詹漓晖,纪燕玲,于汉寿,等. 禾本科植物内生真菌研究8——中国部分地区拂子茅属植物Neotyphodium属内生真菌分布及形态学特征[J].草业科学,2009,26(1):13-18.
[4] Clay K.Clavicipitaceous endophytes of grasses: Their potential as biocontrol agents[J].Mycological Research,1989,92(1):1-12.
[5] Clay K,Schardl C.Evolutionary origins and ecological consequences of endophyte symbiosis with grasses[J].The American Naturalist,2002,160(4):99-127.
[6] Hoveland C S.Importances and economic significance of theAcremoniumendophytes to performance of animals and grass plant[J].Agriculture,Ecosystems and Environment,1993,44:3-12.
[7] 黄东益,黄小龙,Segenet K.旗草内生真菌与旗草抗病性的研究[J].草业学报,2009,18(2):39-45.
[8] 陈娜.醉马草遗传多样性及内生真菌对其抗寒性影响[D].兰州:兰州大学,2008.
[9] 李飞,李春杰.内生真菌对禾草植物抗旱性的影响[J].草业科学,2006,23(3):57-62.
[10] 任安芝,高玉葆.禾草类内生真菌的研究进展[J].微生物学通报,2004,31(2):130-133.
[11] 南志标.草坪草病害综合防治的原则与要点[C].北京:面向21世纪的中国草坪科学与草坪业学术讨论会,1999.
[12] 师尚礼,李锦华.羊茅属两种牧草生态适应性及其栽培技术[J].草地学报,2006,14(1):39-42.
[13] 师尚礼.羊茅属牧草的生物学特性分析及其利用[J].草原与草坪,2000(3):44-46.
[14] 师尚礼,李温.羊茅属牧草和草坪草的综合评价[J].甘肃农业大学学报,2000,35(2):127-131.
[15] 南志标,李春杰.禾草内生真菌共生体在草地农业系统中的作用[J].生态学报,2004,24(3):605-616.
[16] 申靖,陶文文,陈昌,等.禾本科植物内生真菌研究9——Epichloyangzii的种传特征及其在宿主体内的分布[J].草业科学,2009,26(6):146-151.
[17] Welty R E.Barker R E,Azevedo M D.Response of field-grown tall fescue infected byAcremoniumcoenophialumtoPucciniagraminissubsp.graminicola[J].Plant Disease,1991,75(9):883-886.
[18] 金文进,李春杰,南志标.中华羊茅内生真菌Neotyphodiumsp.生物学与生理学特性的研究[J].菌物学报,2009,28(3):363-369.
[19] 李春杰.醉马草内生真菌共生体生物学与生态学特性的研究[D].兰州:兰州大学,2005.
[20] White J F Jr.The widespread distribution of endophytes in the Poaceae[J].Plant Disease,1987,71:340-342.
[21] White J F,Jr.,Morgan-Jones G,Morrow A C.Taxonomy,lifecycle,reproduction and detection ofAremoniumendophytes[J].Agriculture,Ecosystems and Environment,1993,44:13-37.
[22] Christensen M J,Latch G C M.Variation among isolates ofAcremoniumendophytes (A.coenophialumand possiblyA.typhinum) from tall fescue(Festucaarundinacea)[J].Mycological Research,1991,95(9):1123-1126.
[23] Christensen M J,Latch G C M,Tapper B A.Variation within isolates ofAcremoniumendophytes from perennial ryegrasses[J].Mycological Research,1991,95(8):918-923.
[24] Schulthess F M,Faeth S H.Distribution,abundances,and associations of the endophytic fungal community of Arizona fescue (Festucaarizonica)[J].Mycologia,1998,90(4):569-578.
[25] Heeswijck R,McDonald G.Acremoniumendophytes in perennial ryegrass and other pasture grasses in Australia and New Zealand[J].Austrilian Journal of Agriculture Research,1992,43(8):1683-1709.
[26] 魏宇昆,高玉葆,李川,等.内蒙古中东部草原羽茅内生真菌的遗传多样性[J].植物生态学报,2006,30(4):640-649.
