多叶苜蓿自交S1代的胚挽救培养
2011-04-25魏臻武武自念
甘 欣 ,魏臻武,2,武自念,杨 云,赵 艳
(1.甘肃农业大学草业学院,甘肃 兰州 730070; 2.扬州大学动物科学与技术学院,江苏 扬州 225009)
栽培苜蓿(Medicagosativa) 是同源四倍体,常异花授粉植物,是一个杂合的持续分离的群体,且每个个体的遗传基础都不同[1]。在选育特异性状的苜蓿新品种时,多代自交可以得到含有多叶性状纯合个体,提高育种的效率。而在自交常规育种下,存在着严重的自交衰退现象,导致合子胚未发育成熟就中途败育,自交结实率仅为2.2%~6.6%[1-5],给苜蓿自交系育种工作带来很大困难。
随着现代生物工程技术的发展,利用胚挽救技术,在合子胚败育之前进行离体培养,使其发育成成熟的胚,最终得到完整的植株[6-9]。该技术已在小麦(Triticumaestivum)、无核葡萄(Vitisvinifera)、花生(Arachishypogaea)、枣(Ziziphusjujuba)、百合(Liliumbrownii)等植物的杂交育种和胚培养方面开展了相关研究[7-11]。在苜蓿研究方面,McCoy[12]成功应用胚珠培养技术获得了苜蓿种间杂交后代的胚培苗。 Bauchan[13]分别对蜗牛苜蓿(M.scutellata)和紫花苜蓿进行了胚挽救的研究,观察了苜蓿不同时期胚珠的发育过程。结果发现,苜蓿幼胚的发育时期以及不同的激素水平都是影响胚挽救效率的重要因素,并且得到了大量的胚挽救苗。这充分说明借助胚挽救技术进行苜蓿特异性状自交系育种具有广阔的前景。
本研究对苜蓿多叶性状自交系的实生种胚进行离体培养,探讨了不同取材时期、不同单株、不同浓度的6-BA(6-苄氨基嘌呤)和KT(激动素)对苜蓿胚挽救的影响,以期为苜蓿胚挽救育种提供依据,并为苜蓿特异性状自交系结实率低等方面的研究提供有效的解决途径。
1 材料与方法
1.1供试材料 从84个不同来源苜蓿品种(系)中,根据分子标记多态性和田间性状,筛选600个优良特异单株进行移栽,通过3年田间选择,从中筛选多叶性状表现优良的单株自交,获得多叶自交系。将自交后代S1于2007年9月种植于扬州大学实验农牧场,经2年观测从成活的80个单株中选取了3株多叶表达稳定,且多叶率高的S1代单株。单株号为MFS5、MFS42、MFS46(表1)。
1.2试验方法
1.2.1自交方法 苜蓿自交试验于2009年5月14日在扬州大学实验农牧场进行,对3个自交S1代单株整株罩蚊帐隔离,选取健康枝条上的小花序,摘除已授粉和花序顶端未成熟的花蕾,将剩余小花剥蕾自交后用蜡纸纸袋套上,挂牌标记。每个单株分别做400个花序,授粉10 d后去袋。
1.2.2苜蓿败育率调查 在自交授粉后40 d,对自交系3个单株进行败育率调查[7,12-16]。随机选取荚果100粒,重复3次,顺荚果螺旋方向剖开,用镊子剥出幼胚,凡幼胚干瘪,皱缩或种壳内空的,皆视作败育,并统计败育率。

表1 3份苜蓿自交系试材的植物学特征

1.2.3材料灭菌与接种 从授粉后20 d开始,每隔5 d采集,将采集到的材料暂保存于4 ℃冰箱。接种前用自来水将荚果冲洗30 min,然后用70%乙醇浸润30 s,无菌水冲洗3次,在无菌环境下用0.1%的升汞浸泡20 min,无菌水漂洗5次。用剪刀顺荚果螺旋方向剪开,用手术刀和镊子剥掉种皮,挑出幼胚接种到培养基上,每个培养皿接种12粒。
1.2.4苜蓿胚挽救最佳时期的选择 从自交授粉后20 d开始,每隔5 d采集荚果,到授粉40 d结束。灭菌后,剥出幼胚,将其接种在MS+0.5 mg/L IAA+0.05 mg/L 6-BA基本培养基上,蔗糖30 g/L,琼脂7 g/L,pH值5.8~6.1。每个材料接种10皿,12粒/皿。接种后将培养皿放入25 ℃的暗培养箱中暗培养3~5 d后转入温度为25 ℃、光强1 500~2 000 lx、光照时间16 h/d、湿度35%的培养箱内培养,2周后统计胚的萌发情况。
1.2.5苜蓿胚挽救激素水平设置 采集胚挽救最佳时期的材料,分别接种于10种培养基上,培养基的配方如下:以MS+0.5 mg/L IAA,蔗糖为30 g/L,琼脂7 g/L,pH值5.8~6.1为基本培养基。分别添加5个不同梯度水平的6-BA (0.01、0.03、0.05、0.07、0.09 mg/L)和5个不同梯度水平的KT(0.01、0.03、0.05、0.07、0.09 mg/L)于培养基中;每种培养基接种10皿,12粒/皿。接种后将培养皿放入25 ℃的暗培养箱中培养2~3 d后转入温度为25 ℃、光强1 500~2 000 lx、光照时间16 h/d、湿度35%的培养箱内培养。
1.2.6幼胚愈伤组织的诱导及不定芽的分化 将萌动的苜蓿幼胚转接到MS+2.0 mg/L 2,4-D+0.1 mg/L 6-BA,蔗糖30 g/L,琼脂6.5 g/L,pH值5.8~6.1的培养基上。接种后放入温度为25 ℃、光强1 500~2 000 lx、光照时间16 h/d、湿度35%的培养箱内培养。20 d后调查愈伤组织的诱导率。从生长旺盛且较致密的愈伤组织中切取不同颜色和质地,直径为1 cm的小块接种于MS+1.0 mg/L KT+0.1 mg/L 6-BA+0.3 mg/L NAA的分化培养基上光培养,调查愈伤组织分化率。


2 结果与分析
2.1参试材料的植物学差异 对多叶自交系单株进行植物学观察发现,MFS5多叶性状明显,多叶率为93%,5~7片,7片叶居多,羽状,花浅紫色,半直立。MFS42多叶性状较为明显,多叶率为58%,4~9片叶,7片叶较多,羽状,匍匐,花紫色。MFS46多叶率为73%,4~5片,4片叶多,多为掌状,半直立,生长后期易倒伏,花色黄紫色。其中以MFS5,多叶表达率最高。经2年田间观测表明,以上材料多叶率较高且多叶性状均能稳定表达,可用于多叶苜蓿自交系的继续选育和杂交亲本的配置,是自交系中较优良的单株。
2.2败育率的调查情况 苜蓿自交后胚的败育机理相当复杂,不同基因型、生长条件以及成熟期都对胚败育产生影响[14,17-18]。通过幼胚形态特征观察发现,正常的幼胚饱满,颜色多为鲜绿色或淡绿色;而败育的幼胚一直处于干瘪、体积较小的状态,通常表现为褐色或黑色。结果表明,在授粉后40 d,苜蓿的败育率达到最高值。参试材料中,MFS5单株的败育率为28.84%;MFS42单株的败育率为43.26%;败育率最高的材料为MFS46单株,达40.67%。
2.3不同取材时期对胚挽救的影响 为进一步确定多叶苜蓿自交系幼胚挽救的最佳取样时期,从授粉后20~40 d,每隔5 d取幼胚进行离体培养。培养结果显示,3个多叶苜蓿自交系单株在不同取材时期幼胚均能萌发,但不同时期的幼胚萌发差异较大(图1)。采集授粉后20 d的材料褐化比较严重,萌发率较低,平均萌发率为28.09%;授粉后30 d接种,各材料幼胚萌发率均达到最高值,平均为46.71%,明显高于其他各取材时期。此时进行胚挽救培养可以获得最佳效果;授粉后40 d胚挽救效率最低,萌发率仅为12.16%,此时的胚处于绿色状态,很难启动萌发,大部分已处于生理成熟期。综合分析,授粉后30 d进行胚挽救培养,胚的萌发率达到最高值,且此时接种胚不易出现褐化,相对其他时期萌发启动早,约3~4 d后即可萌发,幼胚呈深绿色,为最佳取材时期。
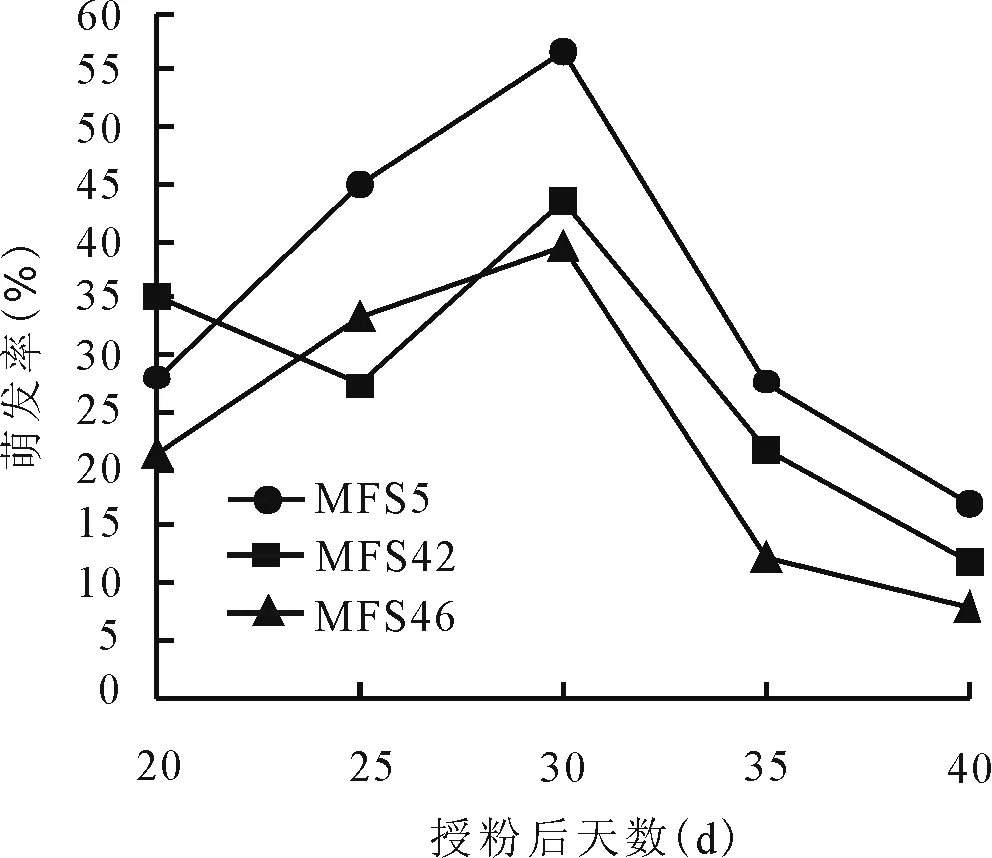
图1 不同取样时间对苜蓿胚挽救萌发率的影响
2.4不同激素水平对幼胚挽救的影响 分别取3个自交单株在授粉后30 d的幼胚,接种于10种激素水平组合下的培养基上。以MS为基本培养基,在吲哚乙酸(IAA)保持0.5 mg/L不变的情况下,附加不同浓度的KT、6-BA 组合研究激素对苜蓿幼胚萌发的影响。
2.4.1细胞分裂素KT对幼胚萌发的效应 在不同KT质量浓度下,3个苜蓿自交单株的幼胚都能萌发。当KT质量浓度为0.01~0.03 mg/L时,3份材料的胚萌发率都随着浓度的升高而增加。当KT为0.03 mg/L时,各材料胚萌发率均达到最大值,分别为MFS5单株 40.13%,MFS42单株38.5%,MFS46单株37.2%;但当KT质量浓度增加到大于0.03 mg/L时,萌发率开始下降,0.03~0.09 mg/L时,幼胚萌发率与KT质量浓度的增加成反比。KT质量浓度为0.09 mg/L时,3份材料萌发率都达到不同程度的最低值,其中MFS5单株的萌发率最低,仅为15.42%(图2)。
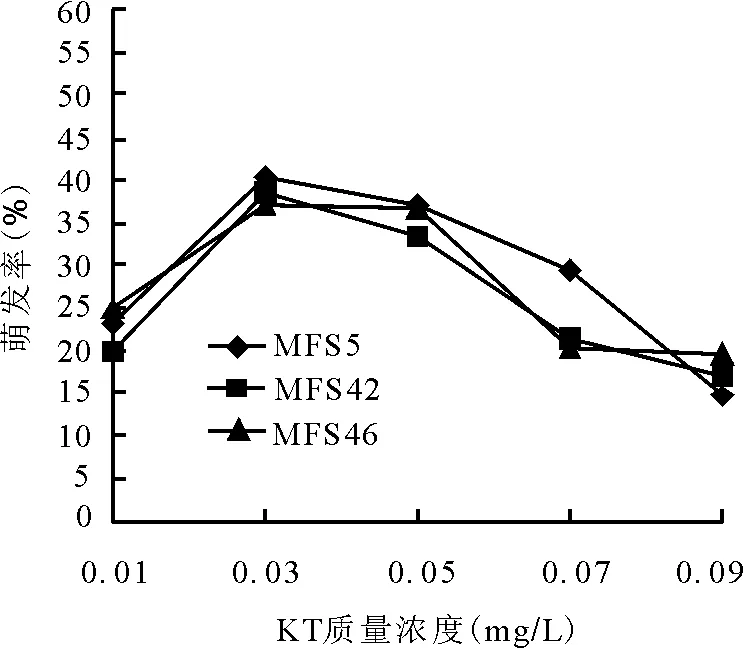
图2 不同质量浓度KT对苜蓿胚挽救萌发率的影响
2.4.2细胞分裂素6-BA对苜蓿幼胚萌发的效应 在6-BA浓度梯度下,各材料也都能萌发。0.01~0.07 mg/L时,3份材料幼胚萌发率与6-BA质量浓度的增加成正比。在0.01 mg/L时,各材料萌发率均为所有处理的最低值,MFS5单株16.63%,MFS42单株17.3%,MFS 46单株18.23%。当6-BA质量浓度达到0.07 mg/L时,各个材料均达到各自萌发率的最大值,MFS5单株53.34%,MFS42单株46.53%,MFS46单株43.37%(图3)。但当6-BA质量浓度高于0.07 mg/L,6-BA对萌发率逐渐出现抑制作用。萌发率随着6-BA质量浓度的增加而逐渐降低。且当6-BA质量浓度为0.01 mg/L时,3个材料的幼胚都发育迟缓,MFS5单株接种7 d后才出现萌发,并且胚萌发后出现生长停滞的现象。
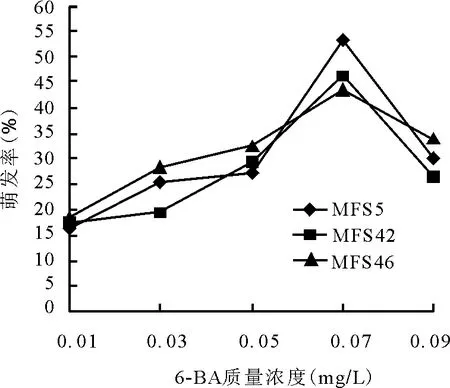
图3 不同质量浓度6-BA对苜蓿胚挽救萌发率的影响
对比6-BA和KT的结果发现,对于胚萌发添加6-BA要优于添加KT。苜蓿幼胚培养的最佳组合为:MS+0.5 mg/L IAA +0.07 mg/L 6-BA,蔗糖30 g/L,琼脂7 g/L,pH值5.8~6.1。
2.5幼胚愈伤组织的诱导及不定芽的分化 将萌动的幼胚转入诱导愈伤培养基上,20 d后发现卷曲的子叶、叶缘及叶背处都形成愈伤组织,其愈伤组织结构大多呈现为浅黄色致密团状,还有少数膨松水渍状和白色沙粒状等,20 d后统计,愈伤平均诱导率分别为MFS5 91.77%、MFS42 80.34%、MFS46 83.85%。然后将形成的愈伤组织每15~18 d继代培养,等长到愈伤直径为1 cm左右时转入分化培养基上,统计愈伤组织分化率以MFS5最高为88.89%,其次为MFS46 87.58%,MFS42较低为77.92%。
3 讨论
苜蓿胚败育是一个极其复杂的生物学过程,苜蓿自花授粉后,经双受精作用而形成的合子和胚胎在发育过程中会出现夭亡的现象,其败育的比率高于异花授粉[1,19]。关于苜蓿胚胎发育过程和败育机理前人已有报道,早在1935年,Cooper[20]第1次对苜蓿的幼胚发育过程进行了描述。Rosellini等[18]分别对9个苜蓿群体的每个单株的胚珠败育情况进行调查,发现苜蓿的胚珠败育率为4%~26%。金洪等[15]对敖汉苜蓿(M.sativacv.‘Aohan’)授粉受精及幼胚的发育过程进行研究,发现经过受精作用幼胚细胞开始分裂分化,到第22天便形成了具有幼胚根、幼胚轴、幼胚芽和子叶的完整幼胚。幼胚的整个形成过程可分为3个阶段:球状幼胚形成期、子叶形成期、幼胚各部分发育成熟期。导致自交败育的原因,除与两性器官的不亲和或不相适应有关外,也可能是一种近亲繁殖效应的结果[1]。紫花苜蓿自交结实率的高低就主要取决于它们各自近亲繁殖的程度,植物材料杂合性降低也是造成受精后合子或胚珠败育的原因之一[21]。本研究对多叶苜蓿自交系授粉后40 d进行胚败育率调查得出自交系单株平均胚败育率为37.59%,与前人研究的苜蓿自交受精后胚珠败育的百分率为34.4%[1]的结论相近。
苜蓿的败育时期,确定胚接种的最佳取材时期是决定苜蓿胚挽救能否成功的前提条件。苜蓿自花不孕有一个特点,即幼胚自花受精后,种子败育的频率很高[1]。Bauchan[13]对苜蓿胚珠发育过程以及接种时间的研究表明,当紫花苜蓿胚珠发育为心形胚期(授粉后8~12 d)和鱼雷形胚期(授粉后12~16 d)时,生长最好,萌发率为31%。所以接种时期太早,胚尚处于发育早期,很难培养成功;接种时间太晚,胚的发育率降低,甚至会因败育而导致试验失败。本研究对于3个自交单株的胚挽救过程中发现,其幼胚胚龄在自交授粉后30 d胚的萌发率最高,为最佳取材时期。此时各个单株萌发率都比较高。
McCoy[12,16]研究了多年生苜蓿及一年生苜蓿杂交胚珠挽救技术,发现基本培养基为SH效果较好。Bauchan[13]对蜗牛苜蓿和紫花苜蓿胚挽救,证明MS和SH培养基适合于胚挽救,还研究了不同激素组合对于苜蓿胚珠萌发的影响;试验证明添加0.05 mg/L IAA和0.05 mg/L 6-BA在MS中对胚珠萌发最为有利。从本研究可以看出,在MS培养基中,当IAA的质量浓度一定时(0.5 mg/L),分别加入了不同质量浓度水平的6-BA和KT,对苜蓿胚挽救效力进行比较,添加6-BA的培养效果要比添加KT好,结果培养基的最佳激素质量浓度配比是:IAA 0.5 mg/L,6-BA 0.07 mg/L。培养基在幼胚生长发育过程中提供其所需的碳源和营养物质,而激素主要作用是调节渗透压[22]。IAA 0.5 mg/L,6-BA 0.07 mg/L较其他不同激素组合效果好的原因,可能是能够更好的提供苜蓿幼胚生长发育所需的渗透压。
在促进萌发过程中,萌发的幼苗应及时转入增殖分化培养基中才能防止褐化,愈伤组织在增殖过程中生长良好,70~90 d后产生膨松带有绿色芽点的愈伤组织,最终分化成苗。进一步提高分化率的同时缩短愈伤组织分化时间是有待继续研究的问题。
[1] 洪绂曾,卢欣石,高洪文.苜蓿科学[M].北京:中国农业出版社,2009:216-231.
[2] Armstrong J M.Cytological studies in alfalfa polyploids[J].Canadian Journal of Botany,1954,32(4):531-542.
[3] 刘淑明.苜蓿的开花习性及其杂交技术的研究[J].中国草地,1996(2):7-10.
[4] 姜华,毕玉芬.紫花苜蓿花粉和胚珠与种子产量的关系[J].云南农业大学学报,2008,23(3):334-338.
[5] 姜华,毕玉芬.紫花苜蓿花粉活力和柱头可授性的研究[J].草业科学,2009,26(9):105-107.
[6] 闫爱玲,张国军,徐海英,等.葡萄不同倍性品种间杂交幼胚挽救及鉴定[J].西北农业学报,2008,17(3):223-226.
[7] 贺佳玉,李云,姜金仲,等.植物胚败育机理及其离体培养挽救技术之研究进展[J].中国农学通报,2008,24(1):141-146.
[8] Ramming D W,Emershad R L.In-ovule embryo culture of seeded and seedlessV.viniferaL.[J].Horticultural science,1982,17(3):487-492.
[9] Cain D W,Emershad R L,Tarilo R E.In-ovule embryo culture and seedling development of seeded and seedless grapes (V.viniferaL.)[J].Vitis,1983,22(1):9-14.
[10] 余桂荣,尹钧,郭天财,等.小麦幼胚培养基因型的筛选[J].麦类作物学报, 2003,23(2):14-18.
[11] 杜学梅,李登科,王永康,等.枣胚培技术体系的建立[J].园艺学报,2005,32(3):496-499.
[12] McCoy T J.Interspecific hybridization ofMedicagosativaL.andM.rupestrisMB.using ovule-embryo culture[J].Canadian Journal of Genetics and Cytology,1985,27:238-245.
[13] Bauchan G R.Embryo culture ofMedicagoscutellataandM.sativa[J].Plant Cell, Tissue and Organ Culture,1987(10):21-29.
[14] 吴素琴,张自和.紫花苜蓿植株群体花序花朵数及荚内种子数的数量特征分析[J].草业学报,2003,12(5):77-80.
[15] 金洪,李造哲,吴永敷,等.敖汉苜蓿授粉受精及胚胎发育过程的研究[J].中国草地,1999(6):1-10.
[16] McCoy T J, Smith L Y.Interspecific hybridization of perennialMedicagospecies using ovule-embryo cultur [J].Theoretical and Applied Genetics,1986,71:772-783.
[17] 吕林有,魏臻武,赵艳,等.苜蓿自交亲和性、授粉方式及后代性状分离的研究[J].草业科学,2009,26(4):33-36.
[18] Rosellini D, Ferranti F, Veronesil F.Ovule sterility and seed set in alfalfa[A].Proceeding of the Conference:The alfalfa Genome[C].Wisconsin:Madison,1999:1-4.
[19] 张爱勤,朱进忠.苜蓿结实格局及其影响因素的研究[J].新疆农业大学学报,2005,28(4):l5-19.
[20] Cooper D C.Macrosporogenesis and embryology ofMedicago[J].Journal of Agricultural Research,1935,51:471-477.
[21] Bola nos-Aguilar E D, Huyghe C, Julier B.Genetic variation for seed yield and its components in alfalfa (Medicagosativa) populations[J].Agronomie,2000,20:333-345.
[22] Raghavan V, Srivastava P S.Embryo culture[A].In:Johri B F.Experimental embryology of vascular plants[C].New York:Springer-Verlag,1982:195-230.
