植物组织培养及其在草类植物中的研究和应用
2011-04-25赵丽君王雪芳张金林王锁民
赵丽君,王雪芳,张金林,王锁民
(兰州大学草地农业科技学院,甘肃 兰州 730020)
植物组织培养(plant tissue culture)起源于20世纪初,从20世纪至今经历了3个阶段:萌芽阶段(20世纪初-20年代末)、奠定阶段(30年代初-50年代中)和蓬勃发展阶段(50年代末至今)。1902年,德国植物学家Haberlandt[1]提出“植物细胞具有全能性”的理论,并将从虎眼万年青属(Ornithogalum)植物表皮细胞及Lamiumpurpureum和凤眼莲(Eichhorniacrassipes)叶肉栅栏组织中分离出的单个细胞置于含有蔗糖的Knop溶液中培养,这是植物组织培养的开端;20世纪30年代,White等[2]培养离体番茄(Lycopersiconesculentum)根尖,建立了可以继代培养的第一个无性繁殖系,确立了植物组织培养的基本方法,40年代开始将植物激素应用于植物组织培养中,使得植物组织培养得到了长足的发展[3];英国学者Steward和Mapes[4]将胡萝卜(Daucuscarota)髓细胞培养成一个完整的植株,这是植物组织培养的第一个突破,60年代开始,植物组织培养迅速发展,并开始应用于生产实际中。目前,植物组织培养技术已渗透到植物生理学、病理学、遗传学、育种学、药学以及生物化学等研究领域,成为生物学科中的重要研究技术和手段之一,推动了相关学科的迅速发展。特别是植物组织培养技术与分子生物学及RNA干扰(RNA interference,RNAi)技术紧密结合,成为细胞生物学和细胞遗传学研究的基础。植物组织培养技术还被广泛应用于农业、林业、工业、医药业等多种行业,从而在生产实践方面产生了巨大的经济效益和社会效益。植物组织培养技术在草类植物中的研究和应用虽然起步较晚,但近年来发展非常迅速,已被广泛应用于草类植物优良营养系的快速繁育[5-11]、遗传转化[12-27]、细胞和分子育种[28-31]以及次生代谢产物生产[32-34]等诸多方面。本研究对影响植物组织培养的因素、存在的主要问题及其解决方法进行探讨,并重点阐述组织培养在草类植物中的研究和应用。
1 影响植物组织培养的因素
影响植物组织培养的内外因素很多,归纳起来主要有:外植体基因型、外植体的种类、培养基、植物生长调节剂的种类及浓度配比以及培养条件等。
1.1外植体基因型 外植体是指植物组织培养中作为离体培养材料的器官或者组织的片段,外植体材料的遗传背景对植物组织培养的影响很大,不同植物或相同植物不同品种间存在着显著的差异,基因型细微的差异都会造成材料的内源激素含量不同,引起不同品种间相同外植体的分化频率和分化速度间差异的产生[35]。外植体的基因型影响植物的再生能力,刘建平等[36]就冬小麦(Triticumaestivum)不同基因型对花药愈伤组织诱导率作了相关研究,发现不同基因型在同一培养环境条件下愈伤组织诱导率有明显差异。何道一等[37]也比较了不同基因型苹果(Maluspumila)的离体再生特点,结果表明,不同基因型苹果叶片再生频率的高低和再生类型存在显著差异。何勇等[38]用6个高羊茅(Festucaelata)品种成熟种子为外植体进行了愈伤组织诱导,发现不同品种在相同培养条件下,愈伤组织诱导差异十分显著,而分化再生能力无明显差异。
1.2外植体的种类 外植体可以取自于植物的各种器官、组织或细胞等。外植体的种类、本身的生理生化特性对愈伤组织和不定芽的诱导起着决定作用。不同种类的外植体诱导愈伤组织和不定芽的能力大不相同;即使是同一植株,若生长在不同的环境条件(光照强度、光照时间、湿度、温度和营养物质等)下,生理生化特征也会不尽相同;不同部位的外植体在组织培养时对培养基和培养条件的要求会不同,愈伤组织与不定芽的诱导能力也存在差异。这些差异可能是外植体本身含有的内源细胞分裂素与生长素的绝对含量和相对比例不同所造成的[39],在植物组织培养过程中选择合适的外植体至关重要。有研究表明,红掌(Anthuriumandraeanum)不同部位的外植体(叶柄、茎段、叶)诱导愈伤组织的能力差异显著。在最佳诱导培养基上,叶柄诱导率最高,达到86.7%,茎段次之,叶的诱导能力最差,但是叶最早诱导出愈伤组织[40]。王强龙等[41]以紫花苜蓿(Medicagosativa)的下胚轴、子叶、叶片和叶柄为外植体进行愈伤组织诱导和植株再生,结果表明,叶片胚性愈伤形成率最低,叶柄和子叶比较接近,而下胚轴的胚性愈伤形成率最高,即下胚轴为最佳外植体。陈季琴等[42]对多年生黑麦草(Loliumperenne)的3个品种选取成熟种子、成熟胚、胚轴和胚根4种外植体进行愈伤组织的诱导,分别得出适应不同外植体的激素配比。
1.3培养基 培养基是维持植物组织活力和提供其生长的人工配制的营养物质,在植物组织培养过程中,外植体的生长、分化需要的各种营养成分都是从培养基中获得的,因此,培养基中营养物质的成分和比例对愈伤组织的诱导和植株再生起着决定性的作用。选择合适的培养基是植物组织培养成功的关键,培养基的选择主要考虑两个方面:基本培养基的种类和各种激素的浓度及比例。植物组织培养中常用的基本培养基有MS和B5两种,MS适合于大多数的双子叶植物,而B5培养基常用于单子叶植物的组织培养。组织培养过程中,要根据植物的种类和外植体的类型选择合适的培养基,这样才能得到较好的诱导和再生效果。冯波[43]分别在基本培养基MS和B5上对霸王(Zygophyllumxanthoxylum)子叶、茎和茎节进行愈伤组织诱导,结果表明,MS更适合作为霸王组织培养的基本培养基。诱导蒜(Alliumsativum)的不定芽生根时,1/2 B5培养基的效果最好[44]。
1.4植物生长调节剂的种类及浓度配比 植物生长调节剂在组织培养的过程中有着重要的作用。植物内源激素是影响组织培养过程中形态发生变化的内在因素,不同基因型的外植体间内源激素的差异对愈伤组织和芽的诱导有重要的影响,植物生长调节剂则是通过调整植物内源激素的水平而起作用。生长调节剂的种类和浓度配比都会对植物组织培养造成影响。有研究表明[45],在培养基中加入2,4-D时,黑麦草成熟种子20 d后出现淡黄色的愈伤组织,无2,4-D的培养基不能诱导产生胚性愈伤组织;当2,4-D质量浓度为0~5 mg/L时,随着2,4-D质量浓度增加,黑麦草愈伤组织的诱导率逐渐增加。杨茹等[46]的研究表明,黑麦草成熟种子添加2,4-D的愈伤组织诱导率显著高于添加NAA的,且2,4-D质量浓度为7 mg/L时诱导率最高,愈伤组织的质量也最好。在含有2,4-D 的培养基中加入少量的6-BA (0.1 mg/L)能进一步促进愈伤组织的诱导,随着6-BA质量浓度的升高,愈伤组织的诱导率反而下降,浓度越高抑制作用越显著。胡张华等[47]在N6+9 mg/L 2,4-D上添加2.0 mg/L ABA,发现高羊茅成熟种子的愈伤组织诱导率明显提高,且能有效抑制胚芽和根的形成。
1.5培养条件 植物组织培养的培养条件主要包括光照强度和时间、温度及相对湿度。由于植物材料培养在含糖的培养基中,光照的主要作用是诱导植物组织的形态建成,光照强度影响着离体培养细胞的增殖和器官的分化,对外植体细胞最初分裂的影响更为显著。在以桃叶卫矛(Euonymusbungeanus)的硬枝为外植体诱导丛生芽的培养中,当光照强度为18 μmol/(m2·s)时,未能诱导出丛生芽并且硬枝逐渐变黄死亡;光照强度为36 μmol/(m2·s)时,才能诱导出丛生芽[48]。光照时间也会影响愈伤组织和芽的诱导,在培养甘薯(Ipomoeabatatas)茎尖分生组织时,光照时间14 h/d要优于10 h/d[49]。温度对愈伤组织的诱导和生长有着决定作用,有研究表明[50],温度对草珊瑚(Sarcandraglabra)愈伤组织的诱导和生长影响显著,温度在23~28 ℃时,愈伤组织诱导率高且生长快,当温度在15 ℃左右或32 ℃以上时,愈伤组织的生长受到严重抑制,逐渐死亡。同时变温也伤害草珊瑚的愈伤组织,影响其生长。相对湿度是影响试管苗或其他离体器官在培养容器内水分状况的重要环境因素之一[51]。尹品训等[52]研究表明,激素水平、温度、光照都不是大麻(Cannabissativa)玻璃化苗产生的主要影响因素,而湿度则是其产生的关键因素。
1.6其他因素 提供外植体植株的年龄也是影响愈伤组织诱导和分化的一个重要因素,有研究表明[53],以低龄的幼苗下胚轴作外植体时,甘蓝型油菜(Brassicanapus)芽的分化率最高,生长5 d的甘蓝型油菜下胚轴再生频率为35.0%,而当苗龄为9 d时,再生频率只有20.2%。赵军良等[54]研究发现,3~4 d的白菜(B.pekinensis)无菌苗的子叶分化率显著高于其他苗龄。植物的组织培养过程中常常会产生大量的乙烯(C2H4),外植体在培养过程中生长素的运输会因为乙烯的存在而受到抑制,这导致器官和体细胞胚的发生受到影响。通常诱导愈伤组织和不定芽时,在培养基中加入乙烯抑制剂(如硝酸银、氯化钴、AVG、水杨酸等),不定根的诱导会显著地受到抑制,同时愈伤组织能快速形成,加快器官和体细胞胚的发生,外植体产生不定芽的数目也会增加,更为重要的是能促进某些很难再生的物种产生不定芽,从而提高再生频率[55]。很多研究都表明,AgNO3对大白菜、油菜等植物的组织培养与植株再生有不同程度的促进作用[56]。AgNO3对愈伤组织和不定芽诱导的促进作用不是因为能够抑制乙烯的合成,而是阻止了乙烯对多胺合成的干扰,多胺的合成则可以促进外植体体细胞胚的发生和不定芽的分化。另外AgNO3也会抑制乙烯的积累,降低培养容器中乙烯的浓度,从而促进不定芽的分化。在植物组织培养过程中培养基多为固体培养基,需要加入固化剂。一般使用琼脂,琼脂品质的好坏也会影响愈伤组织与芽的诱导分化。为了达到较好的离体培养效果,应该选择杂质少、纯度高、凝胶透亮、凝固快的琼脂。
2 植物组织培养中存在的主要问题及解决方法
在植物组织培养的过程中,常常会存在褐化、污染和玻璃化等现象,这些问题严重影响组织培养的效果,应尽量避免其发生。
2.1褐化及控制措施 褐化,也称酚污染,是指外植体在组织培养过程中,自身组织中酚类化合物与空气接触发生氧化反应产生棕褐色的酮类物质,使外植体变褐并逐渐死亡的现象。褐化中产生的有毒物质不仅使外植体和培养基变色,而且抑制很多酶的活性,严重影响外植体愈伤组织的诱导和脱分化,甚至会造成其死亡。褐化现象的发生与否是由外植体组织中所含的酚类化合物多少和多酚氧化酶活性决定的。因此,影响褐化的因素主要为外植体材料和酶促因子[57]。有研究表明,抗氧化剂聚乙烯基吡咯烷酮(PVP)及抗坏血酸(Vc)浓度为200 mg/L时,可延迟野牛草(Buchloedactyloides)成熟胚愈伤组织的褐化;缩短继代周期至5 d可有效防止愈伤组织褐化;外源多胺能影响内源多胺与乙烯的合成,并可减轻愈伤组织的褐化,改善其质量[58]。无花果(Ficuscarica)组织培养中,刚长出幼叶的顶芽与未发芽的顶芽相比,褐化现象较严重,分化率也较低[59]。王文静等[60]在鸢尾(Iristectorum)组织培养的培养基中加入0.1% Vc或0.3%活性炭能明显防止褐化。刘闻川等[61]探讨了黑暗和1 000、2 000、3 000 lx的不同光照条件对槲蕨(Drynariaroosii)组织培养外植体褐化的影响,结果表明,在1 000 lx光照处理下槲蕨外植体的总酚含量积累较少。
在组织培养中可采用以下方法来避免或减轻褐化:1)培养基中加入抗氧化剂(如Vc、柠檬酸、二硫苏糖醇等)或在抗氧化液中对外植体进行切割、剥离等处理。2)经常继代可以防止酮类物质在培养基中的积累,减轻其对外植体的伤害,降低褐化发生的概率。3)培养基中加入1%的活性炭,由于其吸附作用可以除去酚类氧化产物,减少有毒物质对外植体的毒害;活性炭还可以减少光照强度,进一步降低褐化发生的可能;但活性炭也会吸附培养基中的营养物质和外源激素,所以含量不能过多。4)光照可以诱导植物组织内有些酚类氧化酶的活性,因此,组织培养的最初阶段在黑暗条件下进行会减少褐化的发生。
2.2污染及解决措施 植物组织培养的过程较长,培养基中营养物质充足,光照、温度、湿度和pH值等培养条件也适合大多数微生物的生长,并且微生物生长迅速、繁殖周期短,所以组织培养中任何一步带菌都会污染整个体系。一般造成污染的原因有两种:1)外植体本身寄生了很多微生物;2)实验环境和操作过程中病原侵入到培养基中而造成污染。引起污染的微生物主要有细菌、霉菌和酵母菌三类,后两类生长较快、造成的污染很容易发现并及时处理;但是细菌在培养基中有潜伏期,造成的污染一般不容易觉察,因此,细菌造成的污染在植物组织培养中是最严重的。污染不仅影响外植体的正常生长,更破坏了组织培养的正常进行,造成时间和资源的浪费。因此,在植物组织培养过程中,应该严格控制污染:对外植体进行严格的消毒,一般在75%的酒精、5%的次氯酸钠或1%的HgCl2溶液中漂洗,在不损害外植体生长活力的情况下将其自带的病原降到最少[62];保持操作环境的清洁,操作中应穿戴橡胶手套、口罩、帽子,减少甚至消除环境和操作过程中的污染。
2.3玻璃化现象及其消除对策 玻璃化(vitrification)也称过度水化现象,是指植物组织培养过程中外植体因生理失调或生理病变而呈半透明状、外观形态异常的现象。由于玻璃化苗的生理功能异常,难以移栽成活,玻璃化苗的出现对植物快速微繁殖是不利的。在木本及草本植物中已报道出现玻璃化苗的植物达70多种[63]。玻璃化苗的组织或植株呈半透明、水渍状,脆弱易碎[64];叶绿素和蛋白质含量显著下降,分化能力降低,很难继续增殖和生根[65]。目前,研究已证实玻璃化现象只是植株的一种表型特征,玻璃化的组织器官在一定条件下可恢复,并不会遗传到后代[66]。
防止玻璃化的方法主要有:1)基本培养基选择固体培养基,并适当提高培养基中琼脂的浓度,降低培养基的衬质势,阻止细胞过多的吸水,从而防止玻璃化现象的发生;2)增加培养基中蔗糖的含量,培养基的渗透势也就会随之降低,外植体不能从培养基中获得过多的水分而发生玻璃化现象;3)降低培养基中细胞分裂素的浓度;4)严格控制温度;5)把外植体置于自然光照下培养,可消除轻微的玻璃化现象;6)尽可能的增加培养容器的通风性,以降低相对湿度,改善氧气供应状况,可选用透气性好的封口膜封口。张燕玲等[67]在满天星(Gypsophilasp.)组织培养中,发现玻璃化苗的数量随着培养基中糖分和琼脂浓度的增加而减少,而且聚乙烯醇对满天星玻璃化现象有明显的抑制作用。赵佐敏[68]在非洲菊(Gerberajamesonii)组培苗玻璃化控制研究中表明,随着6-BA浓度的降低,玻璃化苗比例呈递减趋势;随着温度的降低(从28 ℃降到18 ℃),玻璃化苗逐渐消失;使用透气性封口膜可抑制玻璃化苗的产生。
3 组织培养在草类植物中的研究和应用
植物组织培养技术在草类植物中的研究和应用起步相对较晚,但近年来发展迅速,已被广泛应用于草类植物的快速繁育、遗传转化、细胞和分子育种以及次生代谢产物生产等诸多方面。
3.1无性系的快速繁殖 应用组织培养进行无性系的快速繁殖可追溯到20世纪60年代的“兰花工业”[69],直到现在已成为组织培养应用十分普遍的一个领域,成千上万种植物通过离体繁殖得到无性系,并形成产业,带来了巨大的经济效益。草类植物的无性系繁殖主要利用了其繁殖速度快、繁殖量大、不受地区气候影响、占用土地面积小等特点,可用于解决一些品种繁殖系数低、周期长的问题,特别对于名贵稀有草类的繁殖推广具有重要意义(表1)。
3.1.1稀缺濒危草类的快速繁殖 利用组织培养快速繁殖稀缺濒危草类主要是对名贵中草药的繁殖。近年来随着对许多草类植物的化学成分及药理方面的研究,许多草类植物的药用价值逐渐被提出。如金铁锁(Psammosilenetunicoides)已作为稀有濒危物种被列于《中国植物红皮书》中,属国家二级保护植物[70]。甘草(Glycyrrhizauralensis)作为医药中最常见的药物,早在1984年就进行了试管无性繁殖研究工作[71]。香根草具有特殊的生物学特征和强大的根系,在水土保持方面起着重要的作用,主要靠分蘖繁殖,远不能满足实际需要,为提高香根草的繁殖速度,韩露等[5]对其愈伤组织诱导和快速繁殖进行了研究。麻花秦艽是常用的上品藏药,徐文华和陈桂琛[6]以其茎尖为外植体进行了离体快速繁殖试验。苦皮藤被国家审批为植源性杀虫剂,其乳油、水乳剂、微乳剂已不断投放市场并收到了巨大的经济效益和社会效益。随着人们对苦皮藤的大力开发利用, 自然资源已面临短缺,为有效保护野生资源,马艳等[7]对其组织培养进行了研究,为其快速繁殖和工业化生产提供了有效途径。
3.1.2优良品系的无害化快速繁殖 在自然界中,许多草类植物的种子不易获得或存在发芽率很低的问题,因此采用根系无性繁殖。但根系长期的无性繁殖易感染病毒,导致种群退化,产量下降,品质低劣。用南丹参优良株系的茎尖或幼叶进行组织培养快速繁殖,1株良种苗1年可繁殖上万株试管苗,可迅速扩大优良种群[8]。溪黄草是民间常用草药,用种子繁殖后代,性状容易分离;扦插繁殖生根困难而且繁殖系数低,所以导致其很难推广;利用组织培养技术进行无性繁殖既可以保持其优良种性,又可以短期内大量繁殖,使工厂化育苗成为可能[9]。黄芩不仅是一种草本药用植物,国内还被作为盆景进行栽培,但利用种子和扦插繁殖容易感染病毒,导致品种退化;为满足市场要求,培育优良种苗,李永红等[10]进行了黄芩的组织培养与快速繁殖研究。
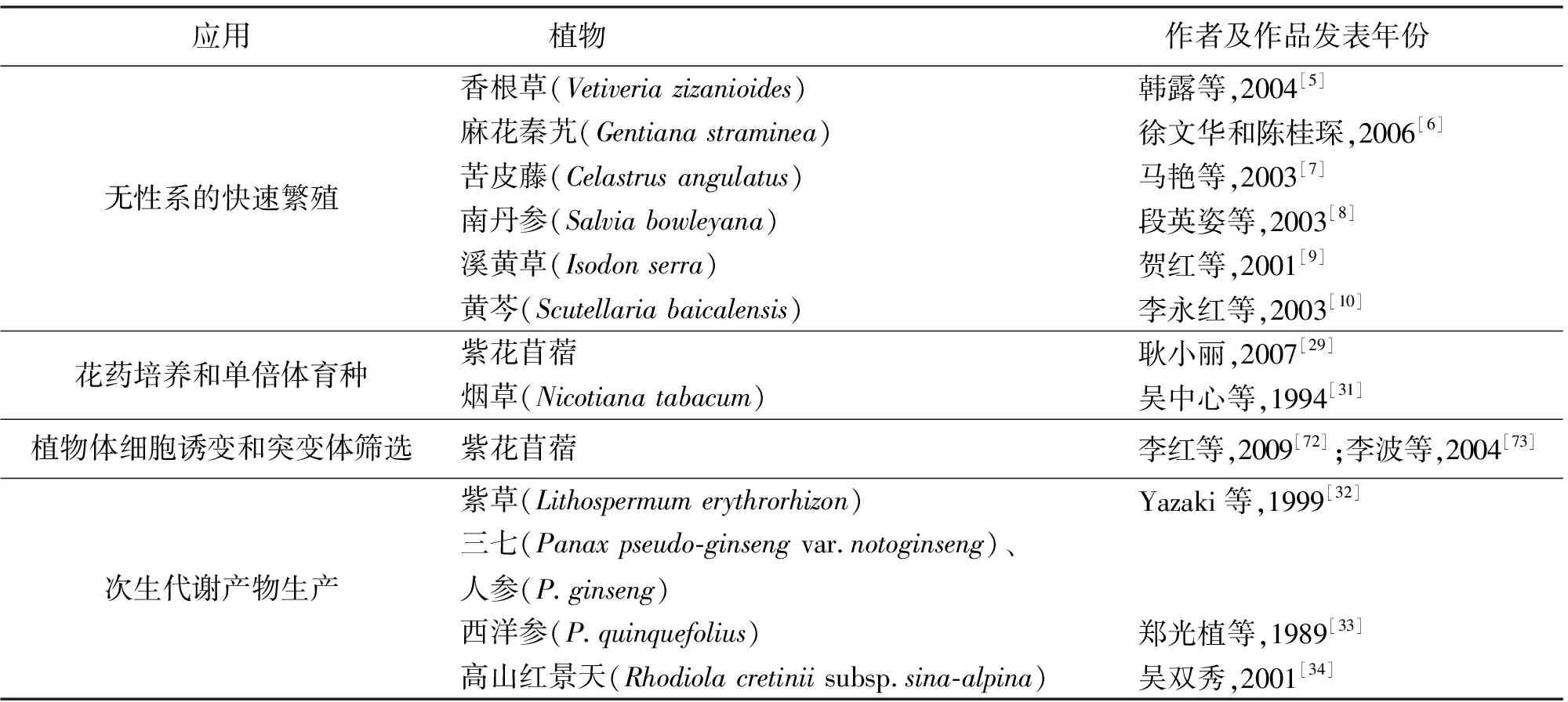
表1 组织培养在草类植物上应用的成功举例
3.1.3转基因植株的快速繁殖 随着现代分子生物学的快速发展,运用传统杂交育种和基因工程相结合培育草类新品种已成为育种的重要手段。目前,转基因高羊茅、紫羊茅、黑麦草和早熟禾等禾本科草类植物和豆科牧草苜蓿、白三叶等已培育成功,但考虑到转基因植株的遗传稳定性,对转基因植株的大量扩繁多采用无性繁殖的方法,例如,包爱科[11]对AVP1转基因紫花苜蓿抗逆性检测时,使用茎段扦插的方法进行快速扩繁;但转基因草类植物如单子叶的禾本科草类,不能使用扦插的方法,利用组织培养技术可以加快其快速繁殖。
3.2草类植物遗传转化再生体系的建立 遗传转化系统是指将外源基因通过某种方法导入植物细胞或原生质体,利用细胞的全能性获得转基因植株,从而有目的地改变植物的某些性状。所以,建立组织培养再生体系是遗传转化的前提,只有良好的再生体系才可以提高转基因的效率。目前为止,对草类植物进行遗传转化的再生体系主要通过愈伤组织、悬浮细胞和原生质体培养建立的(表2)。
3.2.1愈伤组织为受体的遗传转化 在草类植物中,以愈伤组织为受体已建立了许多转基因体系。金淑梅等[12]用根癌农杆菌介导法,以愈伤组织为受体,将目的基因Gus整合进苜蓿基因组中。刘萍等[13]以草坪型黑麦草愈伤组织为受体获得转基因株系Gsc_LP5。马生健等[14]用高羊茅种胚离体诱导的胚性愈伤组织作受体进行了基因枪轰击试验,获得了遗传稳定的抗除草剂PPT的转化植株。赵军胜等[15]用高羊茅下胚轴来源的胚性愈伤组织进行了遗传转化。采用下胚轴为外植体,已成功地将拟南芥(Arabidopsisthaliana)AtNHX1[16]和AVP1[17]基因转化紫花苜蓿,获得了耐盐、耐旱和耐贫瘠性显著提高的紫花苜蓿新品系。
3.2.2悬浮细胞为受体的遗传转化 最初利用组织培养进行的遗传转化,以悬浮细胞为受体比较常见。Wang等[18]以悬浮细胞系为受体,获得了转Hpt和Bar基因的高羊茅。Spangenberg等[19]用高羊茅胚性悬浮系为受体进行了遗传转化。Dalton等[20]通过基因枪轰击悬浮细胞系,建立了黑麦草的转基因体系;使用硅碳纤维介导了黑麦草、高羊茅、匍匐剪股颍的细胞悬浮系,获得了抗潮霉素的转基因植株[21]。Bettany等[22]用高羊茅和黑麦草胚性悬浮细胞为受体,使用农杆菌转导法导入了外源基因Gus。胡张华等[23]用带有质粒pDBA121(含Hpt基因和Bar基因)的农杆菌菌株EHA105转化高羊茅胚性悬浮细胞,建立了可重复的、高效的农杆菌介导的高羊茅遗传转化系统。
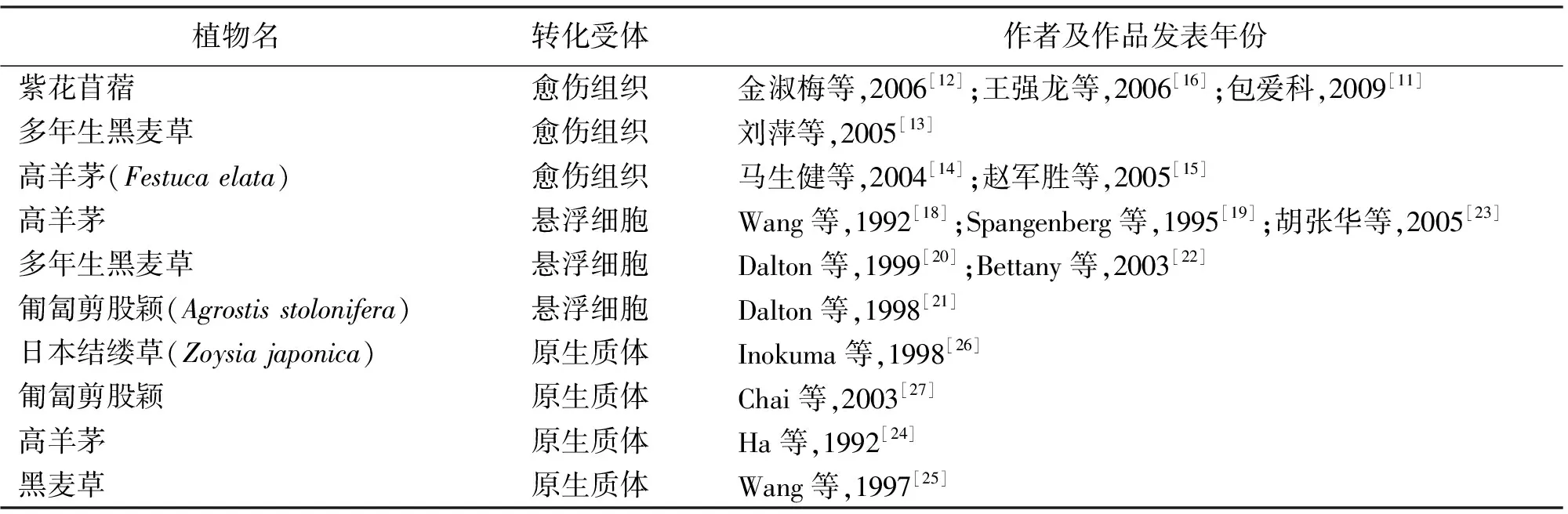
表2 草类植物以组织培养为手段进行遗传转化的举例
3.2.3原生质体为受体的遗传转化 由于从悬浮细胞培养获得的植株在遗传上存在不稳定的现象,同时也不便于进行转基因工作[74]。Ha等[24]用电激法以高羊茅原生质体为受体进行了遗传转化。Wang等[25]以原生质体为受体,获得了转Hpt基因的黑麦草。Inokuma等[26]以原生质体为受体获得了转Gus和Hpt基因的日本结缕草。Chai等[27]以原生质体为受体成功的将Hpt基因导入匍匐剪股颖。
3.3花药培养和单倍体育种 花药组织培养主要是诱导形成单倍体植株,可以快速获得纯系,缩短育种时间。自Guha和Mahcshwari首次从曼陀罗(Daturastramonium)花药诱导出花粉单倍体植株以来,世界各地均开展了花药培养,我国于20世纪70年代获得了第一批水稻(Oryzasativa)花药培养的单倍体植株。目前利用花药培养培育的新品种多见于农作物,如水稻、小麦、玉米(Zeamays)等。近年来,先后也出现了草类植物的花药培养,如马菊兰[28]对4个苜蓿品种的花药培养预处理方法和培养基进行了研究,从而建立了苜蓿花药培养高效再生体系,大大提高了苜蓿育种的效率;耿小丽[29]以5个苜蓿品种为试材,利用花药培养诱导了苜蓿单倍体植株;段承俐等[30]开展了三七的花药培养,吴中心等[31]利用花药培养系统选育了烟草抗赤星病品系(表1)。
3.4植物体细胞诱变和突变体筛选 植物体细胞在离体培养条件下本身容易发生染色体畸变和基因突变,如果采用改变外界条件进行诱变,则诱变的几率更高。这为培育新品种奠定了良好的基础。周荣仁等[75]用组织培养及逐步增加NaCl浓度的方法筛选出能耐2% NaCl的烟草愈伤组织,但在2% NaCl培养基中继代29次后,再移入无盐培养基中培养11和20代后,耐盐性退化到只耐1.5%与1.0% NaCl的水平,不能保持提高了的耐盐性。李红等[74]以紫花苜蓿茎段为材料进行愈伤组织诱导,采用紫外线和NaN3化学诱变处理其愈伤组织,提高了紫花苜蓿的抗碱性。李波等[75]对紫花苜蓿茎段诱导的愈伤组织进行不同浓度的硫酸二乙酯(DES)诱变处理,在-7 ℃低温下进行筛选,获得了抗寒性突变体(表1)。
3.5次生代谢产物生产 植物中含有数量极为可观的次生代谢物质,目前发现的植物天然代谢产物已超过2万种,而且还以每年新发现1 600余种的速度递增[76]。早在1979年,我国学者就提到离体培养的植物组织中可能产生一些物质,尤其是有经济价值的药物[77]。例如,中药草金铁锁根部富含皂甙,对一些炎症和致病性细菌和真菌都有抑制作用,丹参根部含有丹参酮ⅡA、隐丹参酮等脂溶性萜醌类化合物,是我国的传统中药,具有活血祛瘀、通经止痛、清心除烦、养血安神之功效。近年来,次生代谢物质被人类广泛应用,不仅制成药品,还有食品添加剂、风味物质、香料、色素、化妆品、生物杀虫剂和农业化肥等[78]。但由于诸多原因,依靠野生和栽培植物已经远远不能满足日益增长的市场需求。植物组织培养就成为解决这个问题行之有效的方法。紫草系多年生植物,其根部富含紫草宁,Yazaki等[32]研究了在紫草悬浮液中光对紫草宁合成的影响。郑光植等[33]还开展了三七、人参和西洋参这3种药用植物的细胞培养,比较了它们愈伤组织培养及细胞悬浮培养中抗癌皂苷Rh1的含量,以期实现其次生代谢物的工业生产。在日本,用培养的人参悬浮细胞生产人参皂苷已形成规模。珍贵中药植物高山红景天的根和根茎中含有以红景天甙为主的次生代谢物质,吴双秀[34]用植物组织和细胞培养技术,对愈伤组织的状态进行调控,得到红景天甙含量高、生长速度快、初步分化的愈伤组织颗粒(表1)。
4 结束语
植物组织培养经过一个多世纪的发展,技术方法已经相当完善。目前组织培养技术大规模应用于具有重要经济价值的农作物、花卉、果木中,而且也开始应用于草类植物中。但要全面推进组培苗的产业化,还存在一些问题,如生产成本较高;有些植物繁殖系数偏低;技术流程繁琐等。今后还需要继续加强植物组织培养方面的研究和探索,全面彻底解决组织培养过程中出现的问题,使组织培养这一生物技术更好地服务于科学研究和生产实践。
[1]Haberlandt G.Experiments on the culture of isolated plant cells[J].Plant Cell and Tissue Cultures,1902,2:68-88.
[2]White P R.Further evidence on the significance of glycine,pyridoxine and nicotinic acid in the nutrition of excised tomato roots[J].American Journal of Botany,1943,30(1):33-36.
[3]Skoog F,Tsui C.Chemical control of growth and bud formation in tobacco stem segments and callus cultured in vitro[J].American Journal of Botany,1948,35(10):782-787.
[4]Steward F C,Mapes M O.Growth and organized development of cultured cells and organized in cultures grown from freely suspended cells[J].American Journal of Botany,1958,45:705-708.
[5]韩露,刘必融,潘超,等.香根草愈伤组织的诱导和快速繁殖[J].安徽师范大学学报(自然科学版),2004,27(4):443-445.
[6]徐文华,陈桂琛.藏药麻花艽的组织培养与快速繁殖[J].安徽农业科学,2006,34(19):4881-4903.
[7]马艳,肖娅萍,胡雅琴.苦皮藤组织培养与植株再生[J].中草药,2003,34(10):4-7.
[8]段英姿,牛应泽,刘玉贞,等.南丹参离体快速繁殖与多倍体诱导[J].植物生理学通讯,2003,39(3):201-205.
[9]贺红,冼建春,肖省娥,等.溪黄草离体培养和快速繁殖[J].中草药,2001,32(3):255-256.
[10]李永红,赖秋雅,范淑君,等.黄芩的组织培养与快速繁殖研究[J].深圳职业技术学院学报,2003(2):16-18.
[11]包爱科.拟南芥液泡膜H+-焦磷酸酶基因AVP1改良紫花苜蓿(MedicagosativaL.)抗逆性的研究[D].兰州:兰州大学,2009.
[12]金淑梅,管清杰,罗秋香,等.苜蓿愈伤组织高频再生遗传和转化体系的建立[J].分子植物育种,2006,4(4):571-578.
[13]刘萍,张振霞,苏乔,等.应用农杆菌介导法的多年生黑麦草遗传转化研究[J].中山大学学报(自然科学版),2005,44(3):126-127.
[14]马生健,曾富华,徐碧玉,等.基因枪介导的高羊茅基因转化体系的建立[J].园艺学报,2004,31(5):691-693.
[15]赵军胜,支大英,薛哲勇,等.根癌农杆菌介导的高羊茅遗传转化研究[J].遗传学报,2005,32(6):579-585.
[16]王强龙,王锁民,张金林,等.根癌农杆菌介导AtNHX1基因转化紫花苜蓿的研究[J].草业科学,2006,23(12):55-59.
[17]Bao A K,Wang S M,Wu G Q,etal.Overexpression of theArabidopsisH+-PPase enhanced resistance to salt and drought stress in transgenic alfalfa (MedicagosativaL.)[J].Plant Science,2009,176:232-240.
[18]Wang Z Y,Takamizo T,Iglesias V A,etal.Transgenic plants of tall fescue (FestucaarundinaceaSchreb.) obtained by Direct Gene Transfer to Protoplasts[J].Nature Biotechnology,1992,10(6):691-696.
[19]Spangenberg G,Wang Z Y,Wu X L,etal.Transgenic tall fescue (Festucaarundinacea) and red fescue (F.rubra) plants from microprojectile bombardment of embryogenic suspension cells[J].Journal of Plant Physiology,1995,145(6):693-701.
[20]Dalton S J,Bettany A J E,Timms E,etal.Co-transformed,diploidLoliumperenne(perennial ryegrass),Loliummultiflorum(Italian ryegrass) andLoliumtemulentum(darnel) plants produced by microprojectile bombardment[J].Plant Cell Reports,1999,18(9):721-726.
[21]Dalton S J,Bettany A J E,Timms E,etal.Transgenic plants ofLoliummultiflorum,Loliumperenne,FestucaarundinaceaandAgrostisstoloniferaby silicon carbide fibre-mediated transformation of cell suspension cultures[J].Plant Science,1998,132:31-43.
[22]Bettany A J E,Datton S J,Timms E,etal.Agrobacterium tumefaciens-mediated transformation ofFestucaarundinacea(Schreb.) andLoliummultiflorum(Lam.)[J].Plant Cell Reports,2003(21):437-444.
[23]胡张华,陈锦清,吴关庭,等.农杆菌介导的高羊茅高效遗传转化和转基因植株再生[J].植物生理与分子生物学学报,2005,31(2):149-159.
[24]Ha S B,Wu F S,Thorne T K.Transgenic turf-type tall fescue (FestucaarundinaceaSchreb.) plants regenerated from protoplasts[J].Plant Cell Reports,1992,11:601-604.
[25]Wang G R,Binding H,Posselt U K.Fertile transgenic plants from direct gene transfer to protoplasts ofLoliumperenneandLoliummultiflorium[J].Journal of Plant Physiology,1997,151(1):83-90.
[26]Inokuma C,Sugiura K,Imaizumi N,etal.Transgenic Japanese lawngrass (ZoysiajaponicaSteud.) plants regenerated from protoplasts[J].Plant Science,1998,17(5):334-338.
[27]Chai M L,Wang B L,Kim J Y,etal.Agrobacterium-mediated transformation of herbicide resistance in creeping bentgrass and colonial bentgrass[J].Journal of Zhejiang University Science,2003,4(3):346-351.
[28]马菊兰.苜蓿花药培养预处理方法和培养基的研究[D].乌鲁木齐:新疆农业大学,2007.
[29]耿小丽.利用花药培养诱导苜蓿单倍体的研究[D].兰州:甘肃农业大学,2007.
[30]段承俐,张智慧,文国松,等.三七花药培养的研究[J].云南农业大学学报,2004,19(5):510-513.
[31]吴中心,张同庆,姚根怀,等.利用花药培养系统选育烟草抗赤星病品系[J].农业生物技术学报,1994,2(1):78-83.
[32]Yazaki K,Matsuoka H,Ujihara T,etal.Shikonin biosynthesis inLithospermumerythrorhizon:Light-induced negative regulation of secondary metabolism[J].Plant Biotechnology,1999,16(5):335-342.
[33]郑光植,王世林,何静波.三七、人参和西洋参细胞悬浮培养的比较研究[J].云南植物研究,1989,11(1):97-102.
[34]吴双秀.高山红景天颗粒状愈伤组织悬浮培养和红景天甙的诱导[D].哈尔滨:东北林业大学,2001.
[35]M′Ribu H K,Veilleux R E.Effect of genotype,explant,subculture interval and environmental conditions on regeneration of shoots from in vitro monoploids of a diploid potato species,SolanumphurejaJuz.& Buk[J].Plant Cell,Tissue and Organ Culture,1990,23(3):171-179.
[36]刘建平,袁振东,胡道芬.冬小麦不同基因型对花药愈伤组织诱导率的影响[J].农业新技术,1985(5):8-10.
[37]何道一,李雅志,王其会.不同基因型苹果的离体再生特性及其对NaN3的反应[J].核农学报,1997,11(2):84-88.
[38]何勇,田志宏,郑用琏.高羊茅成熟胚离体培养及高频植株再生[J].草业科学,2005,22(6):23-28.
[39]陈正华.木本植物组织培养及其应用[M].北京:高等教育出版社,1986.
[40]郭军战,费昭雪,成密红.红掌不同外植体愈伤组织诱导与不定芽分化的研究[J].西北林业学院学报,2006,21(3):72-74.
[41]王强龙,王锁民,张金林,等.紫花苜蓿体细胞胚高频再生体系的建立[J].草业科学,2006,23(11):21-27.
[42]陈季琴,韩烈保,杨纯奇,等.不同外植体对多年生黑麦草愈伤组织诱导的影响[J].草原与草坪,2005(4):42-46.
[43]冯波.多浆旱生植物霸王组培再生体系的建立[D].兰州:兰州大学,2010.
[44]杜永光,郝丽珍,王萍.植物组织培养中琼脂浓度和pH对培养基凝固程度的影响[J].植物生理学通讯,2005,41(5):623.
[45]杜雪玲,张振霞,刘萍,等.2,4-D和6-BA对多年生黑麦草愈伤组织诱导影响的研究[J].草原与草坪,2005(3):49-51.
[46]杨茹,袁庆华,曹致中,等.2,4-D和BA对黑麦草不同外植体愈伤组织诱导与分化的影响[J].中国草地学报,2008,30(4):34-39.
[47]胡张华,陈火庆,吴关庭,等.高羊茅悬浮细胞系的建立及绿色植株的高频再生[J].草业学报,2003,12(3):95-99.
[48]张丽杰,陈晓旭,周强,等.光照、琼脂和碳源对桃叶卫矛腋芽离体培养的影响[J].辽宁林业科技,2009(1):31-34.
[49]黄冰艳,刘文轩,刘新涛,等.激素及光照对甘薯茎尖分生组织培养的影响[J].华北农学报,1999,14(2):1-5.
[50]涂艺声,王碧琴,江洪如,等.不同色光、温度、pH对草珊瑚愈伤组织的培养效应[J].江西科学,1994,12(2):85-89.
[51]何松林,孔德政,杨秋生,等.组织培养容器环境因子调控技术研究进展[J].河南农业大学学报,2003,37(1):25-32.
[52]尹品训,杨明,郭鸿彦,等.大麻组织培养中玻璃化苗研究初报[J].云南农业科技,2004(4):12.
[53]王艳,曾幼玲,张富春,等.新疆甘蓝型油菜下胚轴的组织培养和植株再生研究[J].新疆农业科学,2005,42(1):24-28.
[54]赵军良,逯宝德,赵美华.大白菜无菌苗子叶组织培养再生植株[J].华北农学报,2004,19(2):17-19.
[55]张鹏,傅爱根,王爱国.AgNO3在植物离体培养中的作用及可能的机制[J].植物生理学通讯,1997,33(5):376-379.
[56]许本波,张学昆,殷家明,等.培养条件对甘蓝型黄籽油菜下胚轴的再生影响[J].中国油料作物学报,2003,25(4):23-26.
[57]Ding Z S,Tian S P,Meng X H,etal.Hydrogen peroxide is correlated with browning in peach fruit stored at low temperature[J].Frontiers of Chemical Engineering in China,2009,3(4):363-374.
[58]钱永强.野牛草成熟胚愈伤组织褐化诱因及其离体植株再生研究[D].北京:北京林业大学,2005.
[59]孙丽娟,关洪斌,赵晶,等.无花果组织培养中防止外植体褐化的研究[J].安徽农业科学,2009,37(2):535-536.
[60]王文静,王鹏,左金淼.鸢尾组织培养中防褐化技术研究[J].安徽农业科学,2009,37(15):6858-6859,6891.
[61]刘闻川,余慧,娜戎华,等.不同光照条件对槲蕨组织培养外植体褐化的影响[J].广东农业科学,2008(8):22-25.
[62]曹孜义.实用植物组织培养技术教程[M].兰州:甘肃科学技术出版社,2001:20-37.
[63]陶铭.组织培养中畸形胚状体及超度含水态苗的研究[J].西北植物学报,2001,21(5):1048-1058.
[64]Matsumoto T,Mochida K,Itamura H,etal.Cryopreservation of persimmon (DiospyroskakiThunb.) by vitrification of dormant shoot tips[J].Plant Cell Reports,2001,20(5):398-402.
[65]Huang C N,Wang J H,Yan Q S,etal.Plant regeneration from rice (OryzasativaL.) embryogenic suspension cells cryopreserved by vitrification[J].Plant Cell Reports,1995,14(11):730-734.
[66]高国训,李光晨,张潞生.逆转苹果试管苗玻璃化的研究[J].华北农学报,1997,12(专辑):48-51.
[67]张燕玲,姚军,王润珍,等.满天星组织培养中克服玻璃化现象的初探[J].广西植物,1997,17(3):246-248.
[68]赵佐敏.非洲菊组培苗玻璃化控制研究初报[J].贵州农业科学,2005,33(3):77.
[69]彭爱红,何永睿,邹修平,等.观赏植物组织培养与基因工程研究进展[J].亚热带植物科学,2002,31(2):58-63.
[70]杨耀文,钱子刚,谢晖,等.珍稀濒危药用植物金铁锁的组织培养和快速繁殖研究[J].世界科学技术-中医药现代化,2003,5(4):56-60.
[71]李长潇,郑铁松,郭海涛,等.中药甘草的快速繁殖[J].植物学通报,1986,4(1-2):84-85.
[72]李红,李波,赵洪波,等.诱变处理苜蓿愈伤组织抗碱性的研究[J].草业科学,2009,26(7):32-35.
[73]李波,袁成志,陈辉,等.硫酸二乙酯诱变苜蓿愈伤组织抗寒生理的研究[J].草业科学,2004,21(5):20-22.
[74]张俊卫,包满珠,孙振元.草坪草的遗传转化研究进展[J].林业科学研究,2003,16(1):87-94.
[75]周荣仁,杨燮荣,季玉鸣,等.烟草耐盐愈伤组织变异体对盐渍的适应性[J].植物生理学报,1993,19(2):188-194.
[76]梁称福.植物组织培养研究进展与应用概况[J].经济林研究,2005,23(4):99-105.
[77]罗士伟.我国植物组织细胞培养的应用[J].陕西林业科技,1979,1(2):63.
[78]吕春茂,范海延,姜河,等.植物细胞培养技术合成次生代谢物质研究进展[J].云南农业大学学报,2007,22(1):1-7.
