苜蓿假盘菌的生物学特性研究
2011-04-25钟少林王华荣
钟少林,王华荣,史 娟,2,3
(1.宁夏大学农学院,宁夏 银川 750021;2.宁夏大学草业科学研究所,宁夏 银川 750021;3.西北退化生态系统恢复与重建教育部重点实验室,宁夏 银川 750021)
苜蓿褐斑病是世界苜蓿(Medicagosativa)生产中危害最严重的病害之一,也是中国苜蓿生产中的主要病害。宁夏平均每年因该病害造成的产量损失为40%~60%[1]。苜蓿褐斑病病原菌可以危害所有的栽培苜蓿,还可侵染白花草木樨(Melilotusalbua)、红豆草(Onobrychisviciaefolia)、蓝胡卢巴(Trigonellacoerulea)、山野豌豆(Viciaamoena)以及红三叶草(Trifoliumrepens)等豆科牧草植物,大田侵染后常造成苜蓿植株1/3~2/3叶片枯死脱落[2],降低干草和种子的品质,而且感染褐斑病的苜蓿因香豆雌酚等类黄酮物质的大量增加,引起采食家畜流产、不育等疾病[3]。袁庆华等[4]对来自北京、新疆、内蒙古、甘肃、山西等苜蓿假盘菌菌株进行了培养性状的研究,发现不同地理来源的苜蓿假盘菌菌株培养性状存在显著差异,且存在致病性分化现象,但有关苜蓿假盘菌宁夏菌株生物学特性的报道甚少[5-6],因此研究宁夏菌株生物学特性对于了解不同生态区域条件下病原菌的生长繁殖规律以及对指导苜蓿病害田间的综合治理具有重要意义[7-8]。
1 材料与方法
1.1材料 供试菌种为苜蓿假盘菌(Pseudopezizamedicaginis),由宁夏大学草业科学研究所提供,于2005年9月采用子囊孢子单孢分离法和常规组织块分离法分离,从宁夏固原原州区种植的阿尔冈金苜蓿病叶上分离得到,用20%V8汁碳酸钙琼脂培养基[V8汁液200 mL(V8汁为美国进口)、碳酸钙 2 g、琼脂17 g、蒸馏水800 mL。培养基配制好后用1 mol/L盐酸和1 mol/L氢氧化钠调pH值为6.0]培养。
1.2孢子悬浮液的制备 选取生长30 d左右成熟好的菌落,置于灭菌的小烧杯中,加入灭菌水2 mL,用灭菌的镊子充分将菌落捣碎,显微镜下观察有大量子囊和子囊孢子的即为子囊孢子悬浮液(孢子浓度为3.0×105~1.5×106个/mL)。
1.3温度对苜蓿假盘菌生长的影响 选用的基础培养基为20%V8汁碳酸钙琼脂培养基。分别吸取15 mL的孢子悬浮液,接种于培养基上,分别置于5、10、15、20、25、30、35和40 ℃黑暗培养30 d,统计菌落数并测量菌落直径,每个处理5个重复,试验重复2次。
1.4水分对苜蓿假盘菌子囊孢子释放和萌发的影响 将培养基上成熟的菌落分别移入皿盖上有游离水和无游离水的培养基上,每皿移入5个菌落,均匀放置,10 d后肉眼观察菌落释放孢子情况。
叶片表面游离水保持0、2、4、6、8、10 h共6个梯度,利用离体叶,采用逆向产孢培养法,对接种后12 h的叶片进行透明和染色,光学显微镜下观察孢子萌发情况,每个处理观察50个孢子,计算孢子萌发率。
1.5pH值对苜蓿假盘菌的生长和孢子萌发的影响
1.5.1pH值对苜蓿假盘菌生长的影响 选用的基础培养基为20%V8汁碳酸钙琼脂培养基。用1 mol/L的盐酸和1 mol/L的氢氧化钠将培养基的pH值分别调为2.0、3.0、4.0、5.0、5.5、6.0、6.5、7.0、8.0、9.0、10.0,共11个梯度。培养条件为20 ℃暗培养,培养30 d后统计菌落数、测量菌落直径,并显微观察菌落产盘情况,每一处理至少镜检100个菌落。
1.5.2pH值对苜蓿假盘菌孢子萌发的影响 吸取孢子悬浮液1.5 mL加入离心管,离心(1 000~5 000 r/min,10 min),弃去上清液,取沉淀物少许,分别加入到滴有pH值为2.0、3.0、4.0、5.0、5.5、6.0、6.5、7.0、8.0、9.0和10.0培养基的凹玻片上,置于20 ℃黑暗条件下培养,4 h后镜检子囊孢子萌发,计算孢子萌发率,每次至少镜检同一处理下的100个孢子的萌发情况,孢子萌发统计标准:芽管长度达孢子长度的1/2以上即视为萌发。
1.6光照对苜蓿假盘菌生长的影响 以pH值为6.5的20%V8汁碳酸钙琼脂培养基为接种用培养基,平板上接种15 mL孢子悬浮液,置于20 ℃下光周期分别为12 h光照+12 h黑暗、24 h光照、24 h黑暗环境下培养,30 d后测量其菌落直径,显微观察菌落产盘情况,每一处理至少镜检100个菌落。
1.7苜蓿假盘菌对碳源的利用 以PA[马铃薯(Solanumtuberosum)、琼脂]培养基为基础培养基,称取1.5 g葡萄糖、蔗糖、麦芽糖、乳糖、甘油5种碳源分别加入100 mL PA培养基中,制成含有不同碳源的固体培养基。培养条件同1.3。
1.8苜蓿假盘菌对氮源的利用 以PA培养基为基础培养基,称取0.1 g硝酸钠、硝酸铵、尿素、硫酸铵、草酸铵、L-苯丙氨酸、氨基乙酸、牛肉膏、酵母提取物和蛋白胨10种氮源分别加入基础培养基中,制成含有不同氮源的固体和液体培养基100 mL。固体培养基培养条件同1.3,液体培养基置于20 ℃、黑暗、振荡条件下培养30 d后称量。
1.9苜蓿假盘菌对无机盐的利用 以PDA(马铃薯、葡萄糖、琼脂)为基础培养基,称取0.1 g FeSO4、KCl、KH2PO4、MgSO44种无机盐分别加入100 mL PDA培养基中,制成含有不同无机盐的液体培养基,培养条件同1.8。
2 结果
2.1温度对苜蓿假盘菌生长的影响 该菌在5~35 ℃范围内均能生长,低于5 ℃和高于35 ℃时不生长,5 ℃时生长缓慢,生长20 d后肉眼观察培养基上出现针尖状菌落。最适温度20~25 ℃,生长15 d的菌落直径为1.54 mm(图1)。
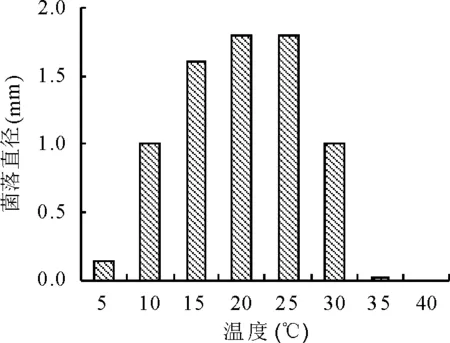
图1 生长30 d后不同温度下苜蓿假盘菌菌落生长情况
2.2水分对苜蓿假盘菌子囊孢子释放、萌发的影响
2.2.1水分对苜蓿假盘菌子囊孢子释放的影响 研究结果表明,在有游离水的培养皿内,从原来的培养基中挑出的菌落能够释放出大量的子囊孢子,且自然弹射出的子囊孢子降落在菌落周围的培养基上,并进一步发育为子代菌落(图2a),子代菌落较小,显微观察(图2b)98%以上的子代菌落都能发育成完整的子囊盘形成子囊和子囊孢子。无游离水的培养皿内部分菌落弹射出孢子,没有移出的原培养基上培养的菌落几乎没有孢子释放,仅有极个别的菌落有孢子弹射的现象,表明水分是制约子囊盘孢子释放量大小的重要因素。
2.2.2水分对苜蓿假盘菌子囊孢子萌发的影响 叶片表面的游离水及游离水保持的时间直接影响孢子的萌发。在无游离水的条件下,孢子基本不萌发(图3)。游离水维持4 h,孢子萌发率达75%,维持6 h,孢子萌发率达95%以上,随湿度保持时间的增加,孢子萌发率逐渐增加。孢子萌发产生的芽管及其结构如图4所示。
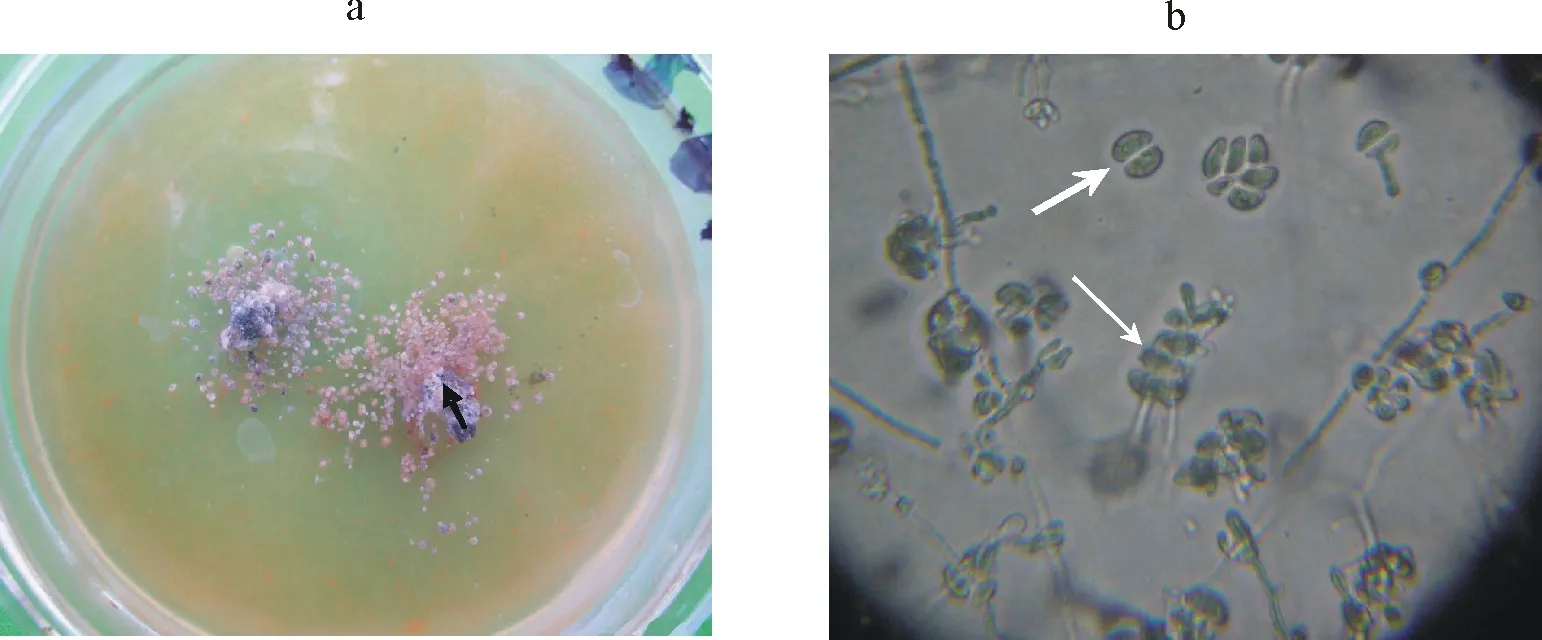
图2 菌落的弹射现象及扩繁后的子代菌落

图3 水分对苜蓿假盘菌子囊孢子萌发的影响

图4 萌发的芽管及其顶端产生的分支
2.3pH值对苜蓿假盘菌生长和子囊孢子萌发的影响
2.3.1pH值对苜蓿假盘菌生长的影响 该菌在pH值4.0~10.0都能生长,以5.0~8.0生长较好。不论是菌落数还是形成子囊盘,均以pH值6.0和6.5为最佳,其子囊成熟率达90%,菌落数为100个左右,表明该菌pH值的生长范围较宽,从产生子囊盘看,pH值4.0和pH值10.0下几乎不形成子囊盘,以pH值6.0~6.5为产盘率最高(表1)。试验表明,该菌进行有性生殖所需要的pH值较窄。pH值1.0、2.0、3.0培养基未凝固,故未进行接种。分析显示,不同pH值对苜蓿假盘菌子囊盘成熟率的影响尤为明显。
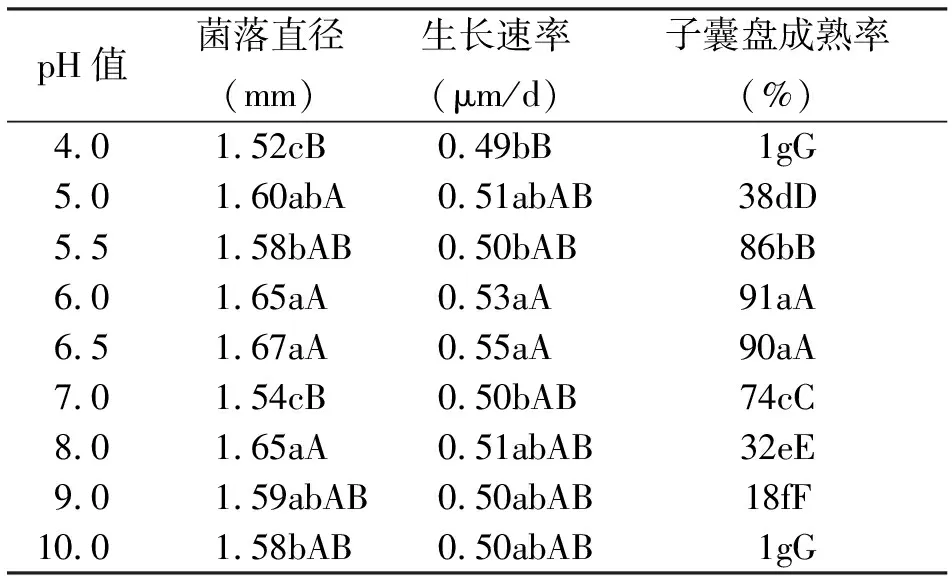
表1 不同pH值对苜蓿假盘菌菌落生长的影响
2.3.2pH值对苜蓿假盘菌子囊孢子萌发的影响 子囊孢子在pH值2.0~10.0范围内均能生长,最适pH值5.0~6.5,pH值6.0时萌发率最高达64%,pH值低于5.0或高于6.5,萌发率呈下降趋势(图5)。表明弱酸条件下有利于病菌子囊孢子的萌发。
2.4光照对苜蓿假盘菌生长的影响 不同光照条件对病菌的生长影响较大,表现在随光照强度的增加,菌落生长呈明显的下降趋势。以黑暗下生长最好,全光照条件下生长最差。病菌在全光照条件下,菌落数极少,仅为5个,显微观察菌丝形态,可见菌丝中有球形膨大体,虽有子囊盘结构,但未观察到分化的子囊;半光照条件下,菌落数为65个,菌落直径为0.8 mm,显微观察,菌丝中有完整的子囊盘和分化出的子囊,但子囊孢子分化不明显;黑暗条件下菌落数和菌落直径的生长均明显优于有光照的条件,显微观察,子囊盘发达,着生在盘上的子囊排列整齐,子囊内可见明显的子囊孢子(表2)。表明光照既不利于病菌生长,也不利于病菌的有性生殖。
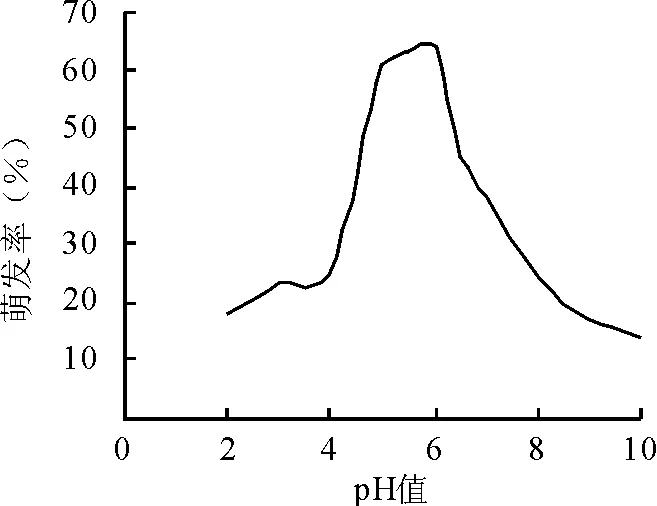
图5 不同pH值对苜蓿假盘菌子囊孢子萌发的影响

表2 不同光照对苜蓿假盘菌生长的影响
2.5碳源对苜蓿假盘菌生长的影响 该菌能利用固体培养基上不同的碳源,但利用能力上有显著差别。病菌对葡萄糖和麦芽糖的利用较好,形成的菌落量大。葡萄糖下只形成黑色菌落,且产盘率达86%;麦芽糖中形成黑色和土黄色2种颜色的菌落,其中黑色菌落产盘率为81%,土黄色菌落不形成子囊盘;蔗糖形成土黄色菌落,不形成子囊盘;甘油形成黑色和土黄色2种颜色的菌落,其中黑色菌落产盘率为28%,土黄色菌落不产盘(表3)。不同碳源条件下,菌落颜色不同。乳糖培养基上不形成子囊盘。表明葡萄糖和麦芽糖不仅有利于病菌的生长,且有利于病菌进行有性生殖,乳糖抑制有性生殖。
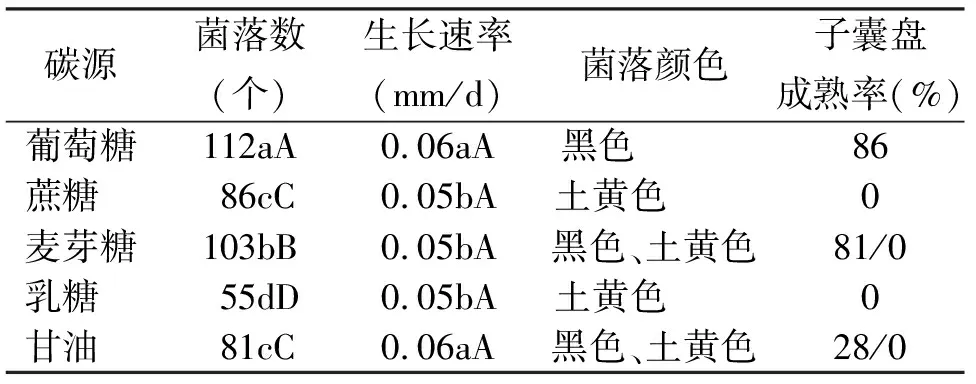
表3 不同碳源对苜蓿假盘菌菌落生长的影响
2.6氮源对苜蓿假盘菌生长的影响 在固体培养基上,10种供试氮源中,除尿素外,该菌均能不同程度利用无机氮源和有机氮源。菌落直径和生长速率基本一致,差异不显著,菌落数差别较大,无机氮源优于有机氮源,表明该菌对无机氮源的利用能力强于有机氮源(表4)。在液体培养基中,病菌除不能利用氨基乙酸和尿素外,对其余8种氮源均能利用。有机氮源优于无机氮源,表明液体培养条件下,病菌对有机氮源的利用能力强于无机氮源。无论是固体培养还是液体培养,尿素均抑制病菌的生长。
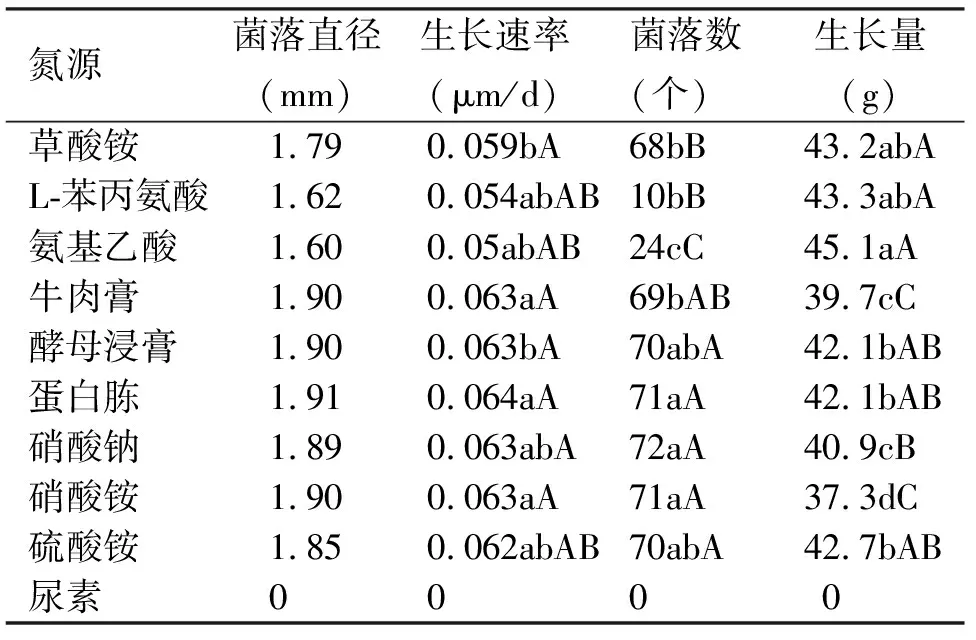
表4 不同氮源对苜蓿假盘菌生长的影响
2.7无机盐对苜蓿假盘菌生长的影响 供试的4种盐溶液,除KH2PO4没有菌落生长外,其余3种盐溶液下菌落生长较好,且生长量基本一致,FeSO4生长量为42.9 g,KCl生长量为43.3 g,MgSO4生长量为43.3 g。肉眼观察,培养液中菌落均不悬浮,互相粘连,黏着于培养瓶的底部。显微观察,发现这4种盐溶液下生长的菌落均不产生子囊盘。表明无机盐对该菌的有性生殖不是必需的。
3 讨论与结论
本试验中利用组织块分离法亦分离出了苜蓿假盘菌菌株,与袁庆华等[4]报道有异,pH值大于6.0时,苜蓿假盘菌宁夏菌株亦产盘。分离菌株选用V8汁碳酸钙琼脂培养基,其上亦有粉红菌落的产生,王蓟华等[6]亦有相同报道,且扩繁时该颜色菌落只产生粉红色的子代菌。当供试碳源为葡萄糖时,仅有黑色菌落出现,为蔗糖和乳糖时,仅有土黄色菌落出现,为麦芽糖和甘油时2种颜色均有,表明碳源对菌落的颜色影响很直接。可进一步研究颜色分化与致病力的关联性,筛选弱毒性菌株,对其致病力分化作分子生物学上的深入研究。
苜蓿假盘菌宁夏菌株对生态条件的适应范围较广,在5~35 ℃,pH值4.0~10.0均能生长,但是尿素能抑制该菌的生长,盐溶液中KH2PO4没有菌生长,从有性生殖角度来看,4种盐溶液下生长的菌落均不产生子囊盘,pH值亦是其进行有性生殖的主要限制因素。故该菌对有性生殖的条件是极其严格的,利用这些特性可为该病害的无公害防治提供思路。
苜蓿假盘菌随光照强度的增加,生长受到抑制,说明不同纬度和季节的光照状况对病菌的生长有影响。据报道[9],病菌致病力在地理上存在分化现象,且该菌是一种易发生变异的真菌[4],今后应加强宁夏菌株与寄主互作过程中病菌变异的遗传基础及群体遗传结构变异机制的研究,特别是分子机制上的研究。
本研究结果表明,水分是病菌子囊孢子释放和萌发的关键。病菌的这种对水分的特殊要求与宁夏南部山区苜蓿褐斑病发生和流行条件相一致,这也可以解释宁夏南部山区苜蓿褐斑病发生和流行重于川区的原因,同时也说明为何雨后苜蓿褐斑病容易爆发和流行,明确这一规律为田间该病害流行的预警发布提供依据。
[1]张蓉,马建华,王进华,等.宁夏苜蓿病虫害发生现状及防治对策[J].草业科学,2003,20(6):40-44.
[2]袁庆华,桂枝.苜蓿褐斑病研究[M].北京:化学工业出版社,2006:2-3.
[3]Morgan W C,Parbery D G.Effects ofPseudopezizaleaf spot disease on growth and yield in lucerne[J].Australian Journal of Agricultural Research,1977,28(6):1029-1040.
[4]袁庆华,李向林,张文淑.苜蓿假盘菌及其生物学特性的研究[J].植物保护,2001,27(1):8-12.
[5]史娟,贺达汉,王蓟华.不同培养条件下苜蓿假盘菌培养特性及分离方法的研究[J].西北农业学报,2007,16(3):260-263.
[6]王蓟华,史娟,于有志.不同培养基上苜蓿假盘菌生长状况及形态学研究[J].农业科学研究,2007,28(1):15-17.
[7]史娟,贺达汉,冼晨钟,等.宁夏南部山区苜蓿褐斑病田间发生及流行动态[J].草业科学,2006,23(12):93-97.
[8]李治强.紫花苜蓿与垂穗披碱草混播防治褐斑病试验[J].草业科学,2009,26(10):177-180.
[9]袁庆华,马鸿文,徐秉良.苜蓿假盘菌致病力分化研究[J].草地学报,2007,15(4):312-315.
