大鼠弥漫性轴索损伤脑干AQP4表达和磁共振弥散张量成像研究
2011-04-16马春林郑文斌詹伏兰孔令梅张海都
马春林,郑文斌,詹伏兰,孔令梅,张海都
(1.珠海市第二人民医院影像科,广东 珠海 519020;2.汕头大学医学院第二附属医院影像科,广东 汕头 515041)
弥漫性轴索损伤(Diffuse axonal injury,DAI)是指头部遭受特殊钝性外力产生突然加速-减速和/或旋转运动时,在剪应力的作用下,脑内发生的广泛分布的以神经轴索断裂为特征的一系列病理生理变化,是一种常见的闭合性脑外伤,其致残率较高,是颅脑损伤后神经、精神功能障碍的常见原因之一。近年来,我国交通事故日益增多,DAI呈明显上升趋势。
DAI后脑水肿是影响患者预后的重要原因,脑水肿发病机制与多种因子如水通道蛋白-4、基质金属蛋白酶、巨噬细胞炎性蛋白-2等有关,国内外许多研究证实脑外伤后水通道蛋白AQP4在局部表达增高和脑水肿密切相关[1],并且AQP4表达增高的区域和脑水肿出现的区域也一致。
磁共振弥散张量成像技术 (Diffusion tensor imaging,DTI)不仅反映水分子的布朗运动,还可定量分析水分子在不同方向上扩散的各向异性。
本文通过复制大鼠DAI动物模型,利用DTI技术对大鼠DAI后脑干部早期表观弥散系数(Apparent diffusion coefficient,ADC)、部分各向异性(Fractional anisotropy,FA)的变化进行观察,研究AQP4在DAI早期脑水肿过程中的表达规律,探讨DAI脑水肿病理基础与AQP4表达的联系,揭示AQP4的表达与DTI的相关性。为活体监测DAI后脑水肿动态变化提供影像学依据,对指导临床制订有效治疗方案具有很大意义。
1 材料与方法
1.1 实验材料
1.1.1 实验动物
健康成年SD雄性大鼠48只,10周龄,体重280~320g,由汕头大学医学院动物中心提供。动物自由进食饮水。动物房7∶00~19∶00光暗交替,相对湿度55%,温度22℃。动物适应环境1周后开始实验。
1.1.2 主要试剂与药品
硝酸银:广州化学试剂厂。水通道蛋白4(AQP4)(BA1560):武汉博士德生物工程有限公司。羊抗兔IgG(ZDR-5306):北京中杉金桥生物技术有限公司。DAB Kit(20x)(DAB-0031):福州迈新生物技术开发有限公司。多聚赖氨酸:武汉博士德生物工程有限公司。
1.1.3 主要实验仪器
GE Signa HDx 1.5T超导磁共振成像仪,3英寸线圈。超纯水机:850EB超纯水系统,法国Millipore S.A.S。微量加样器:德国Eppendorf公司,1ml、200μl、20μl、10μl、2μl。pH计:梅特勒-托利多仪器(上海)有限公司,Delta 320型。TK-C1481BEC病理色彩摄像头:日本奥林巴斯公司。
1.2 方法
1.2.1 实验方案
将大鼠随机分为6组,对照组1组,DAI组5组,每小组8只。DAI组按照Marmarou自由落体致伤模型,分别于损伤后3、6、12、24、72h行MRI检查,包括T1WI,T2WI,DTI。随后立即处死,断头取脑,行病理学检查,包括HE染色,嗜银染色和AQP4免疫组化染色。对照组于MRI扫描后处死,行病理学检查。比较各时间点各项检查的变化。
1.2.2 动物模型
DAI模型制作:采用Marmarou自由落体致伤模型。大鼠腹腔注射10%水合氯醛(0.3ml蛐kg),麻醉后大鼠剪掉顶部毛发,将一元硬币放置于顶骨上,大鼠俯卧于20cm厚的海绵床。500克铁棒通过PVC管从1.8m高处自由坠落打击硬币,注意保持方向,使打击力度垂直向下,防止硬币位置移动。随即撤离海绵床避免二次打击。观察大鼠行为改变(图1)。

1.2.3 MRI检查
大鼠麻醉满意后,毛巾包裹躯干,充分保暖,放置于MRI扫描床,俯卧位,头先进。三平面定位扫描(冠状位,矢状位,横断位各3幅图像,GRE快速扫描)完成后,进行横断面、矢状面及冠状面T1WI、T2WI以及横断面DTI扫描。扫描参数:T1WI:自旋回波(SE),TR 2633ms,TE 23.4ms,层厚3.0mm,层间隔0.0mm,翻转角90°;T2WI:快速自旋回波(FSE),TR 4600ms,TE 109.9ms,层厚 3.0mm,层间隔0.0mm,翻转角90°;DTI:单次激发自旋平面回波序列(SE-EPI),TR 8000ms,TE 109.4ms,层厚3.0mm,层间隔0.0mm,FOV 8cm×8cm,采集矩阵256×256,采集平均次数NEX 1,b值1000s/mm,采集方向为25。
DTI数据处理:MRI扫描完成后将图像传送到工作站AW4.3(GE Mdeiacl system,advantage window 4.3),使用Functool软件进行测量。感兴趣区(ROI)大小为5mm2,置于横断面DTI原始图像脑干部位,为了减少测量时放置ROI受主观因素影响,采用2位有经验的医师测量求平均值。
1.2.4 病理学检查
大鼠MRI扫描完毕后,左心腔4%多聚甲醛充分灌注,迅速开颅取全脑。沿矢状面将大鼠均匀分成6份,去掉最两边的2份,取中间部位的4份,置于4%多聚甲醛固定液中后固定24h。组织块经脱水、透明、石蜡包埋成块。组织切片烤干后行HE及嗜银染色及AQP4免疫组化染色。
免疫组化染色图像分析:应用Image-Pro Plus 6.0显微图像分析系统进行半定量分析,测定免疫反应产物的累积光密度值(IOD值)。选取大鼠脑干部位,每张切片取5个视野,所得数据经计算取每组均值。
1.3 统计学分析
数据用均数±标准差(Mean±SD)表示,用SPSS 13.0统计分析软件进行统计学分析。DAI各组均数分别与对照组行均数样本t检验,ADC与AQP4表达相关性采用Pearson相关分析。P<0.05为有统计学意义,P<0.01为有显著统计学意义。
2 结果
2.1 动物行为观察
Marmarou模型致伤后,出现短时间昏迷,行走不稳,呼吸深慢,全身痉挛,四肢抽搐等症状,有1只大鼠出现一侧肢体瘫痪。
2.2 病理组织学检查结果
2.2.1 大体标本观察
所有大鼠均可见顶部头皮血肿,未见颅骨骨折,脑实质表面未见明显挫裂伤及出血改变。
2.2.2 HE染色观察
正常对照组大鼠脑干脑组织结构清晰,细胞形态正常,染色均匀,血管周围间隙无增宽;DAI组于各时间点可见大鼠脑干内血管腔塌陷,内皮皱缩、血管周围间隙水肿,小血管及毛细血管破裂出血,部分血管腔闭锁,神经细胞肿胀,体积增大,胞浆及核淡染,可见轴索收缩球出现,表现为粉红色圆形或椭圆形小体(图2)。
2.2.3 Bielschowsky’s嗜银染色
对照组:轴索染色均匀,排列规则,走形自然,无增粗、扭曲,无断裂。
DAI组:轴索周围间隙增宽,轴索肿胀、扭曲,可见螺旋状、串珠状改变,粗细不均,部分断裂回缩,可见大量轴索球形成,致伤后3h即出现,随时间增多,24~72h表现最明显(图3)。
2.2.4 AQP4免疫组织化学染色
对照组:大鼠脑干内有AQP4表达,平均光密度值(IOD)为0.222±0.005,但轴突中未见其积聚表达。
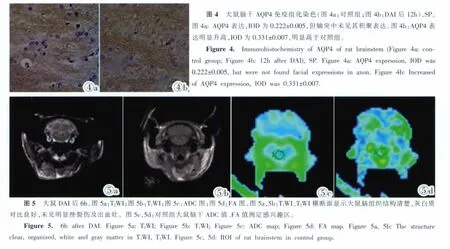
DAI组:致伤后大鼠脑干AQP4表达明显升高(图4),3h即开始,随时间变化逐步升高,于24h达到顶峰,IOD为0.331±0.007,72h有所下降,IOD为0.320±0.004,但仍明显高于对照组。各时间点IOD与对照组进行均数t检验,差别均有统计学意义(P< 0.05)(表1)。
2.3 磁共振扫描结果
2.3.1 常规磁共振扫描结果
DAI各组T1WI、T2WI横断面、矢状面显示大鼠脑组织结构清楚,灰白质对比模糊,未见明显挫裂伤及出血灶,未见蛛网膜下腔出血,颅内未见明显异常信号灶,大鼠顶部头皮血肿(图5a,5b)。
2.3.2 DTI扫描结果

ADC值测量结果 (图5c):对照组大鼠脑干ADC值为0.895±0.121,致伤后3h轻微升高,3~12h升高迅速,于12h达到顶峰,ADC值为1.584±0.200,随后下降,72h明显减低,ADC值为0.660±0.127,低于对照组。DAI组各时间点与对照组进行样本均数t检验,DAI后6h、12h与对照组之间的差别有统计学意义 (P<0.05),72h与对照组差别有显著统计学意义(P<0.01)(表1)。
FA值测量结果(图5d):对照组大鼠脑干FA值为0.421±0.006,致伤后FA值持续下降,于72h达到最低值,FA值为0.255±0.005。DAI组各时间点与对照组进行样本均数t检验,各组之间的差别有明显统计学意义(P<0.01)(表1)。
2.4 AQP4表达与ADC值、FA值相关性分析
在12h内,AQP4表达增加(图6),ADC值升高(图7),AQP4表达与ADC值具有显著相关性,相关系数r=0.691(P<0.01)。12~24h,AQP4表达先增加并于24h达到顶峰,ADC值降低,二者没有相关性(P> 0.05)。24~72h,AQP4表达与ADC值均减低,二者具有相关性,相关系数r=0.608(P<0.05)。AQP4表达与FA值(图8)相关性分析:二者具有显著相关性,相关系数r=-0.946(P<0.01)。
3 讨论
Marmaro等用重物打击大鼠头部,制造出打击负荷DAI模型[2-3],这种模型设备简便、可重复性较好,本实验成功复制了DAI模型,HE染色可见大鼠脑干明显的水肿改变,嗜银染色示轴索肿胀、扭曲,大量轴索球清晰可见,在致伤后3h即出现,24~72h达到高峰。
脑水肿发病机制与多种因子如水通道蛋白-4、基质金属蛋白酶、巨噬细胞炎性蛋白-2等有关,AQPs是构成水通道并与水通透有关的细胞膜转运蛋白,可通过调节水分子跨膜转运来调节细胞外间隙和K+的浓度,AQP4是其一种亚型,在脑内含量最多[4],主要在血-脑和脑脊液-脑的交界面上的星形胶质细胞上表达,对维持脑内水平衡起着非常重要的作用。国内外许多研究证实脑外伤后AQP4在局部表达增高和脑水肿密切相关[1,5],并且AQP4表达增高的区域和脑水肿出现的区域也一致。Manley等[6]对急性水中毒脑水肿动物模型的研究发现,AQP4在水肿模型的脑组织内表达增强,说明AQP4参与了脑水肿的形成,并在其中起重要作用。DAI损伤机制复杂,特别是继发损伤,脑灌注压不足、脑组织氧代谢障碍、脑内过度炎性反应、受损脑组织对继发性损伤的敏感性增强、脑伤后致伤因子的释放增加等,导致脑水肿多种类型共存,而且是动态变化的过程。Stone等[7]研究证实轴索损伤不是外力所引起的原发性改变,而是由缺氧或脑水肿造成的继发性改变,而神经轴索损伤的发展又与脑水肿造成的继发性改变有着极为密切的关系。本实验显示弥漫性轴索损伤后脑干部AQP4表达先升高后降低改变,推测与DAI后脑水肿的类型、程度及时间密切相关。
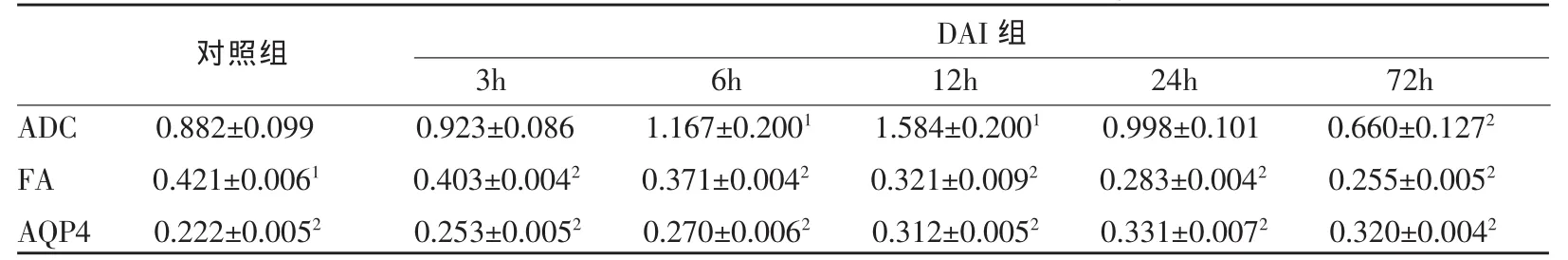
表1 对照组及DAI组各时间点大鼠脑干ADC、FA及AQP4表达情况

DTI利用水分子弥散的各向异性,通过改变弥散敏感梯度方向,在三维空间定量体素内水分子在各个方向上的弥散运动。通过测定FA值和ADC值定量分析反应脑组织结构完整性和水肿情况,在活体水平无创的观察DAI后脑水肿及轴索的病理改变。Barzo等[8]应用撞击致大鼠严重DAI模型,进行连续脑MRI扫描观察,发现致伤后40~60min内出现ADC值短暂升高,随后持续性降低,于7~14d最低值。Schaefer等[9]统计了ADC的变化情况,64%以上的情况下,ADC值表现为降低趋势。FA主要反映组织结构的完整性,组织结构受到破坏,FA也就相应降低。DAI后FA值降低,降低程度与轴索损伤程度密切相关[10];在不同的损伤部位及模型中,胼胝体、外囊、小脑角、双侧额叶、颞叶等[11-15]均可出现FA改变,而且这些改变都表现为降低趋势。本实验在DAI伤后3~72h内,ADC值出现先增高后降低的改变,而FA值则在致伤后持续下降,两者均在72h达到最低值。与文献报道基本一致。
那么,大鼠DAI后AQP4表达与磁共振ADC值、FA值是否存在一定会的相关性呢,我们进行了相关研究:研究结果发现,在DAI后12h内,ADC值升高,AQP4表达增加,ADC值与AQP4表达存在统计学意义的相关性。分析原因,我们认为在损伤后早期由于机械外力的直接损伤等因素,导致血脑屏障破坏,血管源性水肿形成并占据主要地位,此时细胞外液增加,脑组织中细胞外间隙扩大,水分子弥散增加,出现ADC值升高,FA值降低。为了加速血管源性脑水肿的清除,机体出现保护性措施—上调AQP4含量。
在DAI后12~24h,血管源性继续存在,AQP4表达增加,为清除细胞间液体,AQP4一方面是通过跨细胞转运,使液体重吸收入脑脊液循环,另一方面,也使部分液体进入细胞内,这也在一定程度上易化了细胞毒性脑水肿的形成。细胞毒性脑水肿所占比重开始上升。细胞毒性脑水肿造成ADC值降低,由于两者水肿的同时影响,AQP4表达与ADC值没有统计学意义相关性。
到了24~72h,血管源性水肿消退,上调AQP4的使动力减弱,此时由于缺血缺氧等继发损伤,脑组织以细胞毒性脑水肿为主,为了减轻AQP4的易化作用,机体下调AQP4含量。两因素相继和持续作用,AQP4表达明显下降。此期ADC值仍下降。
本研究表明:Marmarou自由落体致伤模型导致的大鼠DAI中,AQP4表达、ADC值及FA值均随时间变化,联合AQP4和ADC值的相关性,能够反映大鼠DAI后脑水肿的类型及演变,0~12h内以血管源性脑水肿为主,12~24h血管源性脑水肿开始消退,细胞毒性脑水肿加剧,24~72h以细胞毒性脑水肿为主。为临床针对不同类型脑水肿的提供治疗依据。
[1]Amiry-Moghaddam M,Frydenlund DS,Ottersen OP.Anchoring of aquaporin-4 in brain:molecular mechanisms and implications for the physiology and pathophysiology of water transport[J].Neuroscience,2004,129(4):999-1010.
[2]Marmarou A,Foda MA,van dan Brink W,et al.A new model of diffuse brain injury in rats,Part I pathophysiology and biomechanics[J].J Neurosurg,1994,80(2):291-300.
[3]Raghupathi R,Huh JW.Diffuse brain injury in the immature rat: evidence for an age-at-injury effect on cognitive function and histopathologic damage[J].J Neurotrauma,2007,24(10):1596-1608.
[4]Badaut J,Lasbennes F,Magistretti PJ.Aquaporins in brain:distributions,physiology,and pathophysiology[J].J Cereb Blood Flow Metab,2002,22(4):367-378.
[5]Hu H,Yao HT,Zhang WP.Increased expression of aquaporin-4 in human traumatic brain injury and brain tumors[J].J Zhejiang Univ Sci B,2005,6(1):33-37.
[6]Manley G,Fujimura M,Ma L.Aquaporin-4 deletion in mice reduces brain edema after acute water intoxication and ischemic stroke[J].Nat Med,2000,6(2):l59-163.
[7]Stone JR,Singleton RH,Povlishock JT.Intra-axonal nerurofilament compaction dose not evoke local axonal swelling in all traumatically injured axons[J].Exp Neurol,2001,172(2):320-331.
[8]Barzo P,Marmarou A,Fatouros P,et al.Contribution of vasogenic and cellular edema to traumatic brain swelling measured by diffusion-weighted imaging[J].J Neurosurg,1997,87(6):900-907.
[9]Schaefer PW,Grant PE,Gonzalez RG.Diffusion-weighted MR imaging of the brain[J].Radiology,2000,217(2):331-345.
[10]Rutgers DR,Fillard P,Paradot G,et al.Diffusion tensor imaging characteristics of the corpus callosum in mild,moderate,and severe traumatic brain injury[J].AJNR,2008,29:1730-1735.
[11]Newcombe VF,Willliams GB,Nortje J,et al.Analysis of acute traumatic axonal injury using diffusion tensor imaging[J].Br J Neurosurg,2007,21(4):340-348.
[12]Cernak I,Vink R,Zapple DN,et al.The pathobiology of moderate diffuse traumatic brain injury as identified using a new experimental model of injury in rats[J].Neurobiol Dis,2004,17 (1):29-43.
[13]MacDonald CL,Dikranian K,Song SK,et al.Detection of traumatic axonal injury with diffusion tensor imaging in a mouse model of traumatic brain injury[J].Exp Neurol,2007,205(5): 116-131.
[14]Hong JH,Kim OL,Kim SH,et al.Cerebellar peduncle injury in patients with ataxia following diffuse axonal injury[J].Brain Res Bull,2009,28(8):30-35.
[15]Greenberg G,Mikulis DJ,Ng K,et al.Use of diffusion tensor imaging to examine subacute white matter injury progression in moderate to severe traumatic brain injury[J].Arch Phys Med Rehabil,2008,89(12 suppl):S45-S50.
