解剖 M型超声心动图对骨髓间充质干细胞移植前后心脏结构和功能的研究
2011-04-13张军辉曹礼庭张小明董国礼刘兴华
张军辉,李 媛,曹礼庭,张小明,董国礼,顾 鹏,刘兴华,张 青
(医学影像学四川省重点实验室,川北医学院附属医院超声科,四川南充 637000)
骨髓间充质干细胞(mesenchymal stem cells,MSCs)移植治疗心肌梗死是近年国内外医学领域的研究热点。在对心肌梗死病情严重程度及治疗效果评价方面,超声检查有着重要的作用。解剖 M型超声(anatomic M-mode echocardiography,AME)能全方位对心室壁的厚度及局部功能进行测量,能客观评价心肌梗死的范围及部位。介入栓塞法是一种建立急性心肌梗死(acute myocardial infarction,AMI)动物模型较稳定的方法。目前,应用AME观察介入栓塞法猪 AMI并经MSCs移植治疗后心脏结构及功能变化的研究报道较少。因此,本研究拟采用该方法建立猪 AMI模型,应用 AME评价其结构和功能变化,为临床应用提供实验依据。
1 材料与方法
1.1 实验准备:贵州种小型猪 8只,雌雄不限,月龄8~12个月,体质量 30~45 kg,平均(35.5±5.2)kg,由成都达硕生物科技有限公司提供。MSCs来源于川北医学院附属医院风湿免疫研究所细胞培养中心。
1.2 动物模型与仪器
1.2.1 实验动物模型的建立:小型猪术前禁食 12 h,禁水6 h。用氯胺酮 12mg/kg,安定 0.2mg/kg耳后肌肉注射使其麻醉。动物安静后,用 22 G留置针于耳缘处建立静脉通道,配制氯胺酮 500 mg、安定20mg与 500ml生理盐水混合液,经静脉滴注维持麻醉。用桡动脉穿刺针穿刺右侧股动脉,置入 5F动脉鞘,在导丝引导下,插入左冠状导管超选行左冠状动脉造影,证实进入左冠状动脉后插入 3F微导管,于左冠状动脉前降支/对角支远端造影并证实,透视下缓慢推入 3条 10 mm长的 4号蓝色丝线线段。栓塞后心电图示有心肌缺血或梗死改变(T波倒置、ST段抬高等)。回退微导管于左冠状动脉口进行造影,证实前降支/对角支远端闭塞。术前2 d及术后用抗生素预防感染。术后 2周,经皮冠状动脉途径移植 MSCs,操作步骤同 AMI建模过程,MSCs的注射部位为通过介入超选至栓塞冠脉的近端血管,移植的 MSCs数量约为 1×107个。
1.2.2 仪器设备:使用日本 Alokaα-10彩色多普勒超声诊断仪,选用 UST-52105相控阵探头,探头频率 1-5 MHz。GE Advantx-Lcv-Plus数字减影血管造影机检查床。
1.3 实验方法:所有动物模型均行超声心动图检查,取仰卧位,稍偏向左侧,于右侧心前区探查。分别记录 AMI前、MSCs移植前后的心脏超声图像。按照美国心脏病学会推荐的方法[1],将左心室室壁划分为 16个节段(除外心尖帽)。获取胸骨旁左心室短轴观,在二维超声图像质量满意时,启动 AME模式,使用 1-3条取样线,将取样线通过二尖瓣瓣尖、乳头肌水平短轴观,即观察前壁 -下壁、前间隔-后侧壁、后间隔 -前侧壁;取心尖水平短轴观,观察前壁-下壁、室间隔 -侧壁,并使取样线尽量位于这些节段的中部且垂直于心内膜面,分别测量各节段室壁运动搏幅(amplitude,Am)。在胸骨旁左心室长轴观,于标准Ⅱa区测量左心室舒张末期内径(left ventricular end diastolic diameter,LVEDd)。取心尖四腔心观,用单平面 Simpison法测量左心室射血分数 (left ventricular ejection fraction,LVEF)。AME判断心肌梗死/缺血节段:根据造模前 Am的95%可信区间下限值判定室壁运动异常节段(心肌缺血/梗死节段)。本实验采用 Am≤6 mm即为阳性(图 1A)。

2 结 果
成功制成 AMI模型小型猪 2头。造模未成功 4头,术后死亡 2头。AME判断建模前、MSCs移植前后室壁运动异常的节段数、左心室大小、心功能指标的变化如下:AMI模型建立前室壁运动均正常,MSCs移植前因 AMI模型已建立,共出现 5个节段室壁运动异常,MSCs移植后 1例室壁运动异常节段数明显减少,1例未明显探及运动异常节段 (图1B);2例均表现为 LVEDd有正常 -增大 -减小趋势;LVEF为正常 -减低 -增加趋势。见表 1。
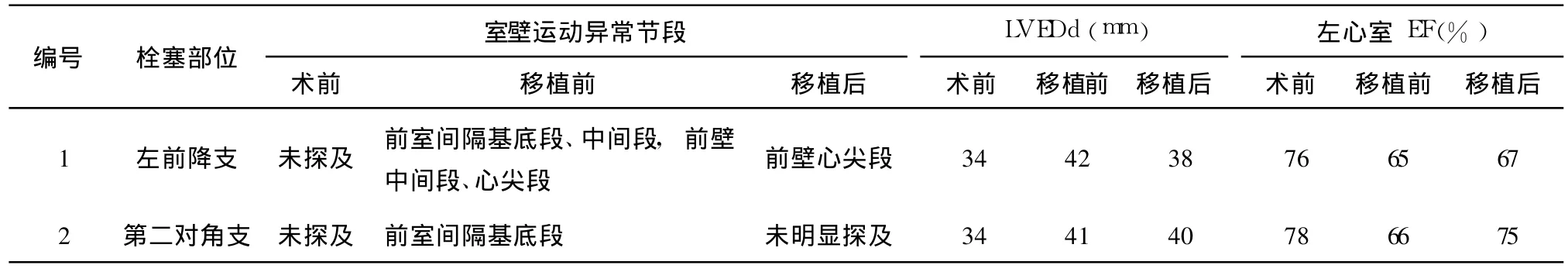
表1 AME对猪 AMI前及 MSCs移植前后观察结果
3 讨 论
AME弥补了传统 M型超声的缺陷,取样线可以在 2DE图像区域内任意旋转和平移,可以对所有部位和运动方向的心血管结构进行 M型成像[2,3],其优点是可通过测量室壁厚度及 Am,较好地反映AMI的部位和心脏收缩功能[4]。
MSCs是存在骨髓腔的一种具有多向分化潜能的干细胞,可以向心肌细胞、造血干细胞支持递质及血管内皮细胞等转化。MSCs移植可能通过改善心肌、基质、血管重构等多种途径共同起作用。
目前建立 AMI模型的动物常见的有兔、大鼠、豚鼠、猪、犬等。小型猪冠状动脉循环系统在解剖学、血流动力学方面与人类相似,是研究人类心血管疾病的最佳动物模型[5]。AMI模型制备的方法常用的是结扎法和介入法。前者需开胸结扎冠状动脉,对实验动物创伤大,长期存活概率低。后者创伤较小,包括球囊堵塞法和栓塞法,球囊堵塞法耗时较长,实验步骤较繁杂[6],梗塞欠恒定;栓塞法造模步骤较简便,梗死较稳定。但本研究实验条件要求仍相对较高、技术较复杂,故仅成功了 2例。
本研究应用 AME对小型猪造模前及 MSCs移植前后左心室长短轴各心肌节段观测的结果表明:MSCs移植后较移植前室壁运动异常节明显减少,LVEDd有正常-增大-减小趋势;左心室收缩功能表现为正常 -减低 -增加趋势。本研究说明 AMI后MSCs移植是有效的,这与国内一些学者报道类似[7]。移植后新生的细胞维持了受损心肌的相对完整性,限制了心室特别是梗死区膨展,抑制了心脏重构;移植细胞增加了心脏的顺应性和弹性,使心室壁富有弹性从而限制了梗死区扩大与心室整体扩张[8]。MSCs移植治疗 AMI,移植细胞可在心肌微环境内存活,并可分化为心肌样细胞,促进新生血管生成,使梗死的心肌组织收缩舒张运动功能得到修复,显著提高 AMI后左心室整体功能。总之,AME能全方位的检测左心室各节段运动情况,可以较好地评价 AMI的部位及 MSCs移植前后左心室的结构与功能。
[1] Manuel D.Cerqueira,Neil J.Weissman,Vasken Dilsizian,et al.Standardized Myocardial Segmentation and Nomenclatur for Tomographic Imaging of the Heart[J].Circulation,2002,105(4):539-542
[2] 胡 杨.M型超声心动图的临床应用[J].心血管病进展,2008,29(5):716-719
[3] Donal E,Coisne D,Pham B.Anatom ic M-mode,a pertinent tool for the daily practice of transthoracic echocardiography.JAm Soc of Echocardiogr,2004,17(9):962-967
[4] 王晓洋,黄朴忠,李 焱,等.解剖 M-型超声心动图对心肌梗死后局部室壁运动参数变化的对比研究[J].中国超声医学杂志,2007,23(9):681-683
[5] 汤宏斌,孔利佳.实验动物学[M].湖北:湖北人民出版社,2006.157-178
[6] 张 蕊,王 健,薛继平,等.猪心肌梗死模型的建立以及心功能的超声评价[J].山西医药杂志,2008,37(11):994-995
[7] Chen Xin-jun,Zhang Hua,Huang Chun-tao et al.Changes in ischemic myocardium following marrow mesenchymal stem cells implantation by echocardiography in rabbits[J].JClReh Tiss Engin Res,2008,12(25):4962-4966
[8] 陈 洁,王建安,骆荣华,等.骨髓间充质干细胞移植对大鼠心肌梗死后心室重构的影响[J].中华急诊医学杂志,2006,15(4):310-314
