糖尿病足截肢患者下肢血管缺氧诱导因子-1α及血管内皮生长因子的表达
2011-04-09袁媛赵明
袁媛,赵明
0 引言
糖尿病下肢血管病变是糖尿病足的重要病理基础,是代谢紊乱、神经营养障碍、氧化应激等多种因素综合作用的结果。血管病变是糖尿病足发生发展的一个重要因素,它不仅是除神经病变和营养障碍外导致糖尿病患者足部感染的主要病因,而且是影响糖尿病足预后的最重要因素。据Walters等[1]报道,1型糖尿病并发周围血管病变的发生率为8.7%,2型糖尿病并发周围血管病变的发生率为23.5%。病变最常见于下肢血管,包括大血管病变和微血管病变2种。研究表明,由于机体持续处于高血糖与蛋白质的非酶糖化状态,脂代谢紊乱,血液的高黏稠、高凝状态以及下肢循环障碍等诸多因素使患者的下肢动脉容易发生血管病变,管壁增厚、管腔狭窄,同时微血管和微循环也有不同程度的障碍,下肢供血逐渐减少,易发生组织损伤。由于目前的研究结果多来源于动物实验,对人组织的研究较少。所以,本研究按照患者的糖尿病情况分组,观察HIF-1α和VEGF在各组截肢患者中表达的改变,探讨它们在糖尿病足中的可能作用。
1 材料与方法
1.1 材料本研究由我科于2008年1月至2009年12月完成。研究对象选自2008年1月至2009年9月在我院住院行截肢术的患者共17例,男10例,女7例,于截肢(大腿中下1/3)手术时留取截肢患者的肢体足背动脉,按患者有无糖尿病情况分糖尿病足组(诊断标准按WHO1999年标准)和对照组(均为外伤截肢患者)。其中糖尿病足组11例,平均年龄(59.91±5.64)岁;对照组6例,平均年龄(47.17±13.95)岁,组间年龄差异无统计学意义(P=0.076)。
1.2 免疫组化方法①组织切片制备:标本均经中性甲醛固定,脱水,石蜡包埋,切片厚约4 μm。②免疫组化SABC法。③主要试剂兔抗人HIF-1α单克隆抗体、兔抗人VEGF、CD34单克隆抗体均购于美国R&D公司;单克隆兔抗人VEGF IgG 1∶100;单克隆兔抗人eNOS IgG 1∶100;SABC试剂盒;DAB显色试剂盒,以上试剂均由美国R&D公司提供。④免疫组化SABC法程序:按照试剂盒说明书方法染色,所有切片染色均在相同条件下进行,每批染色均设阳性、阴性对照和替代对照。
1.3 染色结果判定排除非特异染色前提下,参考文献[2]判定VEGF、HIF-1α、CD34检测结果:染色强度,浅黄色为(+),棕黄色(2+),棕褐色为(3+),无着色为(-)。MVD的判读先在低倍(×100)视野寻找高血管密度区,然后在高倍(×400)视野内记数微血管的数目,分辨不清或染色模糊的细胞不记入结果。单个的棕黄色内皮细胞或血管内皮细胞簇作一个血管记数,血管腔并不作为判断血管的标准。计5个视野的MVD值,取其均值作为该切片的MVD值。全部切片的MVD值均在未知其他相关资料的情况下进行。
1.4 统计学分析运用SPSS11.5软件进行统计学分析。定量资料用均数±标准差(x±s)表示,2组均数比较采用两独立样本t检验。2组有序变量比较采用Mann-Whitney精确概率计算法。2组率的比较采用χ2检验。HIF-1α、VEGF和MVD的相关性用Spearman等级相关分析,以P≤0.05为有显著性统计学意义。
2 结果
2.1 HIF-1α蛋白表达情况HIF-1α主要表达在血管内皮细胞细胞核上,部分细胞质内也有表达,显棕黄色颗粒,血管内皮细胞周围部分疏松结缔组织细胞也有表达,见图1。在巨噬细胞、成纤维细胞聚集的部位,HIF-1a蛋白表达较其他部位更为明显。11例糖尿病足标本中,HIF-1a的阳性表达率为90.9%。其中强表达3例,中度表达5例,弱表达2例,不表达1例。6例对照组中,HIF-la阳性率为83.6%,其中弱表达5例,不表达1例,组间差异有统计学意义(P=0.014)。见表1。
2.2 VEGF蛋白表达情况VEGF主要表达在血管内皮细胞细胞质内(VEGF在平滑肌细胞中均出现阳性表达),见图2。11例糖尿病足标本中,VEGF的阳性表达率为90.9%。其中强表达3例,中度表达3例,弱表达4例,不表达1例。6例对照组中,VEGF的阳性率为66.7%,其中弱表达4例,不表达2例,组间差异有统计学意义(P=0.040)。见表1。
2.3 MVD计数情况CD34蛋白主要在血管内皮细胞的细胞质中表达,呈棕黄色,见图3。糖尿病足标本中MVD计数为46.55±16.38,对照组为17.83±7.25,两者差异有统计学意义(P<0.05)。
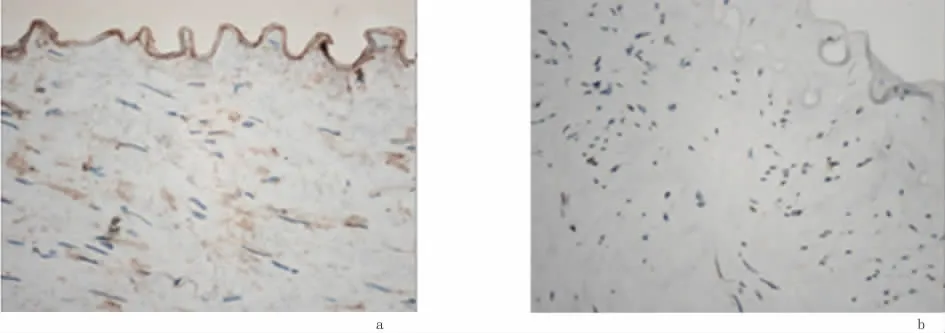
图1 HIF-1α在2组中的表达(×200)Figure 1 The expression of HIF-1α in two groups(×200)
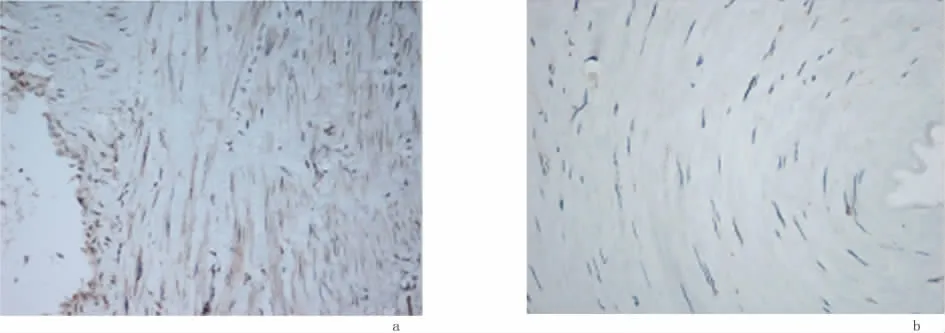
图2 VEGF在2组中的表达(×200)Figure 2 The expression of VEGF in two groups(×200)
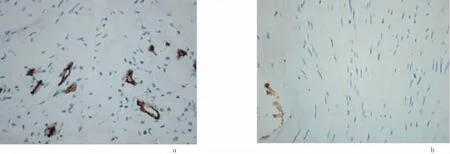
图3 CD34在2组中的表达(×200)Figure 3 The expression of CD34 in two groups(×200)

表1 2组HIF-1α及VEGF的表达Table 1 Expression of HIF-1α and VEGF in diabetic feet
2.4 HIF-1α、VEGF、MVD三者关系糖尿病足病组中HIF-1α和VEGF表达之间两者呈正相关(P<0.05),HIF-1α表达升高,VEGF表达也升高,MVD和HIF-1α、VEGF均呈正相关(P<0.05)。见表2。
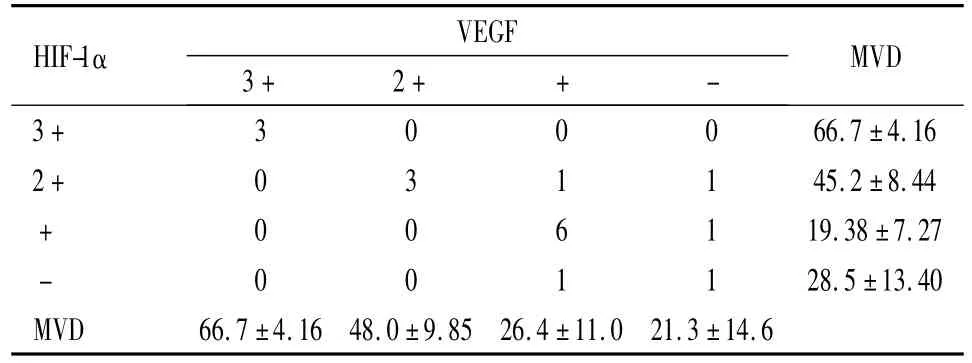
表2 糖尿病足中HIF-1α、VEGF、MVD的相互关系Table 2 Relationship among expression of HIF-1α,VEGF and MVD in diabetic feet
3 讨论
糖尿病下肢血管病变是糖尿病足的主要发病因素[3],高血糖和低氧在糖尿病下肢血管病变中发挥重要作用。高糖血症能使红细胞内2,3-二磷酸甘油酸水平降低,红细胞携氧能力减低;使糖基化血红蛋白在血红蛋白中的比例增高,对氧的亲和力高于正常血红蛋白,使氧不易扩散至组织中;使毛细血管基膜增厚以及血液成分的改变等,从而引起下肢血管慢性缺血缺氧。低氧能使机体一系列的基因表达发生变化以适应低氧的环境,如刺激多种促血管生成因子生成及整合素、基质金属蛋白酶等合成,引起细胞外基质与基底膜溶解、消退,进而细胞迁移、增殖,导致糖尿病患者血管结构和功能改变[4]。
HIF-1α是调节细胞内氧代谢的关键因子之一,也是迄今为止发现的唯一的能在特异性缺氧状态下发挥活性的转录因子,能对细胞的缺氧起稳定作用[5-6]。本研究结果显示,正常人下肢血管中HIF-1α呈弱阳性,而糖尿病足组中出现明显的表达,并有显著差异。有研究表明,随年龄增长HIF-1表达增加[7]。在本实验中,糖尿病足病组与对照组年龄差异无统计学意义,因此年龄差异对本实验结果无明显影响,同时本实验中的6例对照组患者选取的均为新鲜外伤截肢患者,可排除感染和缺氧因素,以上结果证实缺血缺氧在糖尿病足发病机制中的重要作用,也提示HIF-1α在糖尿病足的发生发展过程中可能起一定作用,HIF-1α随着病程的发展进行性表达增强,反映下肢的缺氧随着糖尿病足发展而逐渐加重,这也符合糖尿病足发展的病理生理过程。
VEGF是一种在组织缺氧后与新生血管密切相关的促血管生成因子,VEGF作为最有效的促血管生长因子之一,缺血缺氧是最强的诱导因素[8]。本研究采用免疫组织化学法检测糖尿病足下肢截肢患者的下肢足背动脉VEGF蛋白表达的变化。实验结果表明,VEGF在糖尿病足组中出现明显的表达,对照组VEGF呈微弱表达。王争等[9]研究表明糖尿病患者下肢血管VEGF表达量明显少于动脉粥样硬化性患者缺血下肢的表达量,认为糖尿病抑制了机体对缺氧的正常反应。基于这一理论,有些学者认为外源性VEGF基因治疗动脉粥样硬化、糖尿病等导致的下肢动脉狭窄或闭塞应该有效[9]。但本实验研究结果与此相反,Rivard等[10]研究也与本实验结果一致,这可能是因为糖尿病抑制了缺氧时VEGF受体的表达。本研究结果显示VEGF在糖尿病足的发生发展中亦起重要作用,涉及病变的各个阶段。同时国内外研究还发现,VEGF是一种致动脉粥样硬化作用的前炎症因子。Celletti等[11]发现在apo-E/apo-B100缺乏的鼠和高胆固醇血症的兔,给予VEGF可以促进动脉粥样硬化性斑块的形成。而且近来发现VEGF通过其促血管形成以及诱导单核细胞趋化性的作用,还参与了动脉再狭窄过程[12]。因此,VEGF基因治疗糖尿病足应采取慎重的态度。本研究中,HIF-1α的表达与VEGF具有显著正相关和一致性,已知VEGF是HIF-1的下游基因,两者相互作用的缺氧反应元件位于VEGF5′端,HIF-1与VEGF5′端结合后,不仅使VEGF mRNA稳定性增加,而且增强VEGF的转录活性[13],提示在糖尿病足中,有缺氧→HIF-1α→VEGF这一调控链的存在,调节VEGF的表达可能是HIF-1α参与糖尿病足发病的重要作用机制之一。
MVD被认为是最能反映血管生成的指标之一,利用CD34标记血管内皮细胞可以更准确地统计MVD[14]。本组病例中糖尿病足下肢血管MVD和对照组结果比较有统计学意义,与HIF-1α、VEGF表达一致,是直接反映HIF-1α、VEGF表达结果的指标。糖尿病足组的HIF-1α、VEGF蛋白表达水平和MVD都呈正相关,提示血管内皮细胞HIF-1a、VEGF蛋白表达水平和血管的增生密切相关。目前认为HIF-1α是机体缺血后一系列分子反应的启动因子之一,肢体缺血后,HIF-1α及VEGF等表达增加,可促使缺血肢体形成新生血管,产生代偿性适应,但HIF-1α和VEGF在糖尿病足发生、发展过程中有双刃剑的作用,HIF-1α-VEGF轴不仅在糖尿病足新生血管形成中起上调作用,同时VEGF的表达上调,血管通透性增加,促进脂蛋白和炎性细胞进入内膜[15],以及内膜新生血管生成,导致动脉粥样硬化的发生发展和斑块形成[16],并且新生血管的冠状动脉粥样硬化(athevosclevo sis,AS)退化与AS斑块的退化相伴出现[17]。这些结果说明新生血管形成在AS病变中发挥重要作用。
本研究结果表明,在糖尿病足组有HIF-1α及VEGF蛋白明显表达,与以往的研究相结合,糖尿病足的发生、发展是一个有序的、渐进的过程,其中下肢缺血缺氧是一个重要的病理机制。我们认为,在糖尿病足发生、发展中,存在着HIF-1/VEGF的低氧诱导信号通路,即下肢缺氧/缺血能诱导HIF-1α的表达,进而激活HIF-1的活性,启动缺氧反应基因转录,参与缺氧诱导的一系列基因的表达调控,如促进VEGF表达增强,从而介导糖尿病足的病理生理过程。HIF-1α及VEGF的表达,一方面促进细胞代谢,增强细胞对缺氧环境的适应能力,对保护细胞免受缺氧损伤具有积极作用;另一方面,诱导多种细胞因子的异常表达改变局部正常的微环境,进而改变正常的组织结构和功能,导致病变的进一步恶化[18]。因此,如何调节HIF-1α及VEGF的适度表达对糖尿病足的防治具有重要意义。
[1]Walters DP,Gatling W,Mullee MA,et al.The prevalence detection and epidemiological correlates of peripheral vascular disease:a comparison of diabetic and non diabetic subjects in an English community[J].Diabet Med,1992,9(8):710-715.
[2]邢传平,刘斌,董亮.免疫组织化学标记结果的判断方法[J].中华病理学杂志,2001,30(4):318.
[3]许樟荣.重视下肢动脉病变的诊治是降低糖尿病截肢率的重要措施[J].中华内分泌代谢杂志,2009,25(6):589-590.
[4]Pugh CW,Ratcliffe PJ.Regulation of angiogenesis by hypoxia:role ofthe HIF system[J].Nat Med,2003,9(6):677-684.
[5]Bracken CP,Whitelaw ML,Peet DJ.The hypoxia-inducible factors:key transcri-ptional regulators of hypoxic responses[J].Cell Mol Life Sci,2003,60(7):1376-1393.
[6]Sergiu-Bogdan C,Kensaku O,Teresa P,et al.Hyperglycemia regulates hypoxia-inducible factor-1αprotein stability and function Diabetes[J].2004,53(12):3226-3232.
[7]Camillo DG,Giuseppina B,Marisa C,et al.Oxygen and life span:chronic hypoxia as a model for studying HIF-1α,VEGF and NOS during aging[J].Respiratory Physiol Neurobiol,2005,147(1):31-38.
[8]Shima DT,Gougos A,Miller JW,et al.Cloning and mRNA expression of vascular endothelial growth factor in ischemic retinas of Macaca fascicularis[J].Invest Ophthalmol Vis Sci,1996,37(7):1334-1340.
[9]王争,张纪蔚,张柏根.糖尿病足动脉缺血患者骨骼肌血管内皮生长因子基因表达[J].中华外科杂志,2002,40(7):505-507.
[10]Rivard A,Silver M,Chen D,et al.Rescue of diabetes related impairment of angiogenesis by intramuscular gene therapy with adeno-VEGF[J].Am J Pathol,1999,154(2):355-363.
[11]Celletti FL,Waugh JM,Amabile PG,et al.Vascular endothelial growth factor enhances atherosclerotic plaque progression[J].Nat Med,2001,87(10):425-429.
[12]Shibata M,Suzuki H,Nakatani M,et al.The involvement of vascular endothelial growth factor and flt-1 in the process of neointimal proliferation in pig coronary arteries following stent implantation[J].Histochem Cell Bio1,2001,116(6):471-481.
[13]Kimberly AM,Diana HY,Keyianoosh ZP,et al.Sustained expression of Hif-1a in the diabetic environment promotes angiogenesis and cutaneous wound repair[J].Diabet Med,2007,15(3):636-645.
[14]Zolota V,Geroksata A,Melachrinou M,et al.Microvessel density,proliferating activity,p53 and bcl-2 expression in situductal carcinoma of the breast[J].Anticancer Res,1999,19(4B):3269-3274.
[15]李冬梅,李倩,张颖,等.白细胞介素与2型糖尿病患者的代谢综合征多重危险因素的相关性研究[J].医学研究生学报,2010,23(1):53-56.
[16]彭永平,吴宗贵,江时森,等.冠心病合并2型糖尿病高龄患者经皮冠状动脉介入治疗的临床观察[J].医学研究生学报,2009,22(10):1048-1051.
[17]Zhao Q,Egashira K,Inoue S,et al.Vascular endothelial growth factor is necessary in the development of arteriosclerosis by recruiting/activating monocytes in a ratmodel of long-term inhibition of nitric oxide synthesis[J].Circulation,2002,105(9):1110-1115.
[18]Liu LX,Guy PM,Wei XF,et al.Age-Dependent Impairment of HIF-1a Expression in Diabetic Mice:Correction With Electroporation-Facilitated Gene Therapy Increases Wound Healing,Angiogenesis,and Circulating Angiogenic Cells[J].Cellula Physiol,2008,217(4):319-327.
