冷冻贮藏引起的鱼肉蛋白质变性及物理化学特性的变化
2011-04-01郭园园孔保华
郭园园,孔保华*
(东北农业大学食品学院,黑龙江 哈尔滨 150030)
冷冻贮藏引起的鱼肉蛋白质变性及物理化学特性的变化
郭园园,孔保华*
(东北农业大学食品学院,黑龙江 哈尔滨 150030)
冷冻贮藏是鱼类重要的贮藏方法,但不适当的冻藏和缓化会引起鱼肉肌原纤维蛋白的变性,造成鱼肉质量降低。鱼肉蛋白质变性主要和蛋白质的结构变化有关,包括空间结构的变化、溶解性的变化、Ca2+-ATPase活性变化、巯基和二硫键含量变化、表面疏水性变化及海水鱼中甲醛含量的变化,而结构的变化进一步影响蛋白质的功能特性。本文主要论述鱼肉蛋白质的冷冻变性机理,并对鱼肉蛋白质在冷冻贮藏期间引起的蛋白质物理化学特性的变化进行论述。
冷冻贮藏;变性;肌原纤维蛋白;理化特性
鱼类中含有丰富的营养物质,水分活度高,非常易腐败变质。如果不能及时加工处理,在微生物和酶的综合作用下蛋白质、氨基酸等会发生分解,对品质产生极为不利的影响[1]。为了保证原料鱼肉的质量,冷藏或冻藏保存鱼类是一个非常重要的贮存方法。在低温下可以抑制微生物生长繁殖、降低酶的活性,从而有效延长水产食品的货架期。但不适当的冻藏和缓化会引起鱼肉品质量降低,主要包括肉汁液流失、嫩度下降、风味物质和蛋白质损失,最终破坏肌肉蛋白质的功能特性,降低肉的品质和加工性能。冷冻贮藏中对鱼肉质量影响最大的变化是蛋白质的变性。冷冻鱼类蛋白变性是由冷冻贮藏温度及贮藏时间、包装、冻融速率、温度波动和反复冻融等很多因素决定的[2]。鱼肉蛋白质的变性影响了鱼肉及其制品的口感、风味,降低了其营养价值和商品价值。因此鱼肉蛋白质在冷冻贮藏期间发生的冷冻变性一直是水产品研究的重点。本文主要论述鱼肉蛋白质的冷冻变性机理,并对鱼肉蛋白质在冷冻贮藏期间引起蛋白质物理化学特性的变化进行论述。
1 鱼肉蛋白在冷冻贮藏期间的变性及变性机理
所谓鱼肉蛋白质的冷冻变性,是指鱼在冻藏条件下,即-12~-23℃条件下贮藏,蛋白质受物理或化学因素的影响,其分子内部原有的高度规律性的空间结构发生变化,致使蛋白质的理化性质和生物学性质都有所改变,但并不导致蛋白质一级结构的破坏,这种现象称为蛋白质的变性[3]。
关于蛋白质冷冻变性机理有很多说法,但目前较有说服力的有3种:一是结合水的分离学说,即蛋白质中的部分结合水被冻结,破坏其胶体体系,使蛋白质大分子在冰晶的挤压作用下互相靠拢并聚集起来而变性,也可称为蛋白质分子的聚集变性(aggregation)。蛋白质冷冻凝聚变性模型[4]见图1。
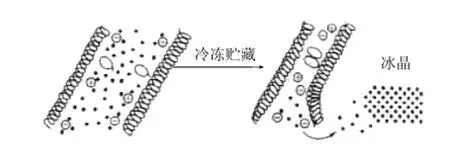
图1 蛋白质冷冻凝聚变性模型Fig.1 Model of protein denaturation of freezing aggregation
具有α-螺旋结构的蛋白质在冻藏过程中易发生聚集变性。该模型指出,当蛋白质冷却到冰点以下时,温度较低部分的水分子开始结晶,而其他部分的未冻结水分子则向冰晶处迁移,引起冰晶生长,最终蛋白质表面功能基团所结合的水分也会被移去,使这些功能基团游离出来而相互作用,从而使蛋白质分子间发生聚集。鱼肉肌原纤维蛋白中的肌球蛋白、肌动球蛋白中的肌球蛋白部分都具有α-螺旋结构,在冻藏中易发生聚集变性。研究发现,参与这些蛋白质聚集的键为氢键、离子键、疏水键和二硫键[5]。蛋白质聚集使其相应的物理化学性质发生改变。
另一学说是细胞液的浓缩学说,即在冷冻条件下,蛋白质自由水与结合水先后结冰,使蛋白质的立体结构发生变化而造成,同时,还由于细胞内外生成的冰结晶破坏,并引起肌肉中的水溶液浓度升高、离子强度和pH值发生变化,最终导致蛋白质变性,这种变性几乎是不可逆的冻结,使蛋白质因盐析作用而变性。这种观点往往被用来说明细胞内外冰的生成量及生成状态同蛋白质变性之间的密切关系。
未冻结时,蛋白质分子以高度水化的折叠状蛋白质存在,这时,蛋白质多肽链上的非极性基团位于分子内部而避免了与水分接触,具有较高的熵,较稳定,同时,蛋白质分子内部的非极性基团相互作用形成的非极性键可使其更稳定。肉在冷冻过程中,随着结合水的冻结,冰晶形成会使蛋白质的水化程度大大降低从而使其链展开,形成水化程度很低的开链蛋白质。其未折叠部分暴露出非极性氨基酸,结果导致临近蛋白质间的疏水相互作用、氢键、二硫键、离子键等形成,最终导致蛋白质分子间构象重排、分子内发生聚集,也称作蛋白质多肽链的展开(unfolding)变性。蛋白质冷冻开链变性模型[4]如图2所示。
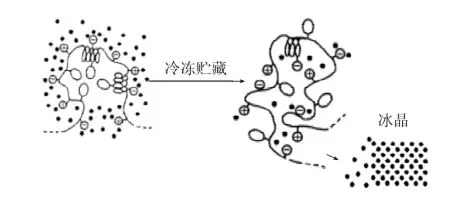
图2 蛋白质开链变性模型Fig.2 Model of protein denaturation of unfolding
后来又有学者提出蛋白变性的一个假设,即水和水合水的相互作用。蛋白质分子中复杂的三级、四级结构是由分子内的非极性键之间的疏水结合和分子间的氢键来维持的。这些键的分布状态和蛋白质周围的水分子所形成的构造、状态密切相关。冻结时由于冰晶的生成引起结合水和蛋白质结合状态的改变,使蛋白质分子内部有些键被破坏,有些键又重新生成,这涉及到蛋白质分子内部构造的变化,从而使蛋白质变性[6]。此外,肌肉组织结构因细胞内外生成的冰结晶而产生破坏,肌肉组织蛋白酶对蛋白质的水解作用,冻藏中氧化三甲胺还原产生的二甲胺和甲醛,脂质氧化生成的醛酮类物质,ATP分解产生的次黄嘌呤类物质,ATP降解和糖原酵解造成的pH值下降等因素均会导致蛋白质发生变性。
鱼肉蛋白质由水溶性的肌浆蛋白、盐溶性的肌原纤维蛋白和不溶性的基质蛋白组成[7]。研究发现鱼肉蛋白变性主要是由肌原纤维蛋白变性引起的,其他两种蛋白变化很小。而肌原纤维蛋白质的变性又与蛋白质的物理和化学特性的变化密切相关。
2 肌原纤维蛋白在冻藏过程中物理化学性质的变化
冷冻贮藏期间鱼肉蛋白质物理化学性质的变化,以及由此引起的蛋白质变性,主要表现在肌原纤维蛋白质空间结构的变化、溶解性的变化、Ca2+-ATPase活性变化、肌原纤维蛋白的巯基和二硫键含量变化、肌原纤维蛋白表面疏水性变化及海产品中甲醛含量的变化等。
2.1 肌原纤维蛋白空间结构的变化
肌原纤维在电镜下呈长的圆筒状结构,其直径为1~2μm。其横切面由粗丝和细丝交错穿插进行有序排列,以一条粗丝为中心,六条细丝呈六角形包绕在周围。纵切面有明暗相见的横纹,分为暗带(A带)和明带(I带),I带中央有一条Z线。粗丝主要由肌球蛋白组成,细丝主要由肌动蛋白组成。肌原纤维蛋白质(myofibrillar protein)是构成肌原纤维的蛋白质,占肌肉中总蛋白的50%~70%,在离子强度0.5以上的中性盐溶液中,可以大致被完全抽提出来[8]。主要包括肌球蛋白(myosin)和肌动蛋白(actin)。其中肌球蛋白的形状很像“豆芽”,由两条很长的肽链相互盘旋构成,这两条肽链称为重链,形成头部,头部(S1)具有ATP酶的活性;尾部有数条轻链。肌动蛋白单独存在时为一球形的结构,与肌球蛋白结合形成肌动球蛋白。
鱼肉在冻藏过程中,由于冰晶的形成及增大而使肌原纤维蛋白脱水变性,电镜结果显示肌原纤维的空间结构发生变化,出现明显的裂缝和空隙,粗细丝排列紊乱、松散,肌节、A带、I带以及横纹模糊甚至消失,Z线扭曲、断裂、严重时溶解消失,肌组织中出现大小不等的空泡;同时电泳图谱会出现色带变淡、消失或有新的条带生成,这都表明了肌原纤维蛋白变性,发生不同程度的降解。
Roura等[9]对冰藏的产卵后的鳕鱼肌原纤维蛋白进行电泳分析和扫描电镜观察,在电泳图谱上发现大分子质量条带变淡,并有新的小分子质量条带出现,表明在冻藏过程中出现了交联反应而沉积或出现新的蛋白质肽链。电镜结果显示肌肉纤维出现明显的裂缝和空隙,表明在冻藏过程中由于冰晶增大而使肌原纤维蛋白质脱水变性。Matthews等[10]对冻藏的鳍鱼和汪秋宽等[11]对冻藏210d鲤鱼的肌原纤维蛋白的研究得到了相似的结果。但是Busconi等[12]对新鲜和冷冻贮存7d的白石首鱼肌原纤维蛋白电泳图进行对比,发现伴肌动蛋白显著降解,然而肌原纤维的大部分蛋白没有变化。作者总结认为在死后贮存期间很多蛋白是不受影响的,肌肉变软不是因为肌原纤维的分解,可能是因为次要的细胞成分发生了蛋白水解,这些次要的细胞成分使主要结构单位紧密结合。
鳕鱼冷藏9d后,其粗丝联接蛋白不断降解,并且变化显著。这表明冷冻贮藏期间肌肉蛋白的降解依赖于物种和组织,即不同的物种和组织间的差异由体内蛋白酶种类和数量的不同造成的[13]。随着冻融次数的增加,虾肉肌纤维间的空隙增大,肌纤维弯曲甚至断裂[14]。
2.2 肌原纤维蛋白溶解性的变化
蛋白质溶解性是指在一定条件下,肌肉中可以进入溶液的蛋白量与总的肌肉蛋白量的比值,且这部分溶解的蛋白质在一定的离心力作用下不应发生沉淀。肌肉蛋白质的溶解性在肉制品加工中起重要的作用,特别肉糜类制品和重组肉的加工方面。因为肌肉蛋白质的大多数功能性质是与蛋白质的溶解性密切相关的,而蛋白质的功能性如凝胶特性、乳化特性、起泡性、流变学特性只有在蛋白质处于高度溶解状态时才能表现出来的[15]。
研究表明,冷冻贮藏期间肌原纤维蛋白的溶解性降低。且当冻藏温度高于冰结晶点时,冻藏温度越低,蛋白质变性越快,溶解性下降得越快;当冻藏温度低于冰结晶点,冻藏温度越低,蛋白质变性越慢,溶解性下降得也越慢;冻藏时间越长肌肉蛋白的溶解性越差。冻藏过程中由于氢键、疏水键、二硫键、盐键的形成往往会导致蛋白质溶解性的下降,且其下降程度与鱼种有关[16]。大西洋鳕鱼鱼糜在-20℃冻藏14d和42d后,盐溶性蛋白含量分别下降了23%和47.5%[17]。Sultanbawa等[18]研究表明,蓝鳕鱼糜蛋白在-18℃冻藏120d,其盐溶性蛋白含量从60%下降到19%。研究发现随着冷冻-解冻循环次数的增加,鳕鱼蛋白盐溶性含量显著降低,当经过5次循环后,盐溶性含量大约减少60%[19]。罗永康[20]对鲢鱼肉在-20℃和-10℃冻藏期间盐溶性蛋白含量的变化进行了研究,发现前6周分别下降到新鲜鲢鱼肉的49.7%和39.8%,分别下降了50.3%和60.2%。从第7周到第24周,盐溶性蛋白含量下降越来越慢,分别从49.7%和39.8%下降到30.1%和26%,表明贮藏温度越低,盐溶性蛋白下降越慢,蛋白变性程度越小。
蛋白溶解性的降低伴随着疏水性的增加、二硫键的形成。因为有序的三级结构的破坏导致蛋白间的交联,从而引起了蛋白溶解性的降低[21]。肌原纤维蛋白溶解性的逐渐降低是由蛋白的聚集引起的,二硫和非二硫共价键也许和肌球蛋白重链的交联相关,而交联导致了高分子质量多聚物的形成[22]。从热力学上讲,蛋白溶解性的降低是蛋白分子间作用和蛋白与水间相互作用的平衡发生变化的结果,这导致了蛋白分子间的作用增强和蛋白与水分子间的作用减弱[23]。自由基的攻击也是蛋白溶解性降低的原因之一[24]。
2.3 肌原纤维蛋白Ca2+-ATPase活性的变化
肌球蛋白的球状头部(S1)具有ATP酶活性,Ca2+可以激活其活性。所以Ca2+-ATPase活性是反映肌球蛋白完整性的一个重要指标[25]。研究表明,冷冻贮藏期间肌原纤维蛋白Ca2+-ATPase活性发生不同程度的下降,这表明冻藏破坏了肌球蛋白的完整性,发生变性,从而降低了肌原纤维蛋白的功能特性。不同鱼种在新鲜状态时Ca2+-ATPase活性不同是因为肌肉蛋白对处理的敏感性存在差异,也可能是因为肌肉蛋白天然结构的不同,Ca2+-ATPase活性的降低可能是由于肌球蛋白头部的结构发生了改变或聚集所致,且降低的程度取决于鱼的品种[26]。Benjakul等[26]报道石首鱼、狗母鱼、鲅鱼和大眼棘鬣鱼4种热带鱼在-18℃冷冻贮存7d后,前三者肌肉蛋白的Ca2+-ATPase分别下降35.7%、46.6%和20.9%,而大眼棘鬣鱼没有什么显著变化;冷冻贮存168d后分别下降72.1%、51.7%、53.4%和42.8%。沙丁鱼在-5、-20℃分别冻藏7、40d后其Ca2+-ATPase活性分别下降一半[27]。周爱梅等[28]研究发现鳙鱼和罗非鱼鱼糜在-20℃冻藏63d后Ca2+-ATPase 活性分别降低了100%和43.5%。鲤鱼在-20℃冷冻贮藏60d肌原纤维蛋白Ca2+-ATPase活性降低[29]。
冻藏过程中冰结晶的形成、离子强度的增加,诱导肌球蛋白的变性、使肌动球蛋白的复合物破裂,致使ATPase活性降低。随着冷冻贮藏时间的延长,Ca2+-ATPase活性下降越显著,这表明肌球蛋白更易变性,特别是头部的变性[25]。在冻藏过程中冰晶的形成及由此所带来的体系离子强度的增加都会导致肌球蛋白头部结构发生改变,从而使其Ca2+-ATPase活性下降[25]。Ca2+-ATPase活性降低可能和肌球蛋白球状头部巯基的氧化相关[16]。蛋白质和蛋白质间相互作用引起的蛋白质分子重排及肌球蛋白活性部位的巯基发生氧化也可能导致肌球蛋白Ca2+-ATPase活性下降[19]。Ramirez等[5]报道Ca2+-ATPase活性的丧失是由肌球蛋白头部的活性位点变化引起的而不是由蛋白聚集引起的。
2.4 肌原纤维蛋白巯基和二硫键含量的变化
巯基对于稳定肌原纤维蛋白质的空间结构有着重要的意义,因此许多学者都认为巯基氧化形成二硫键是引起蛋白质分子间交叉、联结、聚合,进而导致肌原纤维蛋白空间结构发生变化的主要原因。研究表明,在冷冻贮藏过程中,肌原纤维蛋白的活性巯基易氧化成二硫键,因此经冷冻后其活性巯基或总巯基的含量减少,而二硫键的含量增加。巯基含量的减少可能是多肽内部或多肽间形成二硫键;也可能是由于蛋白质发生了聚集反应的结果。罗非鱼在-20℃冷藏15d后总巯基含量不断降低,且降低了初始值的33%,且巯基含量的降低伴随着二硫键的形成[5]。红狗鳕鱼在-20℃冻藏28d后巯基含量降至82%,102d后降到68%[30]。太平洋白鳕鱼在冻藏2d过程中肌动球蛋白总巯基含量轻微上升,然后逐渐下降[26]。Benjakul等[26]研究发现石首鱼、狗母鱼、鲅鱼和大眼棘鬣鱼在-18℃冷冻贮藏14d后总巯基含量分别下降了22.2%、17.4%、29.4%和26.4%,168d后总巯基含量分别下降了29.6%、67.3%、43.2%和47.8%,二硫键含量分别升高了129.5%、325.4%、32.9%和41.7%。鳙鱼和罗非鱼鱼糜在-20℃冻藏63d后,二硫键含量分别增加了27.7%和222.1%[28]。冷冻-解冻鳕鱼发现,随着冻融次数的增多,蛋白变性更严重,加速了二硫键的形成和巯基含量的降低[19]。
肌球蛋白有42~43个巯基,其中SH1和SH2两种巯基位于肌球蛋白头部区域,它们与其ATPase活性有关。SHa集中在轻质酶解肌球蛋白上,它负责Mg2+-ATPase活性,与肌球蛋白重链(MHC)的氧化及二聚物的形成密切相关,促进巯基的氧化[31]。总巯基含量的降低是由SHa的氧化引起的[25]。Buttkus[31]报道鳕鱼巯基氧化程度比虹鳟鱼严重,认为巯基氧化和ATPase活性降低程度不同,这取决于鱼的品种。冻藏中巯基含量变化不同是因为不同鱼种的肌原纤维蛋白巯基氧化的难易程度不同[26]。巯基的下降伴随着Ca2+-ATPase活性的降低,这可能是因为肌球蛋白构象发生改变,特别是头部区域的变化。这些变化导致了活性巯基的暴露,使其更易发生氧化或二硫键交换,从而巯基含量下降,二硫键含量升高。海水鱼中形成的高浓度甲醛诱导了蛋白聚集,这促进了巯基的氧化。此外,蛋白质聚合体的形成会覆盖一些巯基,使能够检测到的游离巯基减少,从而也可能导致巯基含量下降。
2.5 肌原纤维蛋白表面疏水性的变化
蛋白质的表面疏水性反映的是蛋白质分子表面疏水性氨基酸的相对含量,也可以用它来衡量蛋白质的变性程度,对某种蛋白质来说,如果表面疏水性的增加则说明它的变性程度增加。研究发现,鱼肉经冷冻贮藏后,肌原纤维蛋白的表面疏水性增加。这表明冻藏引起蛋白变性,肌原纤维蛋白质分子伸展开,把非极性的氨基酸残基暴露在蛋白质分子的表面,破坏了蛋白质原来的排列方式,引起肽链的卷曲或螺旋结构的变化,形成不同于天然结构的状态[32]。Benjakul等[25]研究发现太平洋鳕鱼冰藏2d后,其肌动球蛋白的表面疏水性增加了56%,而后基本保持不变。Roura等[9]对冻藏鳕鱼的肌动球蛋白进行研究得到了相似的结果。Benjakul等[26]报道鲅鱼和大眼棘鬣鱼在-18℃冻藏168d后肌动球蛋白的表面疏水性分别增加了129.8%和164.7%。
冷藏期间蛋白疏水性的增加可能是因为蛋白质的去折叠及疏水性脂肪族和芳香族氨基酸的暴露[33]。冷冻的白鱼肉肌球蛋白分子的疏水性氨基酸比红鱼肉更易暴露[34]。Multilangi等[35]推测表面疏水性的增加表明蛋白质发生变性或降解引起了内部分子的暴露,从而导致保水能力的降低和较弱的胶凝作用。Roura等[9]报道狗鳕冰藏3d后其肌动球蛋白的表面疏水性升高,发现实验中用的荧光剂8-苯氨基-萘酚-磺酸(ANS)和疏水性氨基酸结合,包括芳香族氨基酸、苯丙氨酸和色氨酸,这是由蛋白质的结构变化引起的。氨基酸间的疏水相互作用和巯基的氧化影响表面疏水性[36]。冻藏过程引起蛋白质氧化,可能导致蛋白质二级结构和三级结构的改变,导致溶液中极性和非极性基团数量的改变,因此可能增加蛋白质的表面疏水性[37]。Benjakul等[26]推测冻藏狗母鱼的表面疏水性的急剧增加是由甲醛的形成引起的。
2.6 甲醛含量的变化
20世纪70年代,人们发现那些抗冻能力很差的鱼类在冻藏时产生大量的甲醛(FA)和二甲胺(DMA),这是因为体内的氧化三甲胺经氧化三甲胺脱甲基酶作用而被降解成等量的FA和DMA[38]。后来发现只有海洋动物体内含有这种酶,因此甲醛含量的变化只存在于海水鱼中。甲醛含量的变化引起肌原纤维蛋白的变化,包括溶解性、凝胶强度、ATPase活性、表面疏水性等。Ang等[39]报道贮存在-25℃和-80℃的鳕鱼肌球蛋白中甲醛含量增加,发生甲醛的聚集,甲醛可能诱导了肌球蛋白构象的变化,特别是球状头部区域,这导致了Ca2+-ATPase活性的降低和表面疏水性的变化。Careche等[40]用RAMAN色谱仪研究了冷冻和贮藏过程中鳕鱼肌肉蛋白的变化,肌球蛋白二级结构的变化从空白的95%的α-折叠到加入12mmol/L甲醛的60%的α-折叠,振动模式的变化指向脂肪端,暗示了甲醛加入后或冷冻贮藏过程中化学键发生了变化,存在疏水相互作用。色谱分析得出有部分蛋白解折叠并增加了脂肪疏水残基的外露。因此导致出现蛋白之间的共价连接,从而出现了SDS和ME处理都不溶的状态。甲醛诱导产生了疏水氨基酸侧链的甲基基团间的大范围的共价键,促进了蛋白的聚集[26]。瘦肉型鱼类在冷藏期间甲醛生成和它对肌肉蛋白的影响是作为影响质地和功能性变质的主要因素[41]。Sikorski等[42]报道说甲醛与蛋白反应,从而导致构象发生改变,蛋白质的溶解性下降。
在研究中也有不同的意见,Badii等[33]观察了鳕鱼(产生丰富的甲醛)和黑线鳕(几乎不产生甲醛)在冷冻条件下品质的变化,结果表明蛋白的聚集与甲醛的产生量没有明显的关系,甲醛并不是引起冷冻变性的主要原因,变性的主要原因仍是脂质的氧化产物与蛋白质的相互作用。
3 影响鱼肉品质变化的因素
冷冻贮藏期间,引起鱼肉质量发生变化的因素包括:原料固有的品质、贮藏前后的处理和包装、贮藏温度、贮藏时间、冷冻速度、温度波动、反复冻融以及解冻方式等。其中冷冻速度和贮藏温度是影响鱼肉品质变化的关键因素。冷冻速度影响冰晶的大小、形成、数量和分布等。缓慢冷冻时,冰晶体大多在细胞的间隙内形成,冰晶量少而且粗大,多呈柱状或块状;冷冻速度越快,冰晶越细小,而且主要分布在细胞内,因此,水产品在冷冻时必须以最快的速度通过0~-5℃温度区,并且迅速达到冷冻所需的温度,这样才能使冰晶细而均匀,解冻后的鱼肉肌肉组织可塑性大、鲜度好,蛋白变性程度低,鱼肉不会发生很大程度的劣变。鱼肉贮藏温度越低,鱼体内各种导致腐败变质的物理化学、组织形态变化以及生化反应的速度也就越缓慢。这就要求贮藏温度的低温化,但是即使在最佳的冻藏条件下,鱼肉的质量也会不可避免地出现下降,并随着时间的累积而增加。Baron等[43]对虹鳟鱼在冷冻贮藏期间(-20、-30℃和-80℃)发生的氧化进行了研究,发现温度越低,脂肪和蛋白氧化程度越显著。曾名湧等[44]发现随着贮藏温度的降低,鲈鱼的盐溶性蛋白含量、ATPase活性和巯基含量不断增加。冻结速度对鲢鱼蛋白变性影响的研究中,鲢背肌在-18℃的慢速冷冻中其肌原纤维Ca2+-ATPase的失活率和盐溶性蛋白溶解度下降的幅度分别比-40℃条件下快速冷冻增加了8.5%和5.1%[45]。因此,为了减少鱼肉在冷冻贮藏期间质量的变化,冷冻速度和贮藏温度应受到较大的重视,严格加以控制,使温度更低且稳定,尽快通过最大冰晶生成带(0~-5℃温度区),才能使冷冻鱼肉具有更优良的品质。
4 结 语
鱼肉肌原纤维蛋白在冷冻贮藏过程中,空间结构发生变化,其溶解性、ATPase活性和巯基含量下降,二硫键含量、甲醛含量和疏水性升高。随着对鱼肉蛋白质结构、功能及在肌肉中作用的进一步研究,利用现代分析手段和处理方法,以便进一步了解蛋白质冷冻变性机理。弄清鱼肉蛋白质冷冻变性的分子作用机制等,对促进水产品加工业的持续发展具有重要的现实意义。
[1] 宋广磊, 戴志远. 鱼肉蛋白质冷冻变性研究进展[J]. 食品科技, 2006 (3): 17-20.
[2] BENJAKUL S, SUTTHIPAN N. Muscle changes in hard and soft shell crabs during frozen storage[J]. LWT-Food Science and Technology, 2009, 42(3): 723-729.
[3] 方竞. 鱼肉蛋白冷冻变性机理、测定方法及防止措施[J]. 福建水产, 2001(3): 67-71.
[4] 鸿巢章二, 桥本周久. 水产利用化学[M]. 郭晓风, 邹胜祥, 译. 北京:中国农业出版社, 1999: 69.
[5] RAMIREZ J A, MARTIN-POLO M O, BANDMAN E. Fish myosin aggregation as affected by freezing and initial physical state[J]. Journal of Food Science, 2000, 65(4): 556-560.
[6] 曾名湧. 几种主要淡水经济鱼类肌肉蛋白质冻结变性机理的研究[D].青岛: 中国海洋大学, 2005: 28-30.
[7] 周爱梅, 曾庆孝, 刘欣, 等. 冷冻鱼糜蛋白在冻藏中的物理化学变化及其影响因素[J]. 食品科学, 2003, 24(3): 153-157.
[8] 孔保华, 马丽珍. 肉品科学与技术[M]. 北京: 中国轻工业出版社, 2003: 71-72.
[9] ROURA S I, SAAVEDRA J P, TRUEO R E. Conformational change in actomyosin from post-spawned hake stored on ice[J]. Journal of Food Science, 1992, 57(5): 1109-1111.
[10] MATTHEWS A D, PARK G R, ANDERSON E M. Evidence for the formation of covalent cross linked myosin in frozen stored cod minces [M]//CONNELL J J. Advances in fish science and technology. Surrey, UK: Fishing News Books Ltd, 1980: 438-444.
[11] 汪秋宽, 李振民, 刘俊荣. 鲤在-20℃冻藏过程中的质构变化[J]. 水产学报, 1997, 21(2): 185-188.
[12] BUSCONI L, FOLCO E J, MARTONE C B, et al. Postmortem changes in cytoskeletal elements of fish muscle[J]. Journal of Food Biochemistry, 1989, 13(6): 443-451.
[13] HERNANDEZ-HERRERO M M, DUFLOS G, MALLE P, et al. Collagenase activity and protein hydrolysis as related to spoilage of iced cod (Gadus morhua)[J]. Food Research International, 2003, 36(2): 141-147.
[14] BOONSUMREJ S, CHAIWANICHSIRI S, TANTRATIAN S, et al.Effects of freezing and thawing on the quality changes of tiger shrimp (Penaeus monodon) frozen by air-blast and cryogenic freezing[J]. Journal of Food Engineering, 2007, 80(1): 292-299.
[15] 孔保华. 畜产品加工储藏新技术[M]. 北京: 科学出版社, 2006: 14.
[16] JIANG S T, HWANG D C, CHEN C S. Effect of storage temperature on the formation of disulfides and denaturation of milk fish actomyosin[J]. Journal of Food Science, 1988, 53(5): 1333-1335.
[17] SYCH J, CARRIER M. Determination of optimal level of lactitol for surimi[J]. Journal of Food Science, 1991, 56(2): 285-290; 295.
[18] SULTANBAWA Y, LI-CHAN E C Y. Croprotective effects of sugar and polyol blends in ling cod surimi during frozen storage[J]. Food Research International, 1998, 31(2): 87-98.
[19] BENJAKUL S, BAUER F. Physicochemical and enzymatic changes of cod muscle proteins subjected to different freeze-thaw cycles[J]. Journal of the Science of Food and Agriculture, 2000, 80(8): 1143-1150.
[20] 罗永康. 鲢鱼肉冻藏期间理化特性的变化[J]. 肉类研究, 1996, 10(4): 16-19.
[21] SRIKET P, BENJAKUL S, WONNOP V, et al. Comparative studies on the effect of the freeze-thawing process on the physicochemical properties and microstructures of black tiger shrimp (Penaeus monodon) and white shrimp (Penaeus vannamei) muscle[J]. Food Chemistry, 2007, 104(1): 113-121.
[22] MATSUMOTO J J, NOGUCHI S F. Crystallization of protein in surimi [M]//LANIER T C, LEE C M. Surimi technology. New York: Marcel Dekker Inc., 1992: 357-388.
[23] VOJDANI F. Solubility[M]//HALL G M. Method of testing protein functionality. London: Chapman & Hall, 1996: 11-60.
[24] DECKER E A, XIONG Youling, CALVERT J T, et al. Chemical physical and functional properties of oxidized turkey white muscle myofibrillar proteins[J]. Journal of Agricultural and Food Chemistry, 1993, 41(2): 186-189.
[25] BENJAKUL S, SEYMOUR T A, MORRISSEYM T. Physicochemical changes in pacific whiting muscle proteins during iced storage[J]. Journal of Food Science, 1997, 62(4): 729-733.
[26] BENJAKUL S, VISESSANGUAN W, THONGKAEW C, et al. Comparative study on physicochemical changes of muscle proteins from some tropical fish during frozen storage[J]. Food Research International, 2003, 36(8): 787 -795.
[27] MIKI H, NISHIMOTO J, YAMANAKA T. Relation between protein denaturation and 1ipid oxidation in fish muscle during storage at low temperatures[J]. Nippon Suisan Gakkaishi, 1994, 60(5): 631-634.
[28] 周爱梅, 龚杰, 邢彩云, 等. 罗非鱼与鳙鱼鱼糜蛋白在冻藏中的生化及凝胶特性变化[J]. 华南农业大学学报, 2005, 26(3): 103-107.
[29] AZUMA Y, KONNO K. Freeze denaturation of carp myofibrils compared with thermal denaturation[J]. Fisheries Science, 1998, 64(2): 287-290.
[30] LIAN P Z, LEE C M, HUFNAGEL L. Physicochemical properties of frozen red hake (Urophycis chuss) mince as affected by cryoprotective ingredients[J]. Journal of Food Science, 2000, 65(7): 1117-1123.
[31] BUTTKUS H. Accelerated denaturation of myosin in frozen solution[J]. Journal of Food Science, 1970, 35(2): 558-562.
[32] RIEBROY S, BENJAKUL S, VISESSANGUAN W, et al. Acid-induced gelation of natural actomyosin from Atlantic cod (Gadus morhua) and burbot (Lota lota)[J]. Food Hydrocolloids, 2009, 23(1): 26-39.
[33] BADII F, HOWELL N K. A comparison of biochemical changes in cod (Gadus morhua) and haddock (Melanogrammus aeglefinus) fillets during frozen storage[J]. Journal of the Science of Food and Agriculture, 2001, 82(1): 87-97.
[34] NIWA E, KOHDA S, KANOH S, et al. Exposure of hydrophobic amino acid residues from myosin on freezing[J]. Bulletin of the Japanese Society of Scientific Fisheries, 1986, 52(6): 2127-2130.
[35] MULTILANGI W A M, PANYAM D, KILARA A. Functional properties of hydrolysates from proteolysis of heat-denatured whey protein isolate[J]. Journal of Food Science, 1996, 61(2): 270-274.
[36] HILL A R, IRVINE D M, BULLOCK D H. Precipitation and recovery of whey proteins: a review[J]. Can Inst Food Sci Technol J, 1982, 15: 155-160.
[37] MORZEL M, GATELLIER P, SAYD T, et al. Chemical oxidation decreases proteolytic susceptibility of skeletal muscle myofibrillar proteins [J]. Meat Science, 2006, 73(3): 536-543.
[38] BENJAKUL S, VISESSANGUAN W, TANAKA M. Partial purification and characterization of trimethylamine-N-oxide demethylase from lizardfish kidney[J]. Comparative Biochemistry and Physiology: Part B, 2003, 135(2): 359-371.
[39] ANG J F, HULTIN H O. Denaturation of cod myosin during freezing after modification with formaldehyde[J]. Journal of Food Science, 1989, 54(4): 814-818.
[40] CARECHE M, LI-CHAN E C Y. Structural changes in cod myosin after modification with formaldehyde or frozen storage[J]. J Food Sci, 1997, 62(4): 717-723.
[41] TEJADA M, MOHAMED G F, HUIDOBRO A. Addition of sardine to hake minces and subsequent effect on dimethylamine and formaldehyde formation[J]. Journal of the Science of Food and Agriculture, 2002, 82 (4): 351-359.
[42] SIKORSKI Z E, KOLAKOWSKA A, PAN B S. The nutritive composition of the major groups of marine food organisms[M]//SIKORSKI Z E. Seafood: Resources, nutritional composition and preservation. Boca Raton, FL: CRC Press Inc, 1990: 29-54.
[43] BARON C P, KJRSGARD I V H, JESSEN F, et al. Protein and lipid oxidation during frozen storage of rainbow trout (Oncorhynchus mykiss) [J]. Journal of Agricultural and Food Chemistry, 2007, 55(20): 8118-8125.
[44] 曾名湧, 黄海, 李八方. 不同冻藏温度对鲈鱼肌肉蛋白质生化特性的影响[J]. 青岛海洋大学学报: 自然科学版, 2003, 33(4): 525-530.
[45] 汪之和, 王慥, 苏得福. 冻结速率和冻藏温度对鲢鱼肉蛋白质冷冻变性的影响[J]. 水产学报, 2001, 26(6): 564-569.
Advances in the Research of Denaturation and Change in Physico-chemical Properties of Fish Proteins during Frozen Storage
GUO Yuan-yuan,KONG Bao-hua*
(College of Food Science, Northeast Agricultural University, Harbin 150030, China)
Frozen storage is an important preservation method for fish; however, quality deterioration and denaturation of myofibrillar proteins can be taken place due to inappropriate frozen storage and thawing. Protein denaturation is highly associated with the changes of protein structure such as stereostructure, salt solubility, Ca2+-ATPase activity, sulfhydryl group and disulfide bond content, surface hydrophobicity and formaldehyde content in marine fish, thus further resulting in the change of functional properties. In this paper, the mechanisms of denaturation and the changes in physicochemical properties of fish proteins during frozen storage have been extensively discussed.
frozen storage;denaturation;myofibrillar protein;physico-chemical property
TS254.1
A
1002-6630(2011)07-0335-06
2010-08-24
东北农业大学创新团队项目(CXZ011)
郭园园(1984—),女,硕士研究生,研究方向为畜产品加工。E-mail:guoyuanyuan1984@hotmail.com
*通信作者:孔保华(1963—),女,教授,博士,研究方向为畜产品加工。E-mail:kongbh@163.com
