泌尿系统组织工程支架材料胶原蛋白-壳聚糖及聚乙烯醇-丝胶的生物相容性评价
2011-03-27何竑超李伟窦红静王晓晶刘伟孙康沈周俊
何竑超 李伟 窦红静 王晓晶 刘伟 孙康 沈周俊
泌尿系统组织工程支架材料胶原蛋白-壳聚糖及聚乙烯醇-丝胶的生物相容性评价
何竑超 李伟 窦红静 王晓晶 刘伟 孙康 沈周俊
目的评价复合材料胶原蛋白-壳聚糖、聚乙烯醇-丝胶作为泌尿系统组织工程支架的生物相容性和生物安全性。方法采用溶血实验评价胶原蛋白-壳聚糖、聚乙烯醇-丝胶两种复合材料对红细胞功能和代谢的影响;采用皮肤致敏实验评价两种材料是否满足体内植入的要求;采用四甲基偶氮唑盐微量酶反应比色法评价胶原蛋白-壳聚糖、聚乙烯醇-丝胶两种复合材料对泌尿上皮细胞和膀胱平滑肌细胞的生长和增殖的影响。结果胶原蛋白-壳聚糖和聚乙烯醇-丝胶的溶血率分别为1.86%和2.08%(均<5%),两种材料不引起溶血反应。与阴性对照组相比,两种材料皮肤致敏实验的结果均为阴性,没有致敏作用。细胞毒性实验(四甲基偶氮唑盐微量酶反应比色法)显示两种材料细胞毒性均为0级。结论复合生物材料胶原蛋白-壳聚糖、聚乙烯醇丝胶具有良好的生物相容性,有望作为组织工程支架材料,应用于泌尿系统的修复重建。
胶原蛋白-壳聚糖聚乙烯醇-丝胶生物相容性组织工程
目前,对泌尿系统肌性管腔的修复主要采用自体器官替代的方法,但这种方法破坏了自身其他器官的完整性和连续性,而产生一系列不可避免的并发症[1-2]。因此,组织工程技术成为未来泌尿系统修复重建的重要手段和发展方向。组织工程学是应用细胞生物学、材料科学和医学生物工程学的基本原理,将体外培养扩增后具有生物学活性及特定功能的细胞与支架材料复合,以修复及重建组织缺损,继而恢复组织或器官的部分或全部功能[3]。支架材料是组织工程研究的核心内容之一。本实验按照有关生物安全性检验标准,对天然复合材料胶原蛋白-壳聚糖和人工合成高分子复合材料聚乙烯醇(Polyvinyl alcohol,PVA)-丝胶进行相关检测,以探讨其作为泌尿系统组织工程支架的生物相容性和生物安全性。
1 材料和方法
1.1 实验动物
健康雄性新西兰大白兔12只(上海交通大学医学院动物中心提供),2.0~2.4 Kg。其中,3只用于尿路上皮细胞及膀胱平滑肌细胞的培养和扩增,另9只分为3组,用于皮肤致敏实验。
1.2 实验材料
胶原蛋白-壳聚糖、PVA-丝胶由上海交通大学材料学院研制提供。
1.3 尿路上皮细胞、膀胱平滑肌细胞的培养和扩增
参照文献[4]的方法进行。
1.4 材料浸提液制备
浸提介质为0.9%生理盐水(按浸提介质∶样品表面积=1 mL∶3cm2),溶血实验中浸提介质于37℃浸提1 h;致热源实验、皮肤致敏实验中浸提介质37℃浸提48 h,0.22 μm微孔滤器滤过除菌,4℃冰箱保存备用。
1.5 溶血实验
试管中加入实验样品浸提液0.2 mL、测试用红细胞悬液0.2 mL和生理盐水0.6 mL,混合均匀,37℃水浴60 min,750 r/min离心5 min,取上清液,545 nm波长测吸光度。以0.9%生理盐水为阴性对照,蒸馏水为阳性对照。每组设平行样品5个。根据公式计算材料的溶血率,当阴性对照组的吸光度<0.03,阳性对照组的吸光度=(0.8±0.30)时实验有效,实验样品的溶血率≤5%时,可判断样品不具溶血作用。

1.6 皮肤致敏实验
取浸提液、0.9%生理盐水(阴性对照)分别与弗氏完全佐剂等体积混合、充分混匀。在兔子的去毛区域作6点对称皮内注射,每个点相距10~20 mm。皮内注射1周后,用已经在浸提液、阴性对照液中浸泡至饱和的2 cm×4 cm大小滤纸黏附于注射局部,封闭固定48 h。2周后,再用在浸提液、阴性对照液中浸泡至饱和的滤纸黏附,封闭保留24 h。将滤纸取下后分别于1 h、24 h和48 h观察黏附处的红斑和水肿反应。按照致敏反应评分标准,即无红斑和水肿为0分,轻度红斑和水肿为1分,明显红斑和水肿为2分,中度红斑和水肿(直径<1 mm)为3分,重度红斑或轻度焦痂和严重水肿(直径>1 mm)为4分,计算致敏反应率,并对实验样品进行评价。
1.7 细胞毒性实验
取体外培养的第3代的尿路上皮细胞(图1)以2×107cells/L的浓度接种于96孔培养板内,每孔加200 μL的无血清角质细胞培养液(KSFM,Gibco公司)培养,放入5%CO2、37℃、饱和湿度培养箱内培养24 h,吸去培养液,各孔分别加入200 μL实验样品(胶原蛋白-壳聚糖、PVA-丝胶)浸提液,每种实验样品加5孔,阴性对照为KSFM培养液200 μL,再放入培养箱内。24 h、72 h、120 h后各取出1块培养板,每孔加四甲基偶氮唑盐(MTT,Sigma公司)20 μL,4 h后加二甲基亚砜(DMSO)200 μL,酶联免疫检测仪490 nm下测定吸光度。相同方法,进行实验样品与第3代膀胱平滑肌细胞(图2)的毒性实验,培养液及阴性对照为DMEM培养液。按照公式计算细胞相对增殖度,按6级毒性分级法计算毒性[5-6]。


图1 第3代泌尿上皮细胞(倒置显微镜,40×)Fig.1Morphology observation of the 3rdpassage of urothelial cells(Inverted phase contrast microscope,40×)

图3 第3代膀胱平滑肌细胞(倒置显微镜,40×)Fig.3Morphology observation of the 3rdpassage of bladder smooth muscle cells(Inverted phase contrast microscope,40×)
2 结果
2.1 溶血实验
阴性对照组的吸光度为(0.014±0.001)(<0.03),阳性对照组的吸光度为(0.832±0.018)(在0.8±0.30的范围内),表明实验有效。实验样品胶原蛋白-壳聚糖和PVA-丝胶的溶血率分别为1.86%和2.08%,均≤5%,表明两种材料体外实验无明显溶血反应(表1)。
2.2 皮肤致敏实验
复合材料胶原蛋白-壳聚糖、PVA-丝胶与阴性对照组的实验结果相比无明显差异,表明两种材料在本实验条件下未表现出致敏作用(表2)。
2.3 细胞毒性实验
采用四甲基偶氮唑盐微量酶反应比色法,细胞为体外培养的第3代尿路上皮细胞和第3代膀胱平滑肌细胞。结果显示,两种材料的细胞毒性均为0级(表3、4)。
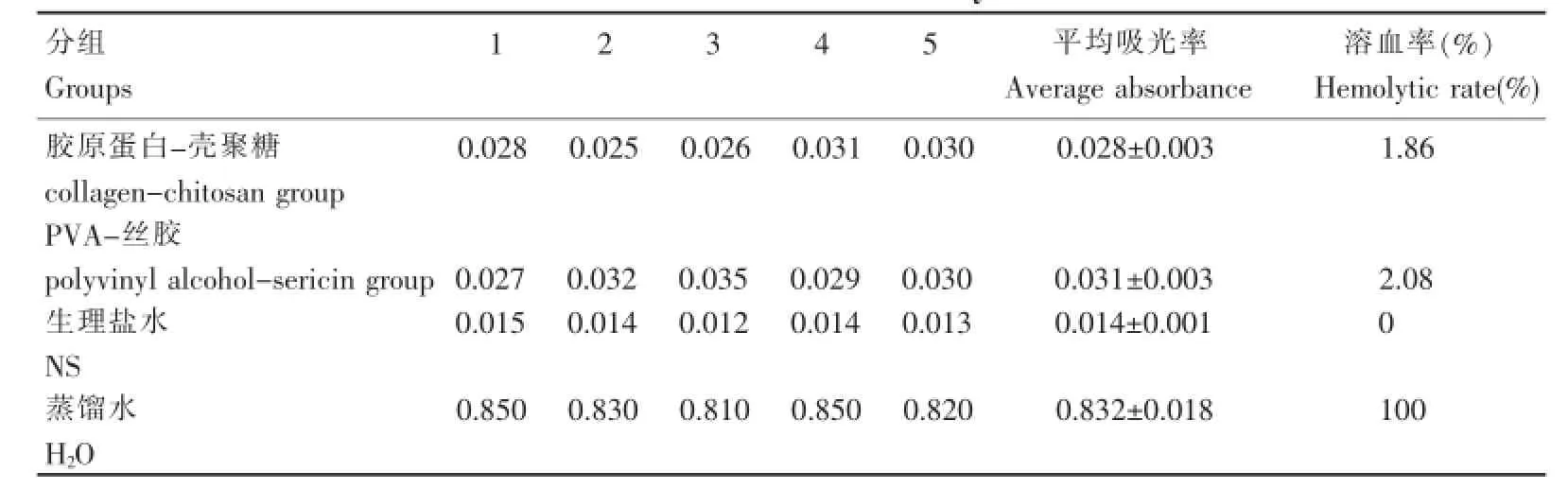
表1 溶血实验结果Table 1The results of hemolytic
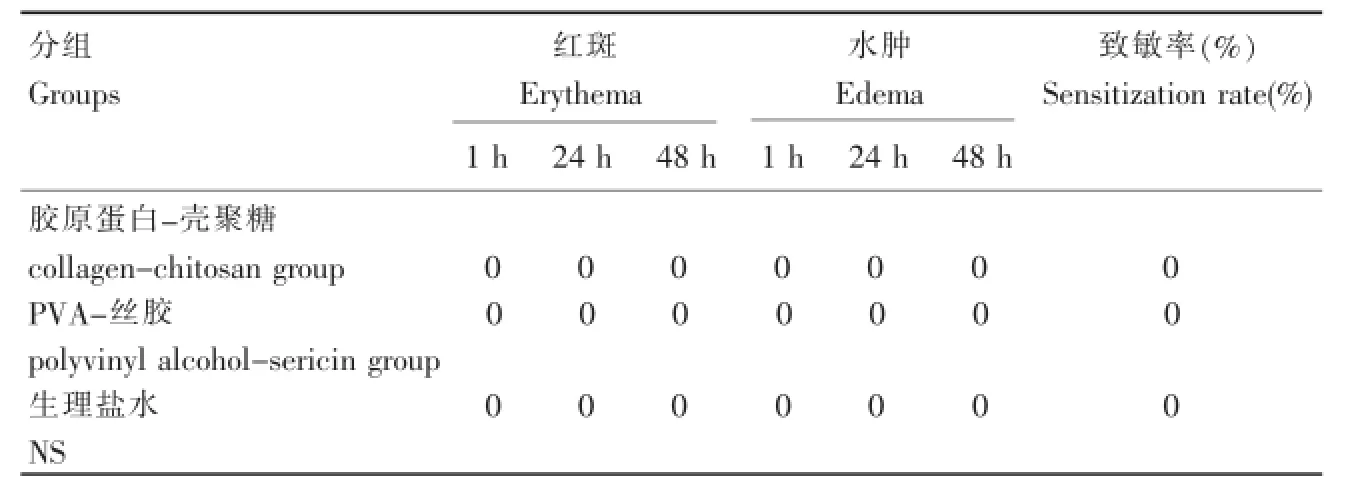
表2 皮肤致敏实验结果Table 2The results of skin sensitization test
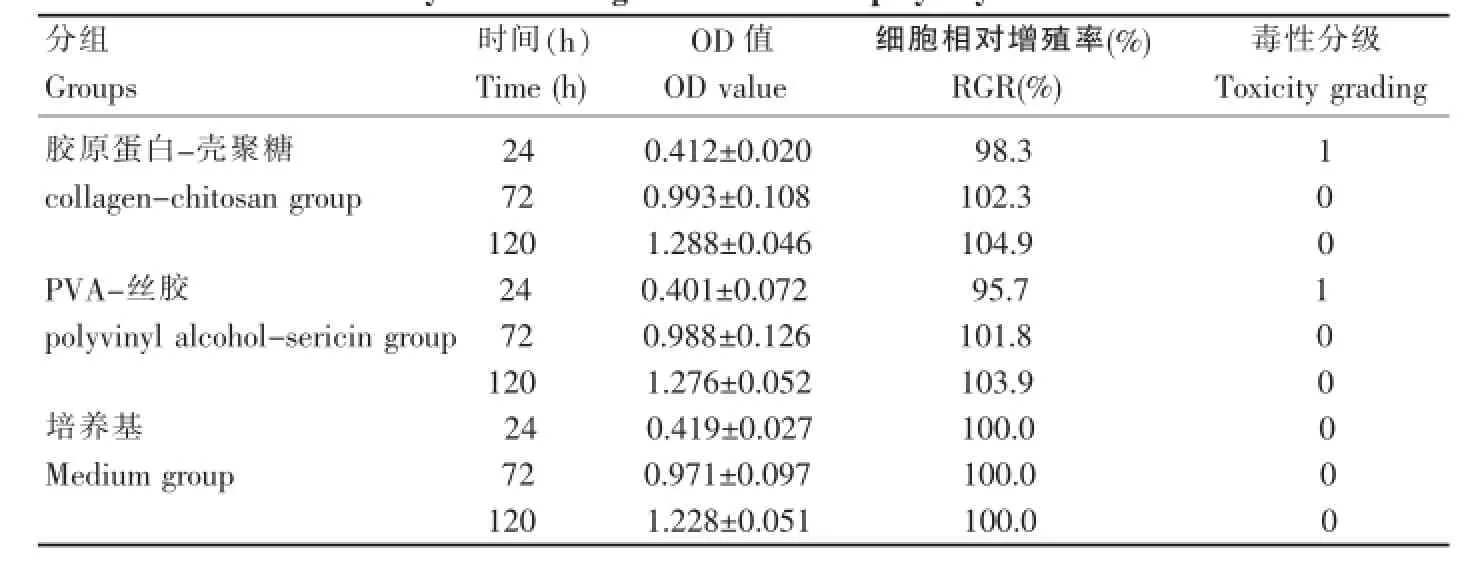
表3 胶原蛋白-壳聚糖、PVA-丝胶与泌尿上皮细胞毒性实验结果Table 3The results of MTT assay of the collagen-chitosan and polyvinyl alcohol-sericin on the urothelial cells

表4 胶原蛋白-壳聚糖、PVA-丝胶与膀胱平滑肌细胞毒性实验结果Table 4The results of MTT assay of the collagen-chitosan and polyvinyl alcohol-sericin on the bladder smooth muscle cells
3 讨论
泌尿系统组织工程支架材料主要有3种:①天然材料,如异种胶原和壳聚糖等;②人工合成材料,如聚乙醇酸(PGA)、聚乳酸(PLA)等;③脱细胞基质,如膀胱黏膜下脱细胞基质(BAMG)和小肠黏膜下脱细胞基质(SIS)等[7-8]。Atala等[9]采用BAMG支架治疗脊髓膜膨出伴膀胱功能异常取得成功;徐月敏等[10]成功使用脱细胞基质修复复杂、长段尿道狭窄。但与天然材料和人工合成材料相比,脱细胞基质并无优势,首先脱细胞基质取材较为复杂,且不能重复性大规模生产,另外机械特性和理化性状无法调控。
胶原蛋白和壳聚糖是组织工程常用的材料。单纯的胶原蛋白物理强度差、降解速度快[11];单纯的壳聚糖材料脆性较大、细胞黏附性低[12]。因此,我们将胶原蛋白与壳聚糖按9∶1比例共混,以冷冻干燥法制备胶原蛋白-壳聚糖支架。该支架为三维多孔结构,孔径在100~300 μm之间,孔径率达95%以上,且孔隙之间相互连通,有利于细胞的黏附增殖和营养成分的渗透。纯丝胶在水中的溶失率大、力学性能较差,难以直接作为医用材料使用,而PVA则具有良好的成膜性和较高的强度[13]。我们采用冷冻-解冻法制备PVA-丝胶支架,PVA与丝胶的比例为1∶1。
溶血实验的目的是通过样品在体外与血液直接接触,测定红细胞释放的血红蛋白量以评价材料对红细胞功能和代谢的影响。根据我国GB/T16886-2001医疗器械生物学评价标准,非直接接触血液的医用生物材料的溶血率应<5%。本实验中,胶原蛋白-壳聚糖和PVA-丝胶的溶血率分别为1.86%和2.08%,表明两种材料不引起溶血反应,能满足医用生物材料的应用要求。皮肤致敏实验是将一定量实验样品或其浸提液与实验动物皮肤接触,以检测实验样品引起皮肤致敏反应的可能性。结果表明,胶原蛋白-壳聚糖、PVA-丝胶两种材料满足体内植入的要求。四甲基偶氮唑盐微量酶反应比色法可检测实验样品对细胞造成的毒性损害程度,对材料的细胞毒性进行定量评价。实验表明,复合材料胶原蛋白-壳聚糖、PVA-丝胶和泌尿上皮细胞、膀胱平滑肌细胞具有良好的细胞相容性。
本实验结果显示,两种复合生物材料无细胞毒性,生物相容性良好,有望成为较理想的泌尿系统组织工程支架材料。
[1]Bisson I,Kosinski M,Ruault S,et al.Acrylic acid grafting and collagen immobilization on poly(ethylene tereph-thalate)surfaces for adherence and growth of human bladder smooth muscle cells [J].Biomaterials,2002,23(15):3149-3158.
[2]Niels-Erik J.Overcoming the stigma of complications of continent cutaneous diversion//Lee CT,Wood DP.Current clinical urology: bladder cancer[M].New York:Humana Press,2010,216-225.
[3]Atala A.Regenerative medicine and tissue engineering in urology [J].Urologic Clinics of North America,2009,36(2):199-209.
[4]卢慕峻,王忠,周广东,等.组织工程化膀胱壁复层结构的体外构建[J].中华泌尿外科杂志,2007,28:82-85.
[5]Santucci RA,Barber TD.Rwsorbable extracellular matrix grafts in urologic reconstruction[J].Int Braz J Urol,2005,31(3):192-203.
[6]朱卫东,徐月敏,冯超,等.冷冻后真空抽干膀胱脱细胞基质的生物相容性[J].中国组织工程研究与临床康复,2009,13(21):4011-4014.
[7]Atala A.Tissue engineering for the replacement of organ function in the genitourinary system[J].Am J Transplant,2004,4(6):58-73.
[8]汪继洪,徐月敏.泌尿系统组织工程支架材料的发展与应用[J].中国组织工程临床研究与临床康复,2010,14(29):5493-5497.
[9]Atala A,Bauer SB,Soker S,et al.Tissue engineered autologous bladder for patients needing cystoplasty[J].Lancet,2006,367(9518): 1241-1246.
[10]Xu YM,Qiao Y,Sa YL,et al.Urethral reconstruction using colonic mucosa graft for complex strictures[J].J Urol,2009,182(3):1040-1043.
[11]Griffon DJ,Sedighi MR,Schaeffer DV,et al.Chitosan Scaffolds: interconnective pore size and cartilage engineering[J].Acta Biomater, 2006,2(3):313-320.
[12]Perets A,Baruch Y,Weisbuch F,et al.Enhancing the vascularization of three-dimensional porous alginate scaffolds by incorporating controlled release basic fibroblast growth factor microspheres[J]. J Biomed Mater Res A.2003;65(4):489-497.
[13]高洋,冯屏,田晓慧,等.以柠檬酸作交联剂改善丝胶/聚乙烯醇热固化膜的性能[J].蚕业科学,2010,36(1):91-96.
Biocompatibility Evaluation of Collagen-Chitosan and Polyvinyl Alcohol-Sericin as Tissue Engineered Scaffold in Urinary System
HE Hongchao1,LI Wei2,DOU Hongjing2,WANG Xiaojing1,LIU Wei3,SUN Kang2,SHEN Zhoujun1.1 Department of Urology,Ruijin Hospital,Shanghai Jiaotong University School of Medicine,Shanghai 200025,China;2 School of Materials Science and Engineering and Institute of Composite Materials,Shanghai Jiaotong University,Shanghai 200240, China;3 Department of Plastic and Reconstructive Surgery,Shanghai Ninth People′s Hospital,Shanghai Jiaotong University School of Medicine,Shanghai 200011,China.Corresponding author:SHEN Zhoujun(E-mail:shenzj6@sina.com);SUN Kang (E-mail:ksun@sjtu.edu.cn).
ObjectiveTo investigate the biocompatibility of collagen-chitosan and polyvinyl alcohol-sericin as tissue engineered scaffold in urinary system.MethodsHemolytic test was performed to evaluate these materials′(collagenchitosan and polyvinyl alcohol-sericin)impact on the function and metabolism of erythrocyte.Skin sensitization test was used to investigate the feasibility of these materials as the implantation materials for human body.Cytotoxicity test(MTT assay)was used to evaluate these materials′influence on the growth and proliferation of cultured cells(urothelial cells and bladder smooth muscle cells).ResultsThe hemolytic rate of collagen-chitosan and polyvinyl alcohol-sericin was 1.86%and 2.08% respectively(<5%),and no hemolytic effect was observed.Skin sensitization test showed no difference between experimental groups(collagen-chitosan group and polyvinyl alcohol-sericin group)and control group,which indicated that these materials meet the requirements of implantation.The MTT assay showed that cytotoxicity score of collagen-chitosan and polyvinyl alcohol-sericin were both grade 0.ConclusionBoth of collagen-chitosan and polyvinyl alcohol-sericin have good biocompatibility and should be safe and promising in urinary reconstruction as tissue engineered scaffold.
Collagen-chitosan;Polyvinyl alcohol-sericin;Biocompatibility;Tissue engineering
Q813.1+1,R318.08
A
1673-0364(2011)02-0089-04
2011年2月20日;
2011年3月21日)
10.3969/j.issn.1673-0364.2011.02.007
上海交通大学医工(理)交叉重点项目(YG2009ZD202)。
200025上海市上海交通大学医学院附属瑞金医院泌尿外科(何竑超,王晓晶,沈周俊);200240上海市上海交通大学材料科学与工程学院,上海交通大学复合材料研究所(李伟,窦红静,孙康);200011上海市上海交通大学医学院附属第九人民医院整复外科(刘伟)。
沈周俊(E-mail:shenzj6@sina.com);孙康(E-mail:ksun@sjtu.edu.cn)。
