COCH基因与miR-96的相关性研究
2011-03-22许智华刘海霞
许智华 刘海霞
(山西省儿童医院耳鼻喉科,山西太原 030013)
COCH基因是人类发现的第1个伴前庭功能障碍的常染色体显性遗传非综合征型耳聋基因,定位于14号染色体长臂14q12~13,在耳蜗和前庭组织中有高度表达,其编码的Cochlin蛋白是内耳细胞外基质的主要成分。
COCH基因突变可致患者出现渐进性感音神经性耳聋、前庭功能障碍症状,诊断为人类常染色体显性遗传非综合征性耳聋疾病(Non-syndrom ic autosomal dom inant sensofineural deafness,DFNA)DFNA9[1]。
M icroRNAs(m iRNAs)是一种小的内源性非编码RNA分子,大约由21~25个核苷酸组成。这些小的m iRNA通常靶向一个或者多个mRNA,通过翻译水平的抑制或断裂靶标mRNAs而调节基因的表达[2]。
谢菲尔德大学沃尔特·马科蒂博士等通过对小白鼠的研究发现,m iR-96与哺乳动物耳蜗发育密切相关,m iR-96突变会导致人和小鼠渐进性失聪。研究人员认为,m iR-96会调节耳蜗毛细胞生理发育进程,也会影响耳蜗毛细胞的形态,对哺乳动物的听觉系统至关重要[3-5]。根据目前的研究基础,笔者通过荧光定量PCR来检测m iR-96是否会调节COCH基因的表达情况,或者两者之间存在某种关联。
1 材料与方法
1.1 实验材料与试剂
B95-8 (绒猴EBV 转化的白细胞)购自上海中科院细胞库;RPM I1640培养基与胎牛血清(FBS)为PAA产品;脂质体转染试剂Lipofectam ineTM 2000为Invitrogen公司产品;一步法RT-PCR扩增试剂盒购自美国Promega公司;m iRNA m im ics和m iRNA inhibitor购自广州锐博公司。
1.2 永生细胞系的建立
参照赵苏瑛等[6]的冻存白细胞法进行建系。
1.3 细胞转染
转染前1天接种细胞于24孔板,第2天细胞汇合度达到75%时进行转染,分组情况如下:m iR-96过表达组(加入m iRNA m im ics)、正常对照组、m iR-96低表达组(加入m iRNA inhibitor),每组重复3次,操作步骤按说明书进行,试剂用量按说明书的推荐用量而加。
1.4 染料法定量检测COCH基因的表达情况
转染24h后,收集细胞提取RNA,染料法定量检测COCH基因的表达情况。COCH基因引物如下:
F:5'-CTTCACGGTAGATGCTGGAGTAAG-3';
R:5'-GCCACAATGCCTGCTTCCTC-3',扩增长度为102bp。
内参为GAPDH:F:5'-TCTCTGCTCCTCCTGTTC-3';R:5'-ACTCCGACCTTCACCTTC-3',扩增长度为97bp。
1.5 统计学处理
采用SPSS12.0软件进行非参数一致性检验、秩和检验及χ2检验,P <0.05为差异有统计学意义。
2 结果
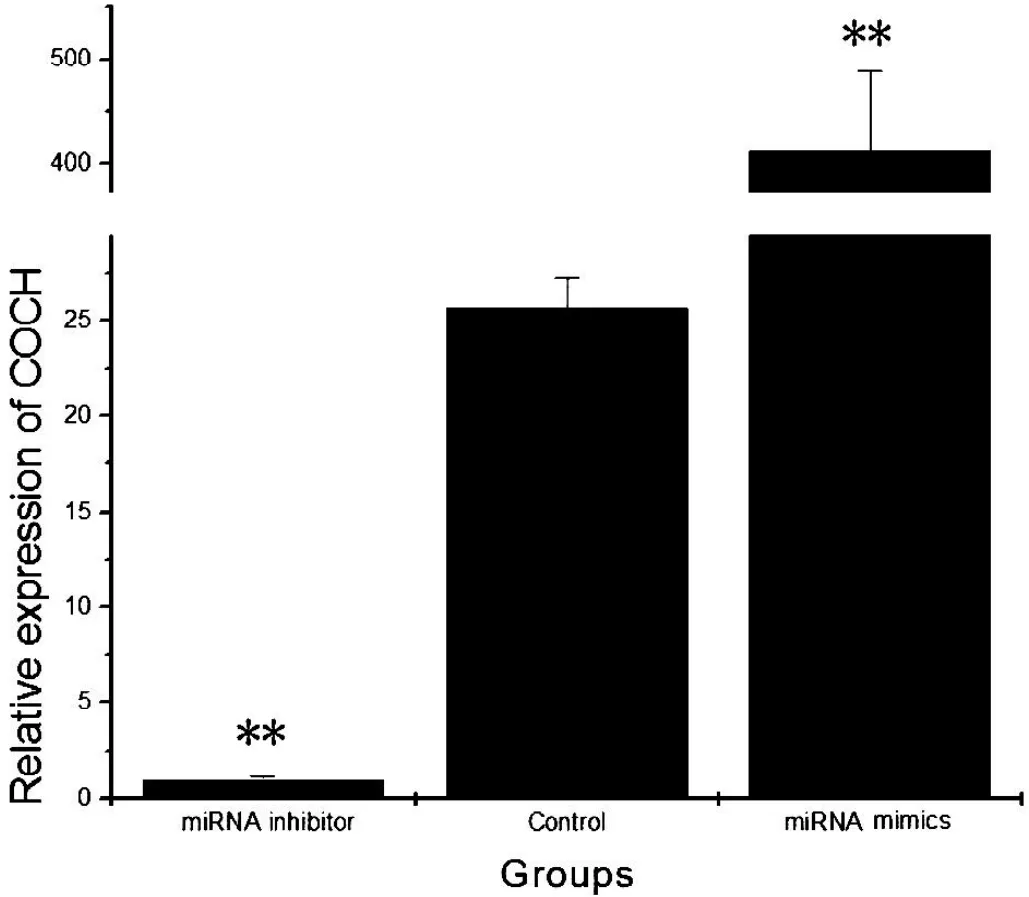
图1 COCH的表达与m iR-96的关系
将m iRNA inhibitor组中COCH的相对表达水平的平均值设为1,与对照组相比,转入m iRNA抑制剂组的COCH的表达显著降低(P <0.05);转入m iRNA模拟物组的COCH表达显著增高(P < 0.05)。这与通常的m iRNA呈负调控的机理相反,而表现出协同关系。见图1。
3 讨论
COCH基因是人类发现的第1个伴前庭功能障碍的常染色体显性遗传非综合征性耳聋基因,在耳蜗和前庭组织中有高度表达,其编码的Cochlin蛋白是内耳细胞外基质的主要成分。COCH基因突变可致患者出现渐进性感音神经性耳聋、前庭功能障碍症状,诊断为DFNA9。DFNA9家系表现为迟发性、进行性听力下降,在不同的家系中耳聋的发生年龄从十几岁至四五十岁不等,患者在耳聋发生时即伴有走路不稳(尤其是在夜间)和头部运动时出现幻视等前庭功能障碍表现,耳聋的外显率几乎为100%。总之,COCH基因作为一个在前庭、耳蜗均有表达的基因,对于耳蜗及前庭功能变化起着至关重要的作用,但COCH基因及其编码的Cochlin蛋白的功能、致病机制尚不完全清楚[7]。
而最近的研究发现,m iR-96与哺乳动物耳蜗发育密切相关,m iR-96突变会导致人和小鼠渐进性失聪。研究表明,通常m iR-96会在特定阶段影响许多与发育相关的不同基因表达,进而调节毛细胞的生长过程。一旦小鼠体内m iR-96基因中某一区域的单个碱基对突变,就会导致小鼠众多的基因表达的改变。研究论文指出,m iR-96发生突变,使得小鼠在出生后,其内耳和外耳毛细胞出现生物物理变异之前,感觉毛细胞的生理发育即已受到影响。
此外,m iR-96突变后,毛细胞静纤毛束的发育和耳蜗内听觉神经联系的构建都会受到影响,这不仅会影响毛细胞的敏锐程度,还会影响感觉神经的电信号传递。据此,研究人员认为,m iR-96会调节耳蜗毛细胞生理发育进程,也会影响耳蜗毛细胞的形态,对哺乳动物的听觉系统至关重要[8-10]。
基于COCH基因和m iR-96发生突变后均会引起相似的病症,笔者试图探讨这两者之间是否存在某种关联。而本实验的数据说明m iR-96并没有对COCH基因进行负调控,而是出现协同现象。这有可能是m iR-96通过调控其他相关因子而促进了COCH基因的表达,从而在动物耳蜗发育中表现出协同作用。现有资料表明很多人包括一些新生儿和小孩会受到渐进性失聪的影响,而科学家对于渐进性失聪的遗传因素了解甚少。随着人们对COCH基因及其编码的Cochlin蛋白功能的深入研究,COCH基因及其编码的Cochlin蛋白功能与DFNA9疾病的相互关系将得到进一步阐明。而同时,m iR-96发生变异可导致渐进性失聪的分子机制的发现,可为未来该疾病的治疗提供新的分子标靶,为改善听力损失和失聪的治疗手段奠定了基础。
[1]陈金霞,张桂茹,张明辉.COCH 基因与DFNA9的相关性研究[J].吉林医学,2007,28(2):169-171.
[2]Guo H,Ingolia NT,Weissman JS,et al.Mammalian m icroRNAs predom inantly act to decrease target mRNA levels[J].Nature,2010,466(7308):835-840.
[3]Stephanie Kuhna, Stuart L. Johnsona, David N. Furnessb, et al. m iR-96 regulates the progression of differentiation in mammalian cochlear inner and outer hair cells[J].PNAS,2011,108(6):2355-2360.
[4]Sacheli R. Expression patterns of m iR-96,m iR-182 and miR-183 in the development inner ear[J].Gene Expr Patterns,2009,9(5):364-370.
[5]Lew is MA. An ENU-induced mutation of miR-96 associated with progressive hearing loss in m ice[J].Nat Genet,2009,41(5):614-618.
[6]赵苏瑛,张海军,徐春宏,等. 非综合征耳聋大家系永生细胞系的建立及几种EB病毒转化外周血淋巴细胞建系方法的探讨[J].遗传,2005,27(3):447-450.
[7]孙悍军,陶然,程静,等. 常染色体显性遗传非综合征型耳聋致病基因定位研究[J].遗传,2006,28(12):1489-1494.
[8]Dror AA,Avraham KB.Hearing loss:Mechanisms revealed by genetics and cell biology[J].Annu Rev Genet,2009,43(1):411-437.
[9] Mencía A .Mutations in the seed region of human m iR-96 are responsible for nonsyndrom ic progressive hearing loss[J].Nat Genet,2009,41(5):609-613.
[10] Friedman LM. M icroRNAs are essential for development and function of inner ear hair cells in vertebrates[J].Proc Natl Acad Sci USA,2009,106(19):7915-7920.
