含硼卟啉在硼中子捕获治疗中的研究进展
2011-03-21杨玉青宋宏涛蒲满飞
杨玉青 宋 虎 宋宏涛 蒲满飞
(中国工程物理研究院核物理与化学研究所 绵阳 621900)
硼中子捕获治疗(boron neutron capture therapy, BNCT)的实质是α粒子和反冲Li粒子的辐射治疗,其治疗原理见文献[1]。选用对肿瘤有特异性亲和力的硼(10B)化物注入体内,使其浓集在肿瘤部位,用适当能量的中子束照射该肿瘤,发生10B(n, α)7Li反应。此项研究始于20世纪30年代,由于50年代用于人体实验的灾难性结果(低剂量中子束辐照的患者死于肿瘤,高剂量中子束辐照的患者死于辐照),使这项研究在随后的几十年中处于低谷,至20世纪90年代后又引起了人们的研究热情[2−4]。
1 BNCT的特点及存在问题
10B(n, α)7Li反应发射1.47 MeV α粒子,其在生物组织中的射程为9–10 μm,接近细胞直径(体内细胞平均直径为10 μm);该反应的反冲7Li离子能量为0.84 MeV,在生物组织中的射程4–5 μm,两种粒子在细胞中的传能线密度约为200 keV/μm,可破坏多种生物活性物质(包括DNA、RNA和蛋白质),造成不可恢复的损伤。另外,该反应还伴有 0.48 MeV的瞬发γ射线,可检测该γ射线而及时掌握体内发生中子捕获反应的10B的量。
BNCT实验的灾难性后果,主要由于硼化物对肿瘤的亲和性不够高,因此,除建立高强力中子源外,制备对恶性肿瘤有高特异性亲和力的硼化物也是BNCT研究的重点。目前临床应用的小分子硼化物为BSH(Na2B12H11SH, disodium mercapto-closododecaborate)、BSSB (BSH的二聚体)和BPA (C9H10NO2B(OH)2,l-4-dihydr-oxyborylphenylalanine)。这几种化合物的靶向性均不理想,其中BSH和BPA能获得的肿瘤/血比分别约1:1和3:1。然而BNCT临床应用对靶向性的要求是:肿瘤/非靶组织比≥5:1、肿瘤/血比≥10:1、肿瘤组织10B含量达到20–35 μg/g。在研究对恶性肿瘤有高特异性亲和力的硼化物中,人们发现硼化的血卟啉类化合物的亲瘤性比BSH高3–4倍,不同种类含硼卟啉的研究成了BNCT研究中的热点。
目前开展中子捕获治疗研究的主要在美国(布鲁克海文国家实验室、加利福尼亚大学、路易斯安那大学等)和日本,我国西北核技术研究所、第四军医大学、中国原子能科学研究院、内蒙古民族大学、中国医学科学院等也开展了相关研究,含硼化合物局限在BSH和BPA[5−8],无含硼卟啉的研究报道。
2 含硼卟啉衍生物的特点及在 BNCT中的应用潜力
癌组织特异性聚集内源性卟啉,对非内源性卟啉及衍生物,恶性肿瘤细胞对其亲和力明显高于正常细胞,且卟啉衍生物在肿瘤细胞内的保留时间明显高于正常细胞[9],由于卟啉基团的介导,含硼卟啉衍生物可在肿瘤组织中选择性浓集和滞留。同时,大部分含硼卟啉分子中含有磞烷或类似结构的基团(如巢状磞烷、碳磞烷、巢状碳磞烷等),一个含硼卟啉分子含8–39甚至72个10B原子,易达BNCT临床应用对肿瘤组织10B含量(20–35 μg/g)的要求。
另外,卟啉衍生物的基本分子结构基础是卟吩环,由四个吡咯环构成的 pπ共轭体系,这种分子结构易于被激光、超声波、辐射激活,在肿瘤内诱发一系列氧化反应来杀伤肿瘤细胞。因此,含硼卟啉衍生物还可用作BNCT和光动力法(photodynamic therapy, PDT)或/和超声动力法(ultrasonic dynamic therapy, USDP)的多效增敏剂,一次给药后可对肿瘤实施多种方式的联合治疗,取得综合效果。综上分析,含硼卟啉衍生物在BNCT及相关治疗中有巨大的应用潜力。
3 含硼卟啉衍生物的研究进展
美国Brookhaven国家实验室Miura等[10−13]合成并系统比较了碳磞烷及巢状碳磞烷取代的、卟吩环上有或无金属原子配位的四苯基卟啉衍生物及血卟啉类衍生物(分子结构如图1)的水溶性、毒性、细胞摄取及肿瘤模型中的摄取。他们发现,巢状磞烷卟啉衍生物的水溶性明显大于磞烷类似物;硼化物体外细胞实验证明有高的细胞摄取,但体内实验表明达到治疗剂量时有过高的毒性而不宜应用;含硼卟啉经腹腔注入荷乳腺癌小鼠体内后,不溶于水的四苯基含硼卟啉(图1a)比溶于水的类似物有较小的毒性和较高的肿瘤硼摄取量,而血红素类含硼卟啉(图1b)除VCDP(R=C2HB9H10−K+, Y=H,M=2H)外,都有较大毒性。四苯基含硼卟啉中,NiTCP-H(R=H, Y=OCH2C2HB10H10, M=Ni),肿瘤 B摄取量>100 μg/g,肿瘤/血比>500,肿瘤/脑比>50;而NiTCP(R=CH2CO2CH3, Y=OCH2C2HB10H10, M=Ni)的肿瘤B摄取量~50 μg/g;两种含硼卟啉在100 μg/g剂量下都未对小鼠显示毒性。VCDP的生物分布与未硼化的卟啉衍生物的分布相似,对皮下移植乳腺癌KHJJ的小鼠,腹腔注入VCDP,获得肿瘤B摄取量为30–50 μg/g,但肿瘤中心坏死区的B摄取量仅为肿瘤周边非坏死区的一半;血液检查发现有血小板减少症、肝脏酶水平变化、粒细胞增多症,血清除时间从注入后18 h至6 d;在肿瘤B摄取达30–50 μg/g峰值后,VCDP的毒性开始减弱。
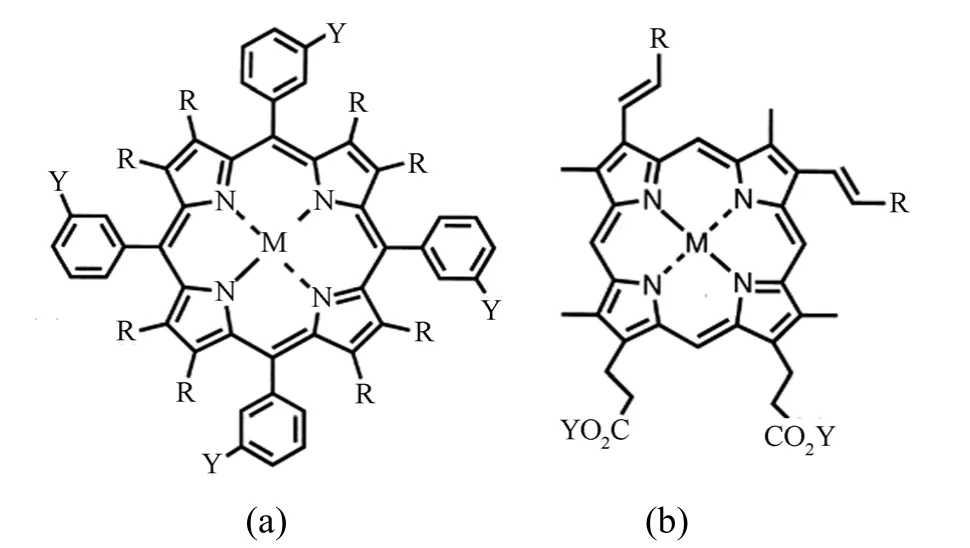
图1 四苯基含硼卟啉(a)和血红素含硼卟啉(b)的分子结构Fig.1 Molecular structure of carborane-containing tetraphenylporphyrin(a) and carborane-containing heme porphyrin(b).
NiTCP-H和NiTCP的肿瘤/血比、肿瘤/脑比及在肿瘤中的滞留时间均优于目前临床用含硼化合物。CuTCP-H和CuTCP(R=CH2CO2CH3, Y= OCH2C2HB10H10, M=Cu)的分布特性与NiTCP-H和NiTCP相同。将 CuTCP-H的 H用 Br代替形成CuTCPBr,在腹腔注射200 mg/kg剂量未显示任何毒性,两天后在SCCV II瘤模型中,肿瘤/血比达120、肿瘤/正常脑比达700,在EMT-6瘤模型中的肿瘤/血比达 20、肿瘤/正常脑比达 125。对CuTCP-H、CuTCP和 CuTCPBr,可标记67Cu 或76Br,可用SPECT或PET显像辅助BNCT的治疗。
美国California大学Kahl等[14]报道形成了中位取代的巢状硼烷卟啉BTPP(图2)。其在神经胶质瘤组织的B摄取量3–7 d后为18–33 μg/g,卵巢癌的摄取量达45 μg/g。血液分析表明,BTPP有中等的血液毒性和血小板减小症。2004年,美国Idaho国家工程实验室等[15]将BTPP的四个巢状碳磞烷替换为四个十二磞烷的 TABP-1,该化合物的水溶性良好,在荷人 U-89胶质瘤鼠模型内的摄取因给药方式不同差异很大,从尾静脉给药,瘤内B摄取量30 μg/g,若用对流增强方式给药,瘤内B摄取量可达65.4 μg/g、瘤/血比160、同侧瘤/正常脑比5、对侧瘤/正常脑比达26,尤宜于临床BNCT的应用。2007年,Koo等[16]又将TABP上的-NH-替换成-S-和-O-分别形成TEBP和TOBP,比较其毒性,认为它们引起哺乳动物的血小板减少是计量限定的毒性,该毒性可能来源于分子的卟啉部分而非磞烷部分,卟啉的大环可能与造血系统的骨髓干细胞或血液的血小板相互作用,作用机制尚不清楚。

图2 BTPP分子结构Fig.2 Molecular structure of BTPP.
BOPP(含硼重量分数约30%, 分子结构见图3)是一种血红素类硼烷卟啉衍生物,Ceberg等[17]比较了BOPP和BSH在荷脑胶质瘤RG2鼠模型中的药代动力学和生物分布。经股静脉给药,BOPP在24 h后的瘤/血比为6、瘤内硼含量81 μg/g,而BSH在12 h后的瘤/血比仅0.6、瘤内硼含量达15 μg/g;BOPP的硼从肿瘤组织内释放的速度是 BSH的1/10,高的肿瘤摄取与滞留充分显示了卟啉的亲瘤性。Tibbitts等[18,19]开展了BOPP大动物(狗)中的毒性、血浆动力学和组织分布研究。静脉注射35 mg/kg剂量,副作用仅限于注入点的血栓症和 3/16例轻度、很可能是瞬时的肝损伤,临床病理实验发现白细胞和血小板的变化是可恢复的;BOPP是两亲分子,在血浆中主要与脂蛋白结合,在人胶质瘤细胞内的摄取是通过低密度脂蛋白受体通道进行的,其血浆动力学为2–3次方的指数分布。Dagrosa等[20]研究了BOPP在荷人甲状腺瘤鼠模型中的分布,表明单独BOPP给药后没有明显的瘤摄取,但在BPA给药前5–7 d给BOPP后,瘤内B摄取量(38–45 μg/g)高于单独的 BPA的值(20 μg/g),瘤/血比 3.8、瘤/正常甲状腺比6.6、瘤/肺比2.9,认为是两种药物不同的药代动力学联合作用的结果。
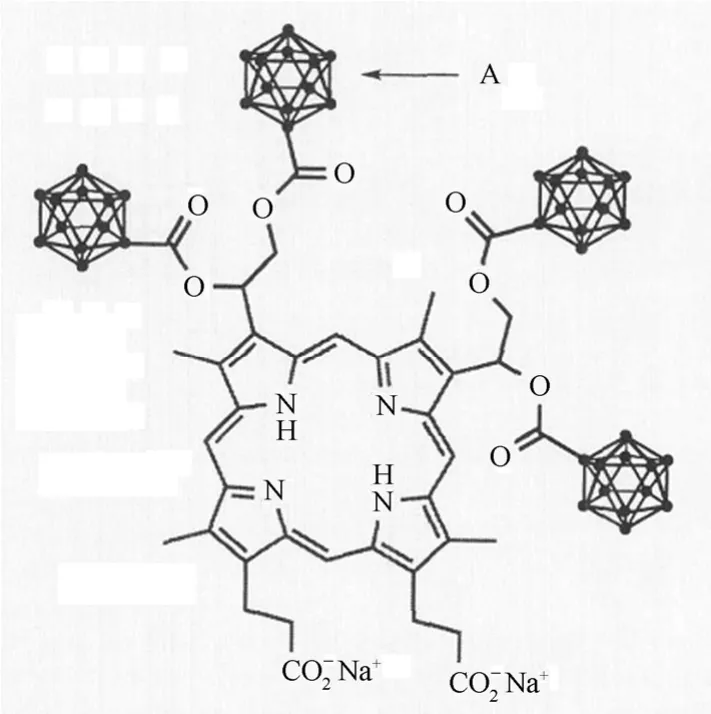
图3 BOPP分子结构Fig.3 Molecular structure of BOPP.
Vicente等[21−26]报道了中位苯基巢状碳磞烷取代的卟啉衍生物 TDNCMPP、H2TCP、H2OCP、H2TCTBP(分子结构见图4)。其中TDNCMPP在水溶液中有好的溶解性,并保持双亲特性,而对应的笼状硼烷的卟啉衍生物完全不溶于水;比较了其与卟吩环与 Zn(II)配位的类似物在荷瘤鼠中的分布,显示两者都有好的肿瘤选择性摄取,2 d后的瘤组织B摄取量分别达(32.5±7.1) μg/g和(54.3±14) μg/g,其中含 Zn的配合物有较高的肿瘤组织摄取量,但肿瘤/血比较低(4.7对应于9.8),肿瘤/正常脑的摄取比>100,在75–78 mg/kg体重的注入加剂量下,实验动物未见并发症或死亡;制备晶体的XRD分析确定了Zn(II)卟啉的一些分子结构参数:Zn(Ⅱ)位于卟吩环平面上方0.434 Å,Zn(II)与卟吩环N的键长在2.07–2.13Å。
荧光显微观测 H2TCP主要分布在细胞内的细胞质中,在红光照射下对B16F1细胞有95%以上的光杀伤效应;经静脉注入荷C57BL/6瘤鼠模型后在肿瘤细胞中有明显富集,所用H2TCP是溶于按质量分数20%/30%/50%的DMSO/PEG400/water混合溶液,显示H2TCP可用作光动力治疗和BNCT治疗的双效药剂;H2TCP在荷黑色素瘤小鼠中的分布与H2TCP的溶液配方有很大关系,需进一步研究。在意大利进行的中子辐照实验荧光分析表明,H2TCP主要摄取于肿瘤细胞内,用5 kW反应堆中子束照射20 min后观察到对肿瘤生长的明显阻碍。
H2TCP与H2OCP的比较研究发现H2OCP在肿瘤细胞中的摄取较慢且较少。但具 PDT和 BNCT双效作用,H2OCP在T98G肿瘤细胞中的聚集高于对应的在卟吩环上与 Zn(II)配位的类似物,H2OCP虽含有8个巢状碳磞烷,但仍可被摄取入细胞内部;其毒性低,并提示带负电荷的卟啉衍生物常摄取入细胞的溶酶体中;肿瘤细胞 B摄取量远高于 BPA和BSH,注入12 h后B摄取量分别为(272±15) μg/g、(239±12) μg/g、(85±2) μg/g,且H2OCP的10B在肿瘤细胞内滞留时间远大于BPA,与BSH相当,因此H2OCP有希望在BNCT中代替BPA/BSH,并同时具有PDT疗效。
H2TCP与H2TCTBP的比较研究发现,与对应的非苯并卟啉结构H2TCP相比,苯并卟啉H2TCTBP由于卟啉π共轭体系的扩展,其稳定性更高、吸收红移、碱性增强、氧化势降低、亲脂性强;体外细胞实验表明,H2TCTBP在人体胶质母细胞瘤细胞T98G中有>30%的摄取,并优先聚集于细胞的溶酶体中;小鼠毒性实验表明,两种化合物在腹腔单次注入160 mg/kg高剂量下均无毒性,显示H2TCTBP是有希望的治疗恶性肿瘤新制剂;其中亲脂性强导致的细胞摄取高的解释,与以前的亲脂性较强巢状碳硼烷卟啉的细胞摄取较高的报道一致。
Friso等[27]研究了 H2TCTBP的类似物 BZnB4Pc(以酞菁代替卟啉、以磞烷代替巢状碳磞烷),经尾静脉注入荷瘤鼠24 h后,用热中子照射20 min,观察到肿瘤生长延迟了4 d。
Hao等[28]合成了5种在卟啉中位连接有1–4个Co(II)巢 状 碳 磞 烷 (-C5H4N-C2H4-O-C2H4-OB9H9C2CoB9H9C2)的卟啉衍生物,比较了它们在HEp2细胞中的摄取、细胞毒性及亚细胞摄取位点,表明细胞B摄取量与分子中钴磞烷的数量成明显的正相关,电荷多的分子更易发生团聚,邻位双钴磞烷卟啉比对位双钴磞烷卟啉在细胞内的摄取量大;给药体系会改变钴磞烷卟啉在亚细胞水平的分布,用脂质体体系给药可明显增大细胞对B的摄取量,说明磞烷卟啉存在于脂质体的空囊内,由细胞内吞作用进入细胞内。

图4 几种含硼卟啉的分子结构Fig.4 Molecular structure of boron porphyrins.
文献[29–31]报道血红素类硼烷卟啉衍生物ATN-10、STA-BX909和EC032磞烷与卟啉间的连接基团不同。ATN-10和STA-BX909都在卟吩环上与Mn(II)配位,ATN-10在静脉注入荷人脑胶质瘤鼠模型24 h后的瘤/脑比达10;STA-BX909在体外神经胶质瘤细胞中的B摄取量随细胞孵育时间增加,而BSH在对比实验中B摄取量随孵育时间的增长保持不变;体外细胞的热中子辐照实验表明STA-BX909比BSH有较高的细胞毒性;EC032在几种细胞中的摄取实验显示其毒性低,细胞内B摄取量随孵育时间增加;显示可用荧光分析法代替ICP-AES分析法。El-Zaria等[32]比较了含单个B12H11SH2−、B12H11NH3−或 B12H11OH2−磞烷阴离子的原卟啉Ⅸ衍生物的毒性和细胞摄取能力,表明这三种含硼卟啉的细胞毒性低,其中 B12H11NH3−和B12H11OH2−类的毒性均小于BOPP,B12H11NH3−类的细胞B摄取量最高,对HeLa细胞的光动力疗效最好;若分子中连接两个B12H11SH2−,则细胞毒性明显增大,提示减少磞烷的数量可降低衍生物的细胞毒性;结合 Na+的磞烷卟啉衍生物的细胞摄取量是结合(CH3)4N+的磞烷衍生物的4倍;一定情况下,磞烷卟啉衍生物分子的亲脂性越高、细胞摄取量越大;PDT研究发现,摄取了这些磞烷卟啉的细胞在激光照射下未诱发细胞毒性,但降低了细胞成活率。
天然卟啉是单卟啉、卟啉二聚体、卟啉多聚体的混合物,单卟啉在体内的生物活性不高,卟啉聚体的体内生物活性高;对光敏素II(Photofrin II)的分析表明,在肿瘤细胞中摄取的主要是以醚键连接的卟啉二聚体和三聚体;由于醚键连接的二聚体不稳定,人们开始研究以碳键连接的二聚体,但不同连接位置的碳键二聚体的体内活性不同,表明分子形状、结构与肿瘤摄取间有强关联。Isaac等[33]合成了确定结构的醚键连接、碳键连接的二聚体。
天然卟啉在光合作用、细胞呼吸和电子转移反应中发挥重要作用,而天然卟啉的中位没有取代基,目前研究的卟啉多是中位取代的水溶性卟啉衍生物和非中位取代的血红素类衍生物,非血红素类中位不取代卟啉(也称 β位取代卟啉)的研究很少,而这类水溶性卟啉的合成和纯化非常困难。Murashima等[34]合成了水溶性的双环卟啉和苯并卟啉,Clark等[35]合成了非血红素类 β位取代硼烷卟啉(分子结构如图5,卟吩环上也可与Zn(II)配位),但没有进一步生化性能研究的报道。

图5 β位取代硼烷卟啉的分子结构Fig.5 Molecular structure of boron porphyrins.
Brothers[36]综述了用于 BNCT的系列在卟吩环内共价连接硼(一般 2个硼原子)的卟啉衍生物,分析了卟吩环的大小、环内连接原子大小与连接后的空间结构之间的联系。指出卟吩环的半径接近 2.0 Å,卟吩环上N原子的共价半径~0.75 Å,环内连接原子大小的最佳共价半径为1.25 Å,较大原子结合后将偏离卟吩环的平面。硼原子的共价半径为0.85 Å,因此,一般是2个硼原子与卟吩环的4个氮原子形成结合。这类卟啉分子中的硼原子含量较低,在卟吩环上不能再与其他金属原子配位。
Bregadze等[37,38]综述了含硼卟啉衍生物的研究进展,尤其是用作BNCT及光动力疗法的双效治疗剂的笼型和巢状硼烷卟啉的络合物,除了上述常规卟啉衍生外,还有扩展卟啉。
4 结语
上世纪90年代开始,含硼卟啉的研究受到广泛关注,但卟啉的合成困难,含硼卟啉结构复杂,虽经多年研究积累了很多经验和数据,但还远未在卟啉衍生物结构与性能间建立普适联系,尚无一个含硼卟啉进入BNCT的临床应用。含硼卟啉的研究在持续进展,除了卟啉衍生物结构的优化外,通过给药方式的优化(如应用对流增强给药途径、通过脂质体体系给药或与BPA/BSH联合给药)提高BNCT性能,同时,扩展其可能的PDT、USDT等多模治疗功能也是重要研究方向,含硼卟啉用作BNCT硼携带剂的研究尚有很多工作要做。
1 Mundy D W, Jevremovic T. Monta carlo assessment of boron neutron capture for the treatment of breast cancer [J]. Nucl Technol Radiat Prot, 2005, 1: 27–31
2 Flam F. Will history repeat for boron capture therapy[J]. Science, 1994, 265(5171): 468–469
3 Barth C F, Soloway A H, Fairchild R G. Boron neutron capture therapy of cancer[J]. Cancer Res, 1990, 50(15): 1061–1070
4 Sweet W H. Early history of development of boron neutron capture therapy of tumors[J]. J Neuro-Oncology, 1997, 33(1–2): 19–26
5 肖 艳, 屠 荆, 唐凌天, 等. 对 2-羟基硼酰苯丙氨酸的99Tcm标记及其生物分布[J]. 核化学与放射化学, 2005, 27(1): 35–41
XIAO Yan, TU Jing, TANG Lingtian, et al. Labelling of 4-dihydroxyborylphenylalanine (BPA) with99Tcmand biodistribution of99Tcm-DMG-BPA[J]. J Nucl Radiochem, 2005, 27(1): 35–41
6 陈保国, 张明瑜, 赵媛媛, 等. 4-二羟基硼苯丙氨酸(BPA)及其多羟基衍生物 BPA(OH)n(n=1,2,4)的电子结构的理论研究[J]. 高等学校化学学报, 2006, 27(7): 1307–1310
CHEN Baoguo, ZHANG Mingyu, ZHAO Yuanyuan, et al. Theoretical studies on electronic structures of cascade polyol-attached p-dihydroxyborylphenylalanine derivatives[J]. Chem J Chinese Univ, 2006, 27(7): 1307–1310
7 陈保国, 张明瑜. 硼中子捕获疗法中B12H11SH2−及二聚体和自由基的结构特性[J]. 内蒙古民族大学学报, 2008, 23(5): 505–509
CHEN Baoguo, ZHANG Mingyu. Theoretical study on the structural features of B12H11SH2−used in boron neutron capture therapy[J]. J Inner Mongolia Univ Natl, 2008, 23(5): 505–509
8 陈保国, 张明瑜, 赵媛媛, 等. 硼中子捕获疗法中使用的1,2-C2B10H12异腈衍生物的结构和电子特性[J]. 高等学校化学学报, 2006, 28(4): 760–763
CHEN Baoguo, ZHANG Mingyu, ZHAO Yuanyuan, et al. Structural and Electronic properties of 1,2-C2B10H12isonitrile derivatives used in boron neutron capture therapy[J]. Chem J Chinese Univ, 2007, 28(4): 760–763
9 蒲满飞.188Re(117mSn,153Sm)标记卟啉配体及其性质研究[D]. 绵阳: 中国工程物理研究院, 2005
PU Manfei.188Re(117mSn,153Sm) labelled porpyrin compounds and their properties[D]. Mianyang: China Academy of Engineering Physics, 2005
10 Miura M, Gabel D, Oenbrink G, et al. Preparation of carboranyl porphyrins for boron neutron capture therapy [J]. Tetrahedron Letters, 1990, 31(16): 2247–2250
11 Miura M, Micca P L, Heinrichs J C, et al. Biodistribution and toxicity of 2,4-divinyl-nido-o-carboranyldeuteroporphyrin IX in mice[J]. Biochem Pharm, 1992, 43(3): 467–476
12 Miura M, Micca P L, Fisher C D, et al. Evaluation of carborane-containing porphyrins as tumour targeting agents for boron neutron capture therapy[J]. Br J Radiol, 1998, 71: 773–781
13 Miura M, Morris G M, Micca P L, et al. Synthesis of copper octabromotetracarboranylphenylporphyrin for boron neutron capture therapy and its toxicity and biodistribution in tumour-bearing mice[J]. BR J Radiol, 2004, 77: 573–580
14 Kahl S B, Joel D D, Nawrocky M M, et al. Uptake of a nido-carboranylporphyrin by human glioma Xenografts in athymic nude mice and by syngeneic ovarian carcinomas in immunocompetent mice[J]. Proc Natl Acad Sci U S A, 1990, 87: 7265–7269
15 Ozawa T, Santos R A, Lamborn K R. In vivo evaluation of the boronated porphyrin TABP-1 in U-87 MG intracerebral human glioblastoma xenografts[J]. Mol Pharm, 2004, 1: 368–374
16 Koo M S, Ozawa T, Santos R A, et al. Synthesis and comparative toxicology of a series of polyhedral borane anion-substituted tetraphenyl porphyrins[J]. J Med Chem, 2007, 50: 820–827
17 Ceberg C P, Brun A, Kahl S B, et al. A comparative study on the pharmacokinetics and biodistribution of boronated porphyrin (BOPP) and sulfhydryl boron hydride (BSH) in the RG2 rat glioma model[J]. J Neurosurg. 1995, 83: 86–92
18 Tibbitts J, Fike J R, Lamborn K R, et al. Toxicology of a boronated porphyrin in dogs[J], Photochem Photobiol, 1999, 69: 587–594
19 Tibbitts J, Sambol N C, Fike J R, et al. Plasma pharmacokinetics and tissue biodistribution of boron following administration of a boronated porphyrin in dogs [J]. J Pharm Sci, 2000, 89: 469–477
20 Dagrosa M A, Viaggi M, Rebagliati R J, et al. Biodistribution of boron compounds in an animal model of human undifferentiated thyroid cancer for boron neutron capture therapy[J]. Mol Pharm, 2005, 2: 151–156
21 Vicente M G, Wickramasinghe A, Nurco D J, et al. Synthesis, toxicity and biodistribution of two 5,15-Di[3,5-(nido-carboranylmethyl) phenyl]porphyrins in EMT-6 tumor bearing mice[J]. Bioorganic Med Chem, 2003, 11: 3101–3108
22 Gottumukkala V, Luguya R, Fronczek F R, et al. Synthesis and cellular studies of an octa-anionic 5, 10, 15, 20-tetra[3,5-(nido-carboranylmethyl)phenyl]porphyrin (H2OCP) for application in BNCT[J]. Bioorganic Med Chem, 2005, 13: 1633–1640
23 Hiramatsu R, Kawabata S, Miyatake S I, et al. Application of a Novel Boronated Porphyrin (H2OCP) as a Dual Sensitizer for Both PDT and BNCT[J]. Lasers Surg Med, 2011, 43: 52–58
24 Gottumukkala V, Ongayi O, Baker D G, et al. Synthesis, cellular uptake and animal toxicity of a tetra (carboranylphenyl)-tetrabenzoporphyrin[J]. Bioorganic Med Chem, 2006, 14: 1871–1879
25 Fabris C, Vicente M G, Hao E H, et al. Tumour-localizing and photosensitizing properties of meso-tetra(4-nidocarboranylphenyl) porphyrin (H2TCP)[J]. J Photochem Photobiol, 2007, 89: 131–138
26 Jori G, Soncin M, Friso E, et al. A novel boronated-porphyrin as a radio-sensitizing agent for boron neutron capture therapy of tumors: In vitro and in vivo studies[J]. Appl Radiat Isot, 2009, 67: S321–S324
27 Friso E, Roncucci G, Dei D, et al. A novel 10B-enriched carboranyl-containing phthalocyanine as a radio- and photo-sensitising agent for boron neutron capture therapy and photodynamic therapy of tumours: in vitro and in vivo studies[J]. Photochem Photobiol Sci, 2006, 5: 39–50
28 Hao E H, Jensen T J, Courtney B H, et al. Synthesis and cellular studies of porphyrin-cobaltacarborane conjugates [J]. Bioconjugate Chem, 2005, 16: 1495–1502
29 Yamamoto T, Matsumura A, Shibata Y, et al. Manganesemetalloporphyrin (ATN-10) as a tumor-localizing agent: magnetic resonance imaging and inductively coupled plasma atomic emission spectroscopy study with experimental brain tumors[J]. Neurosurgery, 1998, 42: 1332–1338
30 Matsumura A, Shibata Y, Yamamoto T, et al. A new boranated porphyrin (STA-BX909) for neutron capture therapy: an in vitro survival assay and in vivo tissue uptake study[J]. Cancer Letters, 1999, 141: 203–209
31 Tsurubuchi T, Yamamoto T, Nakai K, et al. Intracellular uptake of a new boronated porphyrin EC032[J]. Appl Radiat Isot, 2009, 67: S94–S96
32 El-Zaria M E, Ban H S, Nakamura H. Boron-containing protoporphyrin IX derivatives and their modification for boron neutron capture therapy: synthesis, characterization, and comparative in vitro toxicity evaluation[J]. Chem Eur J, 2010, 16: 1543–1552
33 Isaac M F, Kahl S B. Synthesis of ether- and carbon-linked polycarboranyl porphyrindimers for cancer therapies[J]. J Organomet Chem, 2003, 680: 232–243
34 Murashima T, Tsujimoto S, Yamada T, et al. Synthesis of water-soluble porphyrin and the corresponding highly planar benzoporphyrin without meso-substituents[J]. Tetrahedron Lett, 2005, 46(1): 113–116
35 Clark J C, Fronczek F R, Vicente M G, et al. Novel carboranylporphyrins for application in boron neutron capture therapy (BNCT) of tumors[J]. Tetrahedron Lett, 2005, 46(14): 2365–2368
36 Brothers P J. Boron complexes of porphyrins and related polypyrrole ligands: unexpected chemistry for both boron and the porphyrin[J]. Chem Commun, 2008, 18: 2090–2102
37 Bregadze V I, Sivaev I B, Gabel D, et al. Polyhedral boron derivatives of porphyrins and phthalocyanine[J]. J Porphyrins Phthalocyanines, 2001, 5(11): 767–781
38 马金石. 卟啉类第二代光敏剂的发展[J]. 感光科学与光化学, 2002, 20(2): 131–148
MA Jinshi. Development of second generational porphy rinbased photosensitizers[J]. Photogr Sci Photochem, 2002, 20(2): 131–148
