微生态制剂和着色剂对锦鲤体色的影响
2011-03-18张春兰赵文徐立蒲殷守仁魏杰曹欢王静波
张春兰,赵文、2,徐立蒲,殷守仁,魏杰、2,曹欢,王静波
(1.大连海洋大学生命科学与技术学院,辽宁大连116023;2.大连海洋大学辽宁省水生生物学重点实验室,辽宁大连116023; 3.北京市水产技术推广站,北京100012)
微生态制剂和着色剂对锦鲤体色的影响
张春兰1,赵文1、2,徐立蒲3,殷守仁3,魏杰1、2,曹欢3,王静波3
(1.大连海洋大学生命科学与技术学院,辽宁大连116023;2.大连海洋大学辽宁省水生生物学重点实验室,辽宁大连116023; 3.北京市水产技术推广站,北京100012)
以锦鲤Cyprinus carpio皮肤(带鳞片)和尾鳍中的总类胡萝卜素含量作为锦鲤体色的衡量标准,研究了微生态制剂(投喂和泼洒)与着色剂对红色锦鲤幼鱼体色的影响。结果表明:对照组锦鲤皮肤中的总类胡萝卜素含量随饲养时间的延长逐渐增加,并在饲养的第8周达到最大值(38.69 mg/kg±8.64 mg/kg);投喂着色剂和微生态制剂的两组锦鲤皮肤中总类胡萝卜素含量也随投喂时间的延长显著增加(P<0.05),均在第6周达到最大值,分别为(45.78±3.16)mg/kg和(53.91±4.49)mg/kg,在停止投喂着色剂和微生态制剂两周后,该两组锦鲤皮肤中的总类胡萝卜素含量均有所降低,分别为(44.05±4.78)mg/kg和(50.99±5.45)mg/kg;而只投喂微生态制剂的两个试验组和只泼洒微生态制剂的两个试验组锦鲤皮肤中的总类胡萝卜素含量均随饲养时间的延长而逐渐增加,在试验的第8周达到最大值,与对照组表现出相同的规律,且投喂微生态制剂的两个试验组在数值上要略高于对照组,分别为(40.21±5.74)mg/kg和(39.74±4.96)mg/kg,而泼洒微生态制剂的两个试验组与对照组含量相当,分别为(38.31±9.31)mg/kg和(38.34±6.78)mg/kg。这说明微生态制剂无论是作为饲料添加剂投喂或是水体泼洒使用对锦鲤体色的作用都是安全的,并且投喂微生态制剂虽然短时间内对锦鲤体色的影响不明显,但长时间投喂可以在一定程度上起到增色的作用,不会因停止使用而发生褪色的现象。微生态制剂和着色剂对锦鲤尾鳍中总类胡萝卜素含量的影响不明显。
微生态制剂;着色剂;锦鲤;体色;总类胡萝卜素
随着水产养殖业向着绿色、环保、健康的方向发展,抗生素类药物的弊端逐渐被人们所重视,许多国家已经将其中部分抗生素通过立法禁止使用。因此利用有益微生物制成的微生态制剂逐步受到人们的重视。在水产养殖中,微生态制剂与抗生素作为生长促进剂相比,具有显著抗病、促生长以及提高饲料利用率、无毒副作用、无残留等特点,并能补充养殖动物饲料中的营养成分,改善动物胃肠道的微生态平衡[1-2];与抗生素作为水质改良剂相比,利用微生态制剂不仅可以降解和转化有机物,分解残留饵料和动植物残体,减少或消除氨氮、硫化氢、亚硝酸盐等有害物质,改善水质,还可抑制、杀死病原微生物[3-4]。观赏鱼的体色是衡量其品质的一个重要方面。鱼类体色的变化主要是由不同类型的色素颗粒,如类胡萝卜素(红或黄色)、黑色素(黑色)、喋呤(黄色)和鸟嘌呤(白色)等在神经和激素的调控下展现的结果。其中,体色和肉色的红色系色素主要来自类胡萝卜素色群的色素,这是目前研究的主要对象。鱼类自身不能合成类胡萝卜素,只能在消化道中通过水解食物,并将其中的类胡萝卜素吸收、沉淀和转化[5-6]。目前,在饲料中添加着色剂已得到人们的认同[7],这也是改善鱼类体色最有效可行的方法[8-9]。
锦鲤Cyprinus carpio是对鲤突变品系进行选育而成的观赏性鱼类,经济价值很高,并享有“水中活宝石”的美誉。本试验中,作者以锦鲤为研究对象,采取投喂和泼洒两种方式,将微生态制剂和着色剂应用于锦鲤的养殖试验中,并对比配合使用着色剂来研究锦鲤体色的变化情况,旨在论证锦鲤养殖生产中使用微生态制剂的安全性和合理性。
1 材料与方法
1.1 材料
试验用锦鲤幼鱼的体质量为(5.23±0.34)g,通身红色,购于北京鑫淼锦鲤养殖公司。试验前经过2周的暂养驯化。
微生态制剂有:1)世纪生态菌(水产专用,北京世纪万业源生物工程技术有限公司生产),液体型,可拌饵投喂使用,用量为每吨饵料使用1~2 L,也可在水体中直接泼洒,用量为每45~75 L/hm2(水深为1 m);②方便菌(北京普仁生态技术有限公司生产),固体型,可拌饵投喂(使用前需加水稀释活化2~3 d),用量按配合饲料的0.3%添加;③水生态修复剂(北京世纪万业源生物工程技术有限公司生产),有固体型和液体型两种,两者可配合泼洒在水体中,固体型用量为75 kg/hm2,液体型用量为45 kg/hm2。自制饲料有: 1)蛋白质质量分数为35%左右的鲤基础饲料;2)添加质量分数为0.05%的虾青素饲料(德国巴斯夫公司生产,虾青素的质量分数为10%);3)质量分数为10%的螺旋藻精粉饲料。3种饲料的粒径均为2 mm。各饲料配方和主要营养成分见表1。
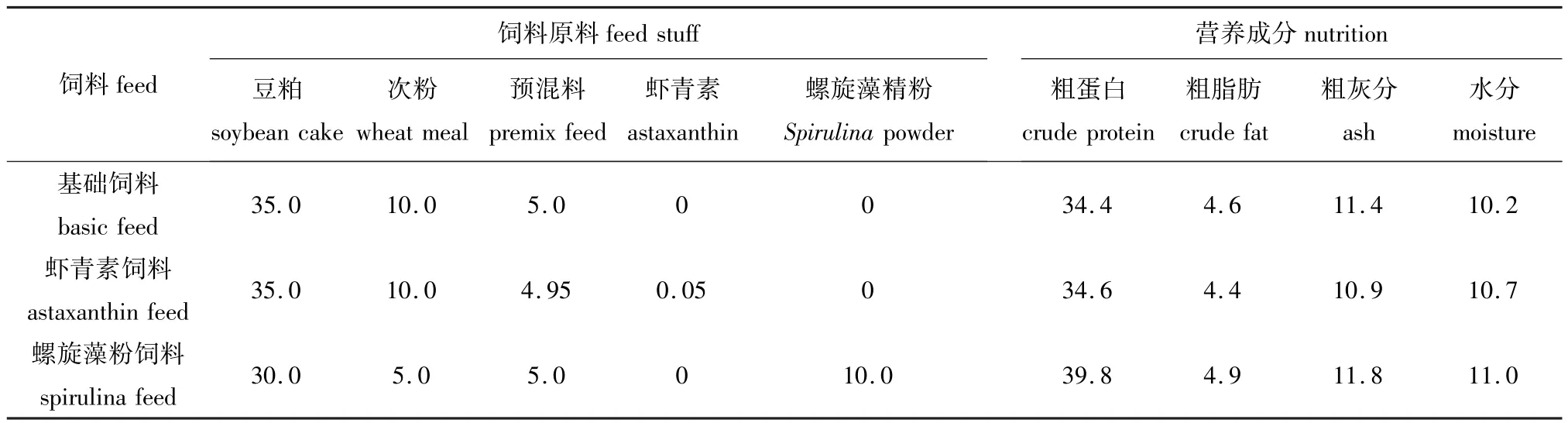
表1 3种饲料的配方和主要营养成分Tab.1 Ingredients and main nutrient composition of the three feedsw/%
1.2 方法
1.2.1 试验设置 共设6个试验组和1个对照组:1)对照组,只投喂基础饲料;2)投喂世纪生态菌组,即投喂添加世纪生态菌的基础饲料; 3)投喂虾青素和世纪生态菌组,即投喂添加世纪生态菌的虾青素饲料;4)投喂螺旋藻粉和世纪生态菌组,即投喂添加世纪生态菌的螺旋藻粉饲料; 5)投喂方便菌组,即投喂添加方便菌的基础饲料;6)泼洒世纪生态菌组,即投喂基础饲料且在水体中泼洒世纪生态菌;7)泼洒水生态修复剂组,即投喂基础饲料且在水体中泼洒水生态修复剂。每组设3个重复。
试验在大连海洋大学水生生态试验室内进行。以90 L的蓝色水槽为饲养容器,24 h连续充气,静水饲养。试验用水为曝气24 h以上的自来水,水质符合国家生活饮用水卫生标准(GB 5749-2006)。每个水槽放养锦鲤幼鱼20尾,日投饲率为3%,投喂时间分别为9:00、13:00和19:00,投饵后1 h吸出残饵。每周换水1次,每次换水量为1/3~1/2,并补充相应剂量的微生态制剂。试验共进行8周,前6周使用微生态制剂和着色剂,每隔2周取样测定1次鱼体色素含量;后2周停用微生态制剂和着色剂,试验结束时再次测定鱼体色素含量。
1.2.2 色素的提取、测定及计算 色素含量以锦鲤幼鱼皮肤(带鳞片)和尾鳍中的总类胡萝卜素含量为衡量标准。测定前,每组随机选取锦鲤幼鱼2尾,放在吸水纸上晾干(2 h左右),然后分别取侧线上方的皮肤(带鳞片)和整个尾鳍,剪碎,做成皮肤混合样本和尾鳍混合样本。称取小于0.200 g样本,并与0.01 g无水硫酸钠一同放入匀浆器中研磨3次,每次加入丙酮2 mL,研磨30 s。将提取液收集于离心管中,定容至5 mL,于冰箱(4℃)中放置16~24 h[10]。测定时,以4 000 r/min离心10 min,取上层萃取液,以丙酮为空白对照,用紫外可见分光光度计在460 nm波长下测定各组提取液的吸光值[11]。总类胡萝卜素含量(mg/kg)的计算公式[7]如下:

其中:A为吸光值;K为常数(104);V为提取液体积(mL);E为吸光系数(2 500);G为样品的质量(g)。
1.3 统计分析
用SPSS 16.0软件对试验数据进行统计分析,用双因素方差分析(Two-Way ANOVA Analysis)法分析数据的差异性,当差异显著时(P<0.05),再用最小显著差数法(LSD)进行多重比较。
2 结果
2.1 锦鲤皮肤中总类胡萝卜素的含量
从表2可见:饲养时间对锦鲤皮肤中总类胡萝卜素含量的影响显著(P<0.05),各微生态制剂和着色剂组间差异也显著(P<0.05),但两者之间的交互作用并不显著(P>0.05)。随着饲养时间的延长,对照组锦鲤皮肤中的总类胡萝卜素含量逐渐增加,并在饲养的第8周达到最大值(38.69 mg/kg± 8.64 mg/kg),但整个试验期间的差异并不显著(P>0.05)。投喂着色剂和微生态制剂的两个试验组总类胡萝卜素含量随投喂时间的延长显著增加(P<0.05),均在第6周达到最大值,投喂虾青素和世纪生态菌组为(45.78±3.16)mg/kg,投喂螺旋藻粉和世纪生态菌组为(53.91±4.49)mg/kg;停止投喂着2周后,即试验的第8周,这两组的总类胡萝卜素含量均有所降低,分别为(44.05± 4.78)mg/kg和(50.99±5.45)mg/kg。只投喂微生态制剂的两组和只泼洒微生态制剂的两组锦鲤皮肤中总类胡萝卜素含量均随饲养时间的延长而逐渐增加,在试验的第8周达到最大值,与对照组表现出相同的规律,且无显著差异(P>0.05),但投喂微生态制剂的试验组在数值上要略高于对照组,而泼洒微生态制剂组的总类胡萝卜素含量与对照组含量相当。

表2 锦鲤皮肤和尾鳍中总类胡萝卜素的含量Tab.2 Total carotenoid contents in the skin,and caudal fin of the brocade carpmg/kg
2.2 锦鲤尾鳍中总类胡萝卜素的含量
从表2可见:饲养时间对锦鲤尾鳍中总类胡萝卜素含量的影响显著(P<0.05),各微生态制剂和着色剂组间差异也显著(P<0.05),但两者之间的交互作用并不显著(P>0.05)。各试验组锦鲤尾鳍中总类胡萝卜素的含量表现出的规律性不明显,只有投喂虾青素和世纪生态菌组与投喂螺旋藻粉和世纪生态菌组,尾鳍中的总类胡萝卜素含量随饲养时间的延长显著增加(P<0.05)。
3 讨论
体色是鱼类逃避敌害、进行信息交流和生理调节的重要手段,同时也是观赏鱼类和某些食用鱼类重要的质量指标。人们对如何改善鱼类体色进行了长期的研究,包括鱼类体色改变的原理以及利用饵料增色剂、雌核发育、性别控制、转基因等生物工程技术方法改善观赏鱼的体色等[12]。鱼类体色和肉色的红色系色素主要来自类胡萝卜素色群的色素。类胡萝卜素在水产动物中的主要生理功能有着色、抗紫外辐射、作为维生素A的前体物质、增强对高氨和低氧的耐受性、促进生长和成熟、改善卵质、作为抗氧化剂和脂质过氧化的抑制剂等[13]。
本试验中发现,对照组锦鲤皮肤中的总类胡萝卜素含量随着时间的延长而逐渐增加,说明处于这一生长阶段的红色锦鲤幼鱼本身正处在体色不断积累的过程中。投喂添加着色剂饲料的两个试验组,即投喂虾青素和世纪生态菌组与投喂螺旋藻粉和世纪生态菌组,在试验前6周锦鲤皮肤中的总类胡萝卜素含量显著增加,并随投喂时间的延长呈逐渐积累的趋势,但在停止投喂微生态制剂和着色剂两周后(试验的第8周),两个试验组锦鲤幼鱼皮肤中的总类胡萝卜素含量明显降低。这说明着色剂(如虾青素和螺旋藻粉)可以使锦鲤在投喂期间迅速增色,但停止投喂后体色也会发生褪色。研究表明,鱼体本身不能合成类胡萝卜素,只能从食物中吸收、沉淀和转化这些色素[5-6]。在饲料中添加虾青素和螺旋藻粉,可以对鱼类起到增色的作用,而目前观赏鱼类饲料中经常添加的着色剂,还对鱼类的生长有一定的促进作用[13-16]。一般来说,着色效果与饲料中着色剂的添加量呈正相关,但着色效果不会无限的增强。当类胡萝卜素含量达到一定浓度后,鱼肠道中对着色剂的吸收会处于一个动态平衡当中,此时鱼体中的色素含量将不会再增加,停止使用后又会因类胡萝卜素的迅速分解而使鱼体褪色[16]。另外,着色剂(如虾青素和螺旋藻粉)的价格十分昂贵,大量使用势必会增加养殖成本。鱼类对着色剂的吸收和沉淀需要时间的积累,虽然增加添加着色剂的浓度可缩短色素达到饱和的时间,但着色剂的利用率往往会降低。在用合成的角黄素对真鲷作用的试验中发现,虾青素对真鲷有全面微红的着色作用,但在试验的第75天与第105天并无显著差异,且在第105天时有所下降[17]。
影响鱼类体色的因素主要有内在因素和外界因素。内在因素包括鱼类本身的遗传因素、年龄、大小、健康状况以及神经内分泌等。从根本上说,鱼的体色是受遗传因素控制的。外界因素如水质、养殖密度、饵料中类胡萝卜素的含量以及激光照射等对鱼体着色也有一定的影响[12]。只投喂微生态制剂的两个试验组和只泼洒微生态制剂的两个试验组,锦鲤总类胡萝卜素含量均随饲养时间的延长而逐渐增加,在试验第8周达到最大值,与对照组表现出相同的规律,但投喂微生态制剂的试验组在数值上要略高于对照组,而泼洒微生态制剂组的总类胡萝卜素含量与对照组含量相当。这说明微生态制剂作为饲料添加剂投喂使用,虽然短时间内对锦鲤体色的影响不明显,但长时间使用可以在一定程度上起到增色的作用,并且不会因停止使用而发生褪色的现象。这可能是由于微生态制剂改善了锦鲤肠道的微生态平衡,使锦鲤能更好地消化吸收饲料中的营养物质和类胡萝卜素,因而锦鲤的体色更加光鲜。很多试验表明,在饲料中添加微生态制剂不仅对养殖动物的生长、消化、免疫有促进作用,还可以降低饵料系数,节省养殖成本[18-19]。在水体中泼洒微生态制剂的主要作用为调节水质,对锦鲤体色的影响不大,即使长时间使用也不会使锦鲤增色或褪色。但微生态制剂无论是作为饲料添加剂投喂或是水体中泼洒,对锦鲤体色的作用都是安全的。
锦鲤尾鳍中总类胡萝卜素含量表现出的规律性较弱,数据出现反复性,只有投喂添加着色剂饲料的两个试验组表现出随饲养时间的延长显著增加的趋势,并且在停止使用后明显降低。这可能是由于鱼鳍中对类胡萝卜素的积累能力个体间的差异很大。另外,对照组、两个投喂微生态制剂试验组和两个泼洒微生态制剂试验组锦鲤尾鳍颜色积累随时间的变化幅度较小,所以数据的规律性不强;而投喂添加着色剂饲料的两个试验组总类胡萝卜素含量随时间的变化较大,可以看出明显的规律。因此,试验中锦鲤尾鳍中的总类胡萝卜素含量仅作为本试验结论的补充。
[1] 何明清.我国动物微生态制剂的起源、发展战略及应用前景[J].中国微生态学杂志,2001,13(3):166-167.
[2] 谢凤行,赵玉洁.几种微生态制剂在水产养殖中的研究进展和展望[J].天津农业科学,2006,12(4):18-21.
[3] Thimmalapura N D,Fmmah M Y,Mohamed S.Changes in bacterial populations and shrimp production in ponds treated with commercial microbial products[J].Aquaculture,206:245-256.
[4] 马江耀,石河荣,柯浩.三种微生态制剂对鱼池水质净化作用的对比试验[J].水产科技情报,2003,30(6):13-15.
[5] Hardy R W.Absorption and distribution of C-labeled canthaxanthin in rainbow trou[J].Aquaculture,1990,87:331-340.
[6] Hata M.Carotenoid pigments in rainbow trout,Salmo gairdneri irideus[J].Agric Res,1975,26:35-40.
[7] 惠伯棣.类胡萝卜素化学及生物化学[M].北京:中国轻工业出版社,2005.
[8] 魏东,卢国占,王春杰.观赏鱼着色剂的种类和应用[J].中国水产,2009(3):60-62.
[9] 沈志刚.养殖鱼类体色改良研究进展[J].齐鲁渔业,2009,26 (10):55-57.
[10] 陈晓明,徐学明,金征宇.富含虾青素的法夫酵母对金鱼体色的影响[J].中国水产科学,2004,11(1):70-73.
[11] 韩学哲.饵料中不同添加物对观赏鱼体色的影响[D].石家庄:河北大学,2001.
[12] 王旭霞,邵力.观赏鱼体色的研究现状[J].水利渔业,2008, 28(2):57-59.
[13] 冷向军,李小勤.水产动物着色的研究进展[J].水产学报, 2006,30(1):138-143.
[14] 何培民,张饮江,何文辉.螺旋藻对锦鲤生长和体色的影响[J].水产学报,1999,23(2):162-168.
[15] Ingle G,Arredondo J L,Ponce J T,et al.Comparison of red chilli (Capsicum annuum)oleoresin and astaxanthin on rainbow trout (Oncorhynchus mykiss)fillet pigmentation[J].Aquaculture, 2006,258:487-495.
[16] 高前欣.水产动物中类胡萝卜素的生理功能[J].中国饲料, 2005(11):29-34.
[17] Kslinowski C T,Robaina L E,Fernandez-Palacios H,et al.Effect of different carotenoid sources and their dietary levels on red porgy (Pagyus pagrus)growth and skin color[J].Aquaculture,2005, 244:223-239.
[18] 杜宣,周国勤,茆健强.3种微生态制剂的氨基酸组成及对鲤鱼消化酶活性的影响[J].云南农业大学学报,2006,21(3): 351-354.
[19] 刘文斌,尹君,方星星,等.3种益生素配伍对异育银鲫(Carassius auratus gibelio)生长、消化及肠道菌群组成的影响[J].海洋与湖沼,2007,38(1):30-34.
Effects of probiotics and coloring agents on body color of koi carp Cyprinus carpio
ZHANG Chun-lan1,ZHAO Wen1,2,XU Li-pu3,YIN Shou-ren3, WEI Jie1,2,CAO Huan3,WANG Jing-bo3
(1.College of Life Science and Technology,Dalian Ocean University,Dalian 116023,China;2.Key Laboratory of Hydrobiology in Liaoning Province,Dalian Ocean University,Dalian 116023,China;3.Beijing Fisheries Technology Promotion Station,Beijing 100012,China)
The effects of probiotics and coloring agents on body color shown by carotenoid contents in the skin (with scales)and the caudal fin were studied in koi carp Cyprinus carpio fingerlings.The results showed that the total carotenoid contents in the skin in the control group were increased as the extension of the feeding time,a maximum value of(38.69±8.64)mg/kg in the 8th week.In the two cases of feeding coloring agents and probiotics, the total carotenoid contents in the skin were found to be increased significantly as the feeding time extended(P<0.05),the maximum values of(45.78±3.16)mg/kg and(53.91±4.49)mg/kg in the 6th week.However,the total carotenoid contents were found to be decreased in both the test group and the control group,with the equilibrium values of(44.05±4.78)mg/kg and(50.99±5.45)mg/kg,when the dietary probiotics and coloring agents were unfed.It is turned out that coloring agents such as astaxanthin and spirulina powder can greatly increase the body color of the koi carp.In the two cases of feeding probiotics,the total carotenoid contents were increased in the skin until the 8th week with the maximum values of(40.21±5.74)mg/kg and(39.74±4.96)mg/kg,respectively,much more than the values in the control group.In the two cases of supplementation of probiotics,the fish followed the same trends with the maximum values of(38.31±9.31)mg/kg and(38.34±6.78)mg/kg,similar to the values in the control group,indicating that the probiotics,and increases the body color in the long term,without the fading color when the feeding is stopped,even though little effect on the body color in the short term.
probiotics;coloring agent;koi carp;body color;total carotenoid level
S965.8
A
2095-1388(2011)04-0328-05
2010-09-18
北京市农委重点项目(20080601)
张春兰(1985-),女,硕士研究生。
赵文(1963-),男,博士,教授。E-mail:zhaowen@dlou.edu.cn
