经前平颗粒对经前期综合征肝气逆证模型大鼠不同脑区孕酮受体表达的影响
2011-03-17巢玉彬张惠云
巢玉彬,张惠云
(山东中医药大学中医药经典理论教育部重点实验室,山东济南 250355)
肝气逆证是经前期综合征(PMS)的一个亚型,以烦躁易怒等情绪异常为主要临床表现。笔者前期研究发现PMS肝气逆证发病与体内性激素周期性变化失调有关[1],动物实验结果证实肝气逆证大鼠下丘脑孕酮受体(PR)的活性下降[2]。为进一步明确PR在PMS发病中的作用机制,探讨经前平颗粒中枢内的作用靶点,本研究采用免疫荧光技术结合流式细胞仪、激光共聚焦显微镜研究了经前平颗粒对PMS肝气逆证模型大鼠下丘脑和顶区皮质中孕酮受体(PR)表达水平、组织内定位分布模式的影响。
1 材料与方法
1.1 动 物
雌性未孕SPF级SD大鼠30只,体质量180~ 220 g,由山东中医药大学实验动物中心提供,动物质量许可证号:SCXK(鲁)20050015。
1.2 药品与仪器
免疫荧光试剂盒(一抗为兔抗鼠PR多克隆抗体,二抗为山羊抗兔IgG-FITC,正常山羊封闭血清), Santa Cruz公司产品;L-多聚赖氨酸,上海创赛科学仪器有限公司产品;经前平颗粒,批号 040216,江苏扬子江药业生产;ST-A型数字脉冲生物刺激仪,山东中医药大学与济南军区空军司令通信修配厂联合研制;CT15RT台式高速冷冻离心机,上海天美科学仪器有限公司产品;激光流式细胞仪(FCM,BD FACS Calibur 420),激光共聚焦显微镜(LSCM,Zeiss LSM 510),转轮式切片机(LEICA RM 2015)。
1.3 模型的建立与检测方法
1.3.1 受试大鼠筛选
实验开始前动物预适应环境 1周,大鼠饲养于昼夜颠倒环境,每天21:00开灯,9:00关灯。预适应结束后,采用旷场实验筛选得分相近大鼠进入实验。旷场实验方法,见 1.3.4。
1.3.2 大鼠动情周期确定
采用阴道涂片镜检法确定正常未孕大鼠的动情期[3]。具体步骤如下:用滴管吸取少量生理盐水滴于大鼠阴道反复吸取 2~3次,将吸出液涂于载玻片上,使其自然风干。用无水乙醇固定2~5min,用吉姆萨染液充分附着10~30 min,冲洗,干燥,40倍显微镜下镜检。各期细胞形态见表 1。
同时大鼠动情周期评定辅助采用宏观行为药理学观察方法[4]:将雌鼠引入雄鼠笼中,观察大鼠动情行为(跳跃,奔走,摇耳,弓背,雄鼠击打雌鼠背部)确定大鼠动情周期,同时阻止雄鼠爬跨雌鼠。大鼠动情前期/动情期(即动情周期接受期)动情行为活跃,而动情间期/动情后期(即动情周期非接受期)动情行为减退或消失,中间间隔约2 d左右。最后选取旷场得分相近、动情行为规则出现且活跃、处于动情周期非接受期的大鼠纳入本实验。

表1 大鼠动情周期卵巢变化及阴道涂片的组织学变化
1.3.3 分组与给药
取处于动情周期非接受期大鼠 30只,随机分为正常对照组、PMS肝气逆证模型对照组、经前平颗粒组,每组 10只。正常对照组正常饲养,其他两组采用电刺激法复制PMS肝气逆证大鼠模型[5]:大鼠置入可调式激惹、噪音、脉冲电刺激笼内,设置脉冲电压2 700~3 300 V,中等强度电流0.5 mA,脉宽0.3 s,间隔时间白天5 min,夜晚10min,连续造模5 d。经前平颗粒组大鼠在造模同时给予经前平颗粒灌胃给药,剂量10 g/kg,给药体积10μL/g,相当于人体临床8倍剂量;PMS肝气逆证模型对照组和正常对照组给予等体积的生理盐水,每日9:00给药,每日1次,连续给药5 d。
1.3.4 旷场实验方法[6]
100 cm×100 cm×50 cm旷场实验箱,周壁底面为黑色,底面用白线划分为面积相等的 25块,沿墙的格称为外周格,其余称为中央格。操作者握住大鼠尾根部 1/3处,小心放入旷场正中格,用摄像系统记录动物3min的行为变化。记录得分值。①水平得分:动物穿越底面方块数为水平活动得分(4爪均进入的方格方可记数,为水平运动得分)。②垂直得分:直立次数为垂直活动得分(两前爪腾空或攀附墙壁,为垂直运动得分)。旷场实验总分=①+②。实验前动物筛选和造模后模型评价各进行 1次测定。
1.3.5 免疫荧光结合流式细胞仪检测
末次给药后,大鼠迅速断头,剥离下丘脑、顶区皮质,冰上匀浆。冷生理盐水悬浮,1 200 r/min离心洗涤8min,弃上清液,过300目筛。沉淀加入0.25%多聚甲醛溶液室温固定1 h,后0.01 M PBS离心清洗,弃上清液。沉淀加入70%甲醇溶液4℃固定1 h,离心,弃上清液,PBS悬浮离心清洗1次。上述细胞悬液加一抗(1∶200)及0.1%Triton X-100 4℃过夜, PBS悬浮离心洗涤2次。二抗室温孵育30 min,PBS洗涤 3次。冷生理盐水定容,过 300目筛。用流式细胞仪检测,Cellquest软件处理数据和图像。
1.3.6 免疫荧光结合激光共聚焦显微镜检测
大鼠断头后,取下丘脑和顶区皮质,4%多聚甲醛固定,系列酒精脱水,二甲苯透明,常规石蜡包埋。切片厚度 5μm,铺有多聚赖氨酸的玻片展片。石蜡切片脱蜡,山羊血清封闭,一抗4℃过夜,0.1M PBS (pH 7.4)冲洗。二抗37℃孵育20min,0.1 M PBS (pH 7.4)冲洗,Zeiss LSM 510激光共聚焦显微镜检测,Zeiss LSM 510 Image Exam iner图像分析软件半定量分析相对荧光强度,受体表达量以相对荧光强度表示。
1.3.7 统计学方法
采用SPSS 17.0统计分析软件处理。计量资料数据以均数(BZ_139_2138_999_2156_1045)±标准差(s)表示,多组比较采用单因素方差分析,检验水准α=0.05,以P<0.05为差别有统计学意义。
2 结 果
2.1 造模结果
2.1.1 行为学观察
与对照组比较,模型组大鼠活动量大,对外界刺激敏感,用电笔较易激惹,出现精神紧张、相互对峙、怒目而视、毛竖立、相互追逐及撕咬等现象;而给予经前平颗粒预防治疗组,大鼠变化不明显。
2.1.2 旷场实验得分对比
旷场实验水平得分反映动物的兴奋性,垂直得分反映动物对环境的适应程度,旷场实验总分是动物探索行为及兴奋性的总体反映。结果表明,较正常对照组大鼠,模型对照组大鼠水平得分、垂直得分及旷场总分均增加,垂直得分差别有统计学意义(P<0.05),说明此组大鼠活动兴奋性及认知能力均有显著性升高,结合宏观行为学观察初步判定模型制备成功;较模型对照组大鼠,经前平颗粒组大鼠水平得分、垂直得分及旷场总分均显著减少(P<0.01,P<0.05),说明经前平颗粒对PMS肝气逆证模型大鼠有明显预防治疗作用。见表 2。
表2 各组大鼠旷场实验得分比较 分,±s
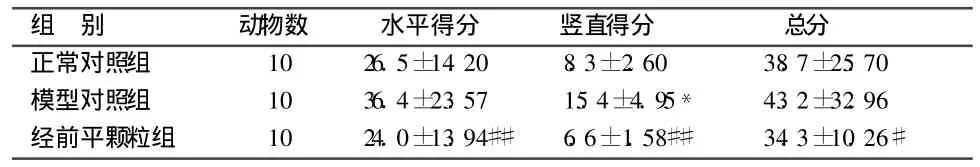
表2 各组大鼠旷场实验得分比较 分,±s
注:与正常对照组对比,*P<0.05;与模型对照组对比,#P<0.05,##P<0.01。
组 别 动物数 水平得分 竖直得分 总分正常对照组 10 26.5±14.20 8.3±2.60 38.7±25.70模型对照组 10 36.4±23.57 15.4±4.95* 43.2±32.96经前平颗粒组 10 24.0±13.94## 6.6±1.58## 34.3±10.26#
2.2 流式细胞仪检测结果
见图 1,2和表 3。由图可以看出:与正常对照组大鼠相比,模型对照大鼠下丘脑和顶区皮质中 PR蛋白均显著降低(P<0.05),经前平颗粒组大鼠下丘脑和顶区皮质PR蛋白表达量较模型对照组均显著升高(P<0.01,P<0.05),恢复至正常水平。

表3 流式细胞仪检测定量统计结果比较分,±s
注:与正常对照组对比,*P<0.05;与模型对照组对比,#P<0.05,##P<0.01。
组 别 动物数 下丘脑 顶区皮质正常对照组 10 18.5±2.42 13.3±1.69模型对照组 10 15.5±2.63* 11.2±1.60*经前平颗粒组 10 19.5±2.94## 13.6±1.58#
2.3 激光共聚焦显微镜定位表达检测结果
由图 3,4可以看出:模型对照组大鼠下丘脑和顶区皮质神经元PR蛋白表达的阳性细胞数显著少于正常对照组,阳性细胞内荧光减弱。与模型对照组相比,经前平颗粒组大鼠相同脑组织中 PR阳性细胞数增加明显,阳性神经元中荧光强度也明显回升。荧光强度定量分析证实,与正常对照组相比,模型对照组大鼠下丘脑神经元PR蛋白表达的阳性细胞数下降(P<0.01),见表 4。在下丘脑和顶区皮质中,正常对照组大鼠PR的阳性细胞弥散分布,而模型对照组大鼠阳性细胞少而且趋向于边缘,经前平颗粒组大鼠细胞分布模式则趋于正常,见图 3、图 4。结果表明,与正常对照组相比,模型对照组和经前平颗粒组大鼠下丘脑PR阳性神经细胞分布模式均发生不同程度变化。
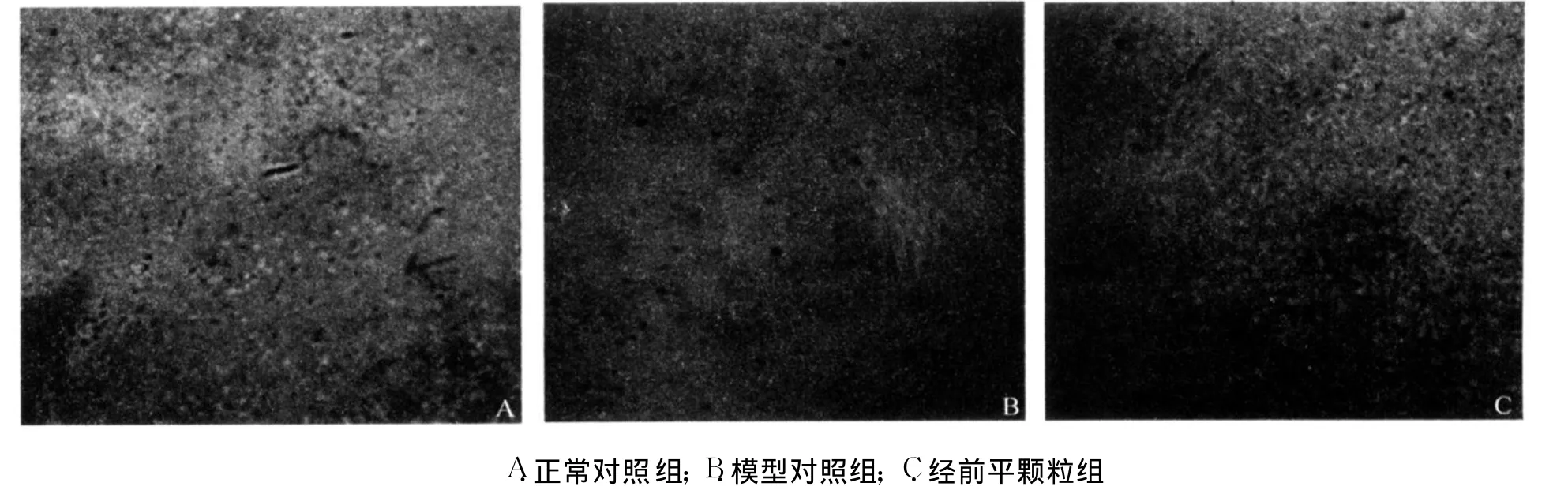
图3 大鼠下丘脑PR定位分布免疫荧光照片 (荧光染色,×200)

图4 大鼠顶区皮质PR定位分布免疫荧光照片 (荧光染色,×200)
表4 各组大鼠下丘脑、顶区皮质相对荧光强度对比 分,±s

表4 各组大鼠下丘脑、顶区皮质相对荧光强度对比 分,±s
注:与正常对照组比较,**P<0.01。
组 别 动物数 下丘脑 顶区皮质正常对照组 10 1 153.7±58.78 584.3±45.16模型对照组 10 1 020.4±84.37** 552.8±37.14经前平颗粒组 10 1 082.2±94.62 558.9±30.41
3 讨 论
PMS发病机制复杂,可能是多因素作用的结果,具体病因尚不清楚[7]。不过已有证据显示,PMS躯体和心理症状与精神因素、体液潴留、催乳素(PRL)排出增多、雌激素/孕激素(P)比例失常及β-内啡肽、5-羟色胺(5-HT)、γ-氨基丁酸(GABA)、肾上腺素(E)能神经系统等有关[8]。体内孕酮的变化不仅可以影响下丘脑体温调节中枢[9],还与调节情绪和行为的5-HT能、NE能、GABA能系统及单胺氧化酶密切相关[10-12]。孕酮发挥调节情绪和行为的作用要通过孕酮受体介导,其中枢内受体结合位点分布于视前区、室旁核、下丘脑前部、腹内侧核、弓状核和正中隆起,另外内侧基底下丘脑也包含重要的孕酮受体神经元[13]。Wolfe CA等[14]研究结果表明,PR在大鼠下丘脑和边缘叶的表达量及分布模式不仅具有性别差异,而且随月经周期变化而变化。
经前平颗粒主要有白芍、香附、川楝子(炒)、柴胡、川芎、枳壳、豆蔻、半夏(姜制)、木香、甘草组成,专为治疗经前期紧张综合征肝气逆证而研制,具有平肝理气、除胀止痛,佐以和胃之功效。临床研究证明,经前平颗粒治疗PMS可能与调节患者血清/尿液E2、P、PRL、5-HT、E和NE紊乱有关[15-16];实验研究显示,除前述递质和激素外,经前平颗粒还可调控受试动物血清一氧化氮(NO)及超氧化物歧化酶(SOD)等[17-19],对中枢 5-HT、DA等单胺类神经递质[20]、内吗啡肽[21]和雌激素受体[22]等与 PMS密切相关物质的失调也具有显著纠正作用,但对中枢 PR与PMS肝气逆证关系的研究和报道则相对欠缺。
本实验采用电刺激造模方法复制PMS肝气逆证动物模型,旷场实验结果结合宏观行为学观察初步判定模型制备是成功的;免疫荧光技术结合流式细胞仪、激光共聚焦显微镜研究证实经前平颗粒能够显著上调 PMS肝气逆证大鼠下丘脑和顶区皮质PR表达水平,恢复其中 PR阳性细胞正常分布模式的趋势明显。上述发现表明,PMS肝气逆证发病与中枢PR密切相关,下丘脑和顶区皮质中PR可能是经前平颗粒的重要作用靶位,这也为进一步研究该病证中枢发病机制及新药研发提供了部分依据。
[1]魏霞,张惠云,乔明琦.经前平颗粒对经前期综合征肝气逆证患者血清 E2、P峰值的影响[J].山东中医药大学学报,2006,30(3):198-200.
[2]马月香,乔明琦,张惠云.大鼠模拟经前期综合征肝气逆证不同脑区E2受体、P受体基因表达mRNA水平变化[J].世界科学技术:中医药现代化,2008,10(1):68-71.
[3]陈奇.中药药理研究方法学[M].北京:人民卫生出版社,1993:83.
[4]Hoi-Por Ho,Marie Olsson,Lars Westberg,et al.The serotonine Reuptake Inhibitor Fluoxetine Reduces Sex Steriod-Related Aggresson in Female Rats:An animalModelof p remenstrual Irritability?[J].Neuropsychopharmacology,2001,24 (5):502-510.
[5]魏盛.经前期综合征肝气逆、肝气郁证动物模型改进及肝失疏泄微观机制研究[J].山东中医药大学学报, 2007,31(5):125.
[6]刘晓伟,张红梅,曲宏达,等.“怒伤气”大鼠行为观察与检测[J].江苏中医药,2005,26(3):53-55.
[7]LoriM Dickerson,Pamela JMazyck,Melissa H Hunter.Premenstrual Syndrome[J].American fam ily physiclan,2003, 67(8):1743.
[8]乔明琦,张惠云.中医情致学[M].北京,人民卫生出版社,2009:326-328.
[9]Barton D,Loprinzi C,Wahner-Roedler D.Hot flashes:aetiologyand management[J].Drugs Aging,2001,18:597-606.
[10]Berendsen HHG.The role of serotonin in hot flushes[J]. Maturitas,2000,36:155-164.
[11]Kaura V,Ingram CD,Gartside SE,et al.The progesterone metabolite allopregnanolone potentiates GABA(A) receptor-mediated inhibition of 5-HT neuronalactivity[J]. Eur Neuropsychopharmacol,2007,17:108-115.
[12]Gundlah C,Lu NZ,Bethea CL.Ovarian steroid regu lation ofmonoam ine oxidase-A and-BmRNAs in themacaque dorsal raphe and hypothalamic nuclei[J].Psychopharmacology,2002,160:271-282.
[13]B Liu,L A Arbogast.Gene Expression Profiles of Intracellular and Membrane Progesterone Recep tor Isoforms in the Mediobasal Hypothalamus during Pro-oestrus[J].Neuroendocrinol,2009,21(12):993-1000.
[14]Wolfe CA,Van Doren M,Walker HJ,etal.Sex differences in the location of immunochemically defined cell populations in the mouse p reoptic area/anterior hypothalamus[J].Brain Res Dev Brain Res,2005,157(1):34-41.
[15]孙晓玲,许丽绵,罗颂平,等.经前平颗粒对经前期综合征肝气逆证患者的神经内分泌调节[J].时珍国医国药,2010,21(4):840-842.
[16]乔明琦,张惠云,高冬梅.经前平颗粒对经前期综合征肝气逆证患者尿中神经递质变化的影响[J].辽宁中医杂志,2007,34(3):257-259.
[17]张惠云,乔明琦,朱武成,等.大鼠模拟经前期综合征肝气逆证血清激素与行为变化[J].中成药,2002,24(2): 118-119.
[18]郑春梅,张惠云.大鼠血清中单胺类递质的高效液相色谱—荧光检测法分析[J].药物分析杂志,2006,26 (2):215-217.
[19]周继发,朱萱萱,顾和亚,等.经前平颗粒对老龄和去势大鼠激素水平的实验研究[J].实用中医内科杂志, 2008,22(5):67-69.
[20]徐明婧,张惠云.经前平颗粒治疗经前期综合征肝气逆证大鼠的作用机制[J].药学与临床研究,2010,18(2): 152-155.
[21]马晶,张惠云.经前期综合征模型大鼠下丘脑和外周血内吗啡肽含量变化的实验研究[J].药学与临床研究, 2008,16(5):343-346.
[22]耿燕楠,张惠云.经前期综合征肝气逆证模型大鼠脑雌激素α受体蛋白水平的表达[J].中药新药与临床药理,2010,21(5):490-492.
