肝复康对HSC-T6细胞Wnt信号转导通路调节作用的观察*
2011-03-15张彩华姜妙娜袁丽君李寒姝赵赫男贾玉杰
张彩华 姜妙娜 袁丽君 李寒姝 赵赫男 李 骢 贾玉杰
Wnt信号转导通路是一条在生物进化过程中高度保守的通路,在调控胚胎发育以及细胞的黏附、增殖、分化和凋亡等过程中发挥重要的作用[1,2]。近年来,Wnt信号转导通路的异常已成为肿瘤以及其他一些疾病的研究热点[3,4]。有研究表明,Wnt信号通路与肺、肝和肾纤维化的形成密切相关[5,6]。肝复康是本室发现的抗纤维化经验方[7,8]。本实验将首次通过测定肝星状细胞经典Wnt信号转导通路中的关键调节因子Wnt1、糖原合成激酶3β(glycogen synthase kinase-3β,GSK-3β)、β-链蛋白(β-catenin)、细胞周期蛋白D1(cyclin D1)以及 α-平滑肌动蛋白(α-smooth muscle actin,α-SMA)等基因表达,以进一步揭示肝复康抗肝纤维化的分子调节机制。
材料与方法
一、肝星状细胞系 大鼠肝星状细胞株(HSCT6)由上海中医药大学肝病研究所徐列明教授惠赠,表型为活化的HSCs。在含体积分数10%胎牛血清(天津灏洋生物公司)、含青链霉素各100U/ml的DMEM(高糖)培养基(Hyclone公司)、37℃、CO2体积分数5%、饱和湿度的条件下培养HSC-T6细胞,用0.25%胰酶消化传代。
二、药物的制备 肝复康由柴胡、当归、黄芪、赤芍、白芍、丹参等组成。其无菌原液由本校中西医结合研究所按既定的工艺制备(1.95g/ml)。
三、含药血清的制备 清洁级SD大鼠20只,雌雄各半,体重300~350g。随机分为正常对照组和肝复康组,各10只。将肝复康按4.16ml/只分别给大鼠灌胃7次,每次间隔24小时,第7次灌胃前12小时禁食,在灌胃后1小时以苯巴比妥钠腹腔注射麻醉,在无菌条件下行下腔静脉取血约10ml,在4℃ 3000r/min离心10min,血清用0.22μm滤器过滤,即为药物血清;对照组动物以生理盐水代替药物灌胃。所有血清均经56℃、30min灭活,置-80℃冰箱中保存备用。
四、HSC干预实验 将传代培养的HSC按常规方法(105/cm)接种于6孔板中,用含10%胎牛血清的DMEM培养液培养,次日换液,以后每2~3天换液一次。待细胞近铺满孔底(>80%)时,换无血清的DMEM培养24小时,吸弃上清,而后分为3组:即空白对照组:加10%正常对照血清的DMEM;模型组:加10%正常对照血清+乙醛(终浓度150μm/L);肝复康组:加10%肝复康中剂量药物血清+乙醛(终浓度150μm/L),培养24小时,再分别收集细胞。
五、Western-Blot检测 β-catenin和 α-SMA表达 小鼠抗β-catenin单克隆抗体(工作浓度1:200)购自Santa公司;兔抗α-SMA多克隆抗体(工作浓度1:200)购自北京博奥森生物技术有限公司。细胞总蛋白的提取参照文献[9],考马斯亮蓝法测定其浓度。取25μg蛋白上样,进行SDS-PAGE,分别用5%浓缩胶、10%和12%的分离胶电泳,使用Tris-甘氨酸电泳缓冲液、电压20mA、PVDF膜进行半干式电转,转膜时间分别为1小时和30分钟。将膜放入封闭液(5%脱脂奶粉)中封闭3小时,加入一抗4℃过夜,TBST漂洗10min×3,分别加入二抗-辣根过氧化物酶标记的羊抗小鼠 IgG(1∶2000)和羊抗兔 IgG(1∶3000),37℃孵育1h,TBST漂洗10min×3。采用化学发光法进行显色反应,重复3次,结果用光密度扫描仪记录,并进行统计分析。
六、RT-PCR 法检测 Wnt1、GSK-3β、β-catenin、cyclin D1和α-SMA mRNA水平 使用TrizolTM试剂盒(Invitrogen公司)和RT-PCR两步法试剂盒(北京天根)。在90mm培养皿中加入0.5mlTrizol试剂,提取细胞总RNA,1%琼脂糖凝胶电泳,用分光光度计测定RNA水平及纯度。A260/A280均在 1.18~2.10。cDNA的合成采用RT-PCR两步法,20μL逆转录反应体系,AMV Reverse Transcriptase 1μL,RNA 酶抑制剂 0.5μL,MgCl24μL(2.0mmol/L),Oligodt1μL,内含待测RNA 300ng,其余按推荐的试剂及浓度加入到反应体系。扩增 PCR:反应体系为 50μL,5×buffer10μL,分别加入 Wnt1、GSK-3β、β-catenin、cyclin D1 和 α-SMA 引物(20μmol/L)各 0.5μL,用PCR 仪扩增。扩增结束后,取5μl扩增产物在TBE缓冲液中行1.5%琼脂糖凝胶电泳(制胶时在20ml琼脂糖溶液中滴入浓度为10mg/ml溴化乙锭2μl),电泳结束后,在凝胶成像仪上拍照并进行图像分析。引物:设置β-actin为参照,由大连TAKARA公司合成,引物序列见表1。

表1 引物序列
七、统计学处理 应用SPSS11.5软件包完成统计学处理。所有数据均用表示,组间比较采用单因素方差分析,采用LSD法进行两两比较。采用Pearson法进行相关分析。P<0.05为差异有意义,P<0.01为差异有显著性意义。
结果
一、肝复康药物血清对 Wnt1、GSK-3β和βcatenin mRNA表达的影响 各组HSC细胞β-actin表达量一致。在正常对照HSC中,Wnt1和β-catenin mRNA均有表达,但程度较弱;在乙醛刺激的模型组HSC中,两者mRNA的表达明显上调,与正常对照组比有显著性差异(P<0.01);在药物血清处理的HSC细胞,Wnt1和β-catenin mRNA的表达较模型组明显下调,有显著性差异(P<0.01),且与正常对照组比差异无统计学意义(P>0.05)。与此相反,GSK-3βmRNA 在乙醛刺激的模型组HSC中表达明显下调,而在药物血清处理的HSC细胞中的表达明显上调(P<0.01,图1)。
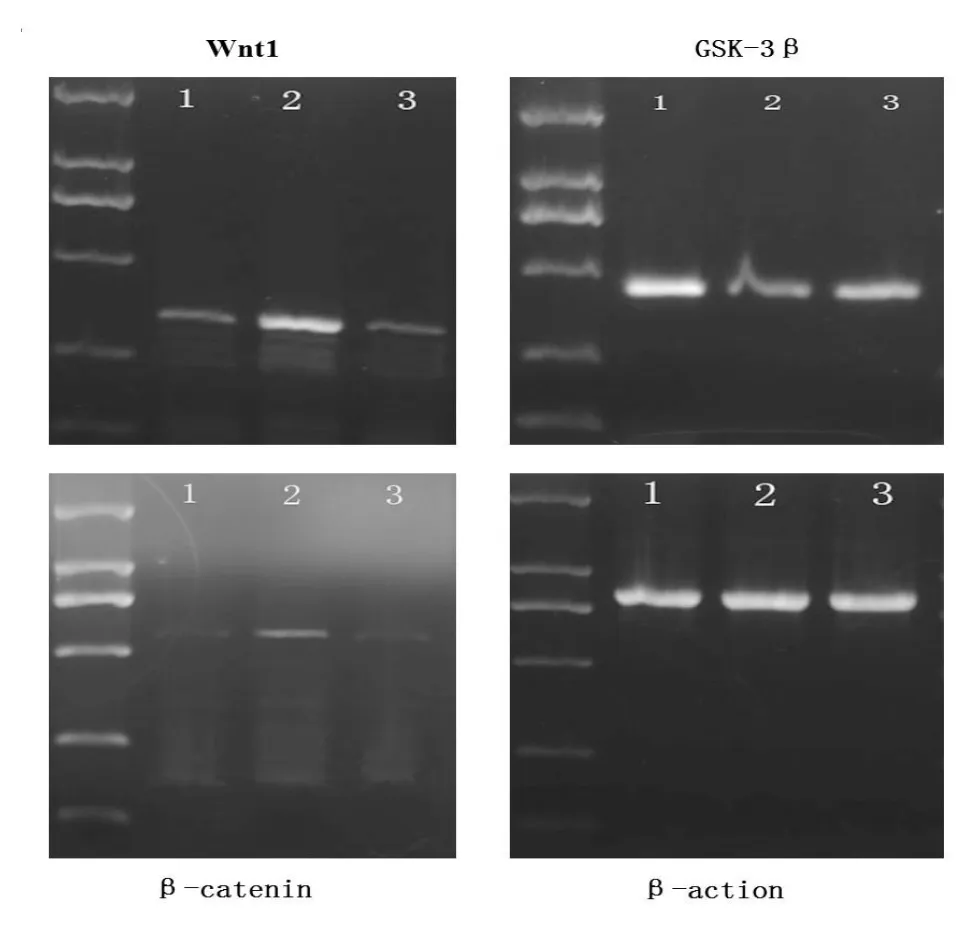
图1 Wnt1、GSK-3β、β-catenin mRNA 水平
二、肝复康药物血清对β-catenin蛋白表达的影响 在乙醛刺激的模型组HSC细胞,β-catenin蛋白表达明显升高,与正常组比有显著性差异(P<0.01);在药物血清处理组HSC细胞,β-catenin表达较模型组明显下降(P<0.01,图 2)。
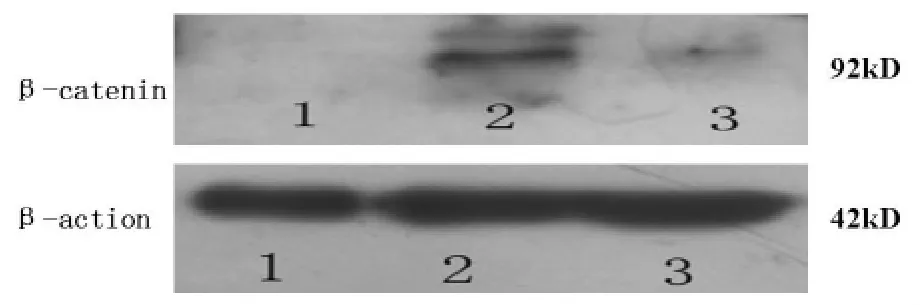
图2 β-catenin蛋白表达情况
三、肝复康药物血清对经典Wnt信号转导通路靶基因CyclinD1mRNA表达的影响 乙醛刺激的模型组HSC细胞CyclinD1mRNA表达明显升高,与正常组比有显著性差异(P<0.01)。药物血清处理组HSC细胞CyclinD1mRNA表达较模型组明显下降,差异有显著性(P<0.01,图 3)。

图3 CyclinD1mRNA表达情况
四、肝复康药物血清对α-SMA表达的影响 乙醛刺激的模型组HSC细胞α-SMA蛋白表达明显升高,与正常组比有显著性差异(P<0.01)。药物血清处理组HSC细胞α-SMA表达较模型组明显下降,差异有显著性(P<0.01,图 4)。
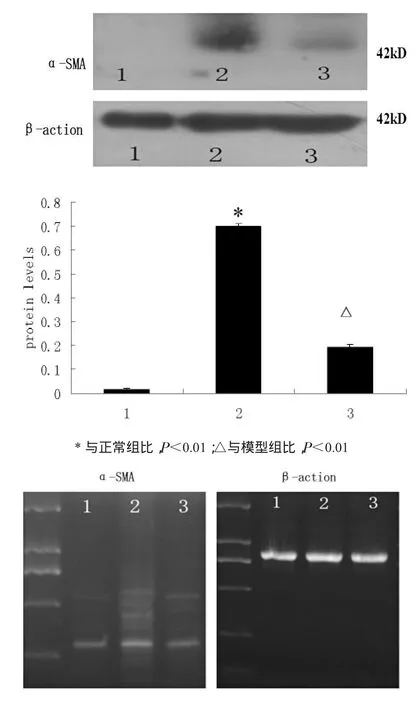
图4 α-SMA蛋白及其mRNA表达情况
五、α-SMA mRNA 与 Wnt1、β-catenin和 Cyclin-D1表达的相关性分析 α-SMA mRNA的表达与其他三者mRNA表达均呈显著正相关。
讨论
分泌性糖脂蛋白Wnt家族介导的信号是在胚胎生长和组织稳态中指导细胞增殖和细胞极性并决定细胞命运的一个基本机制[10]。因此,Wnt信号通路突变通常与人类的生长缺陷、癌症和其他的一些疾病密切相关[3,4]。目前已发现至少3条Wnt信号转导通路,包括经典的Wnt/β-catenin信号转导通路、细胞极性通路和Wnt/Ca2+通路。其中Wnt/β-catenin信号转导通路是目前研究比较多、比较深入的一条分支。当经典的Wnt/β-catenin信号转导通路被激活时,Wnt配体与跨膜受体Frizzled及其辅助受体Lrp5/Lrp6结合形成复合物并激活受体,进而激活胞内的Dsh,导致GSK-3β活性受到抑制,阻止APC-axin-GSK-3β降解复合体的形成,使β-catenin不被磷酸化和降解,而在胞浆内积累。当胞内β-catenin水平升高后,游离的β-catenin发生核转移,与转录因子Lef/Tcf结合,形成转录激活复合体,最终实现某些特定基因的表达,如c-myc、周期素 D1(CyclinD1)和 MMP7 等的增强或者减弱[11,12]。
近年研究表明,经典的Wnt/β-catenin信号转导通路与肺纤维化和肾纤维化等密切相关[13,14]。有学者指出,经典的Wnt信号通路可以使HSCs维持静止状态[15]。也有学者认为,Wnt信号能够增强HSCs的活性[16],而关于药物干预的研究尚未见报道。
本实验研究了经典的Wnt/β-catenin信号转导通路中的一些关键基因的表达情况。结果表明,乙醛刺激的模型组Wnt1和β-catenin表达增高,GSK-3β表达下降,经典的Wnt/β-catenin信号转导通路在乙醛刺激的模型组被激活了,而肝复康药物血清处理能够明显改善上述变化,说明肝复康可能通过抑制经典的Wnt/β-catenin信号转导通路从而达到抑制HSCS增殖,减少炎症的发生,而具有抗肝纤维化的作用。
当然,经典的Wnt/β-catenin信号转导通路最终是通过其靶基因来发挥效应的。在众多推论的靶基因中,CyclinD1被普遍认为能调控细胞进入S期和G2/M期的增殖和分化[17]。
到目前为止,经典的Wnt/β-catenin信号转导通路与α-SMA基因表达之间的关系尚未见报道。本研究结果显示,三者表达呈显著正相关。因此,我们推测在肝纤维化发生过程中,经典的Wnt/β-catenin信号转导通路被激活,从而促进HSCs的活化,进而增加α-SMA的表达,但其中的分子生物学机制还有待于进一步研究。
[1]CADIGAN KM,NUSSE R.Wnt signaling:a common theme in animal development[J].Genes Dev,1997,11:3286-3305.
[2]LEE PN,PANG K,MATUS DQ,et al.A WNT of things to come:evolution of Wnt signaling and polarity in cnidarians[J].Semin Cell Dev Biol,2006,17:157-167.
[3]KIKUCHI A,YAMAMOTO H.Tumor formation due to abnormalities in the beta-catenin-independent pathway of Wnt signaling[J].Cancer Sci,2008,99(2):202-208.
[4]ZHANG B,ZHOU KK,MA JX.Inhibition of connective tissue growth factor overexpression in diabetic retinopathy by SERPINA3K via blocking the WNT/beta-catenin pathway[J].Diabetes,2010,59(7):1809-1816.
[5]MORRISEY EE.Wnt signaling and pulmonary fibrosis[J].Am J Pathol,2003,162(5):1393-1397.
[6]HE W,DAI C,LI Y,et al.Wnt/beta-catenin signaling promotes renal interstitial fibrosis[J].J Am Soc Nephrol,2009,20(4):765-776.
[7]车颖,徐婷婷,姜妙娜,等.肝复康对实验性肝纤维化大鼠肝细胞的保护作用[J]. 中药材,2004,27(6):428-429.
[8]车颖,王善菊,徐婷婷,等.中药肝复康对实验性肝纤维化大鼠肝功能及血清标志物的影响[J].放射免疫学杂志,2004,17(4):283-284.
[9]DIGNAM JD,LEBOVITZ RM,ROEDER RG.Accurate transcription initiation by RNA polymerase II in a soluble extract from isolated mammalian nuclei[J].Nucleic Acids Res,1983,11:1475-1489.
[10]ZHAO J,KIM KA,ABO A.Tipping the balance:modulating the Wnt pathway for tissue repair[J].Trends Biotechnol,2009,27:131-136.
[11]HUANG H,HE X.Wnt/beta-catenin signaling:new (and old)players and new insights[J].Curr Opin Cell Biol,2008,20:119-125.
[12]LING L,NURCOMBE V,COOL SM.Wnt signaling controls the fate of mesenchymal stem cells[J].Gene,2009,433:1-7.
[13]KONIGSHOFF M,BALSARA N,PFAFF EM,et al.Functional Wnt signaling is increased in idiopathic pulmonary fibrosis[J].PLoS One,2008,3:e2142.
[14]KIM TH,KIM SH,SEO JY,et al.Blockade of the Wnt/β -catenin pathway attenuates bleomycin-induced pulmonary fibrosis[J].Tohoku J Exp Med,2011,223(1):45-54.
[15]CLAUS K,IRIS S,DIETER H.Canonical Wnt signaling maintains the quiescent stage of hepatic stellate cells[J].Biochem Biophys Res Commun,2008,367:116-123.
[16]MYUNGA SJ,YOONA,JH,GWAK GY.Wnt signaling enhances the activation and survival of human hepatic stellate cells[J].FEBS Letters,2007,581:2954-2958.
[17]ALBRECHT JH,HANASEN LK.CyclinD1 promotes mitogenindependent cell cycle progression in hepatocytes[J].Cell Growth Differe,1999,10:397-404.
