南蛇藤乙酸乙酯提取物诱导HepG2细胞凋亡的实验研究*
2011-03-15汪茂荣
熊 熙 汪茂荣
南蛇藤(Celastrus orbiculatus Thunb)为卫矛科南蛇藤(celastrus)属植物,分布广泛,其藤茎、根、叶、果均可入药。现代药物化学研究证实,其具有抗肿瘤、抗菌、抗病毒、抗生育和镇痛等广泛的药理活性[1]。为进一步研究南蛇藤抗肿瘤的作用机制,本实验应用体外细胞模型研究了南蛇藤乙酸乙酯提取物对肿瘤细胞增殖的抑制作用,现报告如下。
材料与方法
一、材料及主要试剂 HepG2细胞购自中国科学院上海细胞研究所。南蛇藤乙酸乙酯提取物由扬州大学刘延庆教授赠送。DMEM培养基(HyClong公司);胎牛血清(美国ExCell公司);CCK-8试剂盒(主要成分WST-8,日本株式会社同仁化学研究所);Alexa Fluor 488 annexin V-PI试剂盒(美国Invitrogen公司);碘化丙啶(PI,杭州联科生物公司);Caspase-3凋亡比色法试剂盒(美国Biovision公司);BCA蛋白定量试剂盒(美国Pierce公司);其它试剂均为进口分装或国产分析纯,购自南京生兴公司。
二、HepG2细胞培养 取适量冻存的HepG2细胞复苏,接种在含10%胎牛血清的DMEM(含100U/ml青霉素和100U/ml链霉素)培养瓶内,置入37℃、5%CO2饱和浓度的培养箱中培养,2天传代1次。取对数生长期细胞进行实验。
三、南蛇藤乙酸乙酯提取物对HepG2细胞增殖的影响 采用CCK-8法检测。取HepG2细胞接种于96孔培养板,每孔5×104个细胞,培养24h,弃培养基,加入含不同浓度的南蛇藤提取物培养基100μl/孔,终浓度分别为 300μg/ml、240μg/ml、120μg/ml、60μg/ml、30μg/ml、15μg/ml和阴性对照组;阴性对照组加入等体积的DMEM;同时设本底空白对照组。每个浓度设3个复孔,于37℃、5%CO2培养箱中分别继续培养 24h、48h 和 72h,然后每孔加入 WST-810μl,继续培养1h后,在酶标仪上检测450nm吸光度,计算药物对细胞的生长抑制率,即:
细胞生长抑制率(%)=(对照组OD值-用药组OD值)/对照组OD值×100%
四、细胞周期和细胞凋亡的检测 采用流式细胞术,在药物作用24h后,加胰酶消化、1000rpm离心,收集细胞,同时用冷的PBS冲洗2次,加70%乙醇固定,4℃过夜。离心去除乙醇,调整细胞数为1×106个/mL。加入终浓度为10mg/L PI 500μl,室温避光30min后上流式细胞仪检测细胞周期分布。按Annexin V-PI试剂盒说明进行凋亡率的检测。
五、凋亡细胞caspase-3活性检测 采用比色法,取细胞 5×105/孔接种到6孔板中,培养24h后,消化、收集。同时设空白(lysis buffer+2×reaction buffer)对照组,实验组加入不同浓度(120μg/ml、60μg/ml和 30μg/ml)南蛇藤提取物,阴性对照加入等体积的DMEM。处理24h和48h后收集细胞,1000g离心5min,PBS洗2次,去除上清。在收集的沉淀细胞中加入50μl冰冷裂解缓冲液,置冰上裂解20min,蜗旋振荡10s,10000g,4℃离心1min。把离心上清液转移至新的EP管中,并放置冰上,测定蛋白浓度。吸取50μl含50μg蛋白的细胞裂解上清,如体积不足50μl,则用裂解缓冲液补足。加入50μl 2×反应缓冲液;加入5μl Caspase-3底物,并于37℃避光孵育4h;在酶标仪上以405nm波长测定其吸光度OD值。
Caspase-3活化度=(南蛇藤组OD值-空白对照组OD值)/(阴性对照组OD值-空白对照组OD值)。同时测定并绘制pNA标准曲线,计算一个样品单位重量蛋白中所含的caspase 3酶的活力单位。
结果
一、对HepG2细胞的抑制作用 随药物浓度升高,其对细胞增殖的抑制率也增高,并随作用时间延长而增强(图 1);药物作用 24h,其 IC50为 111.8μg/ml,作用 48h,其 IC50为 99.7μg/ml,作用 72 小时,其IC50为43.0μg/ml(图2)。
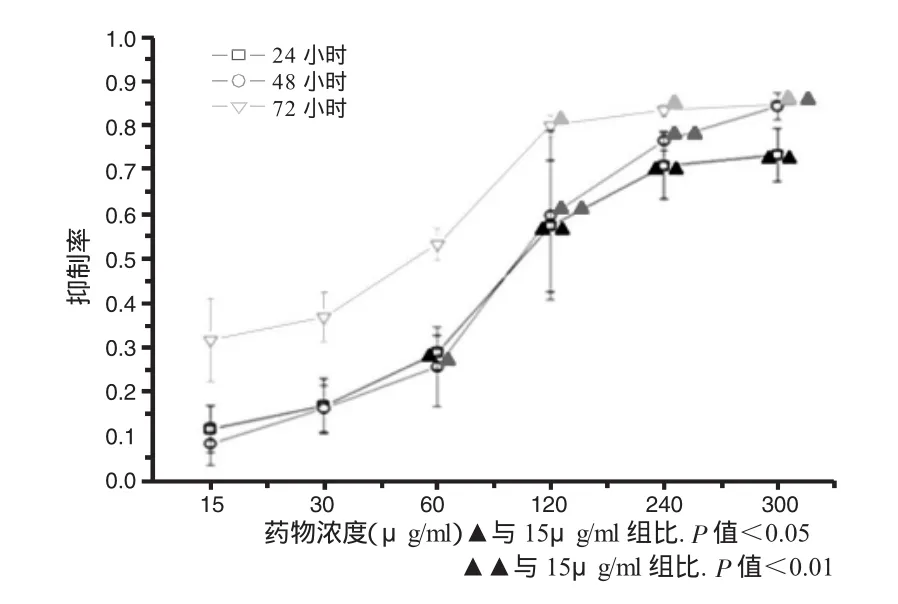
图1 不同浓度的南蛇藤乙酸乙酯提取物对Hep细胞的抑制作用
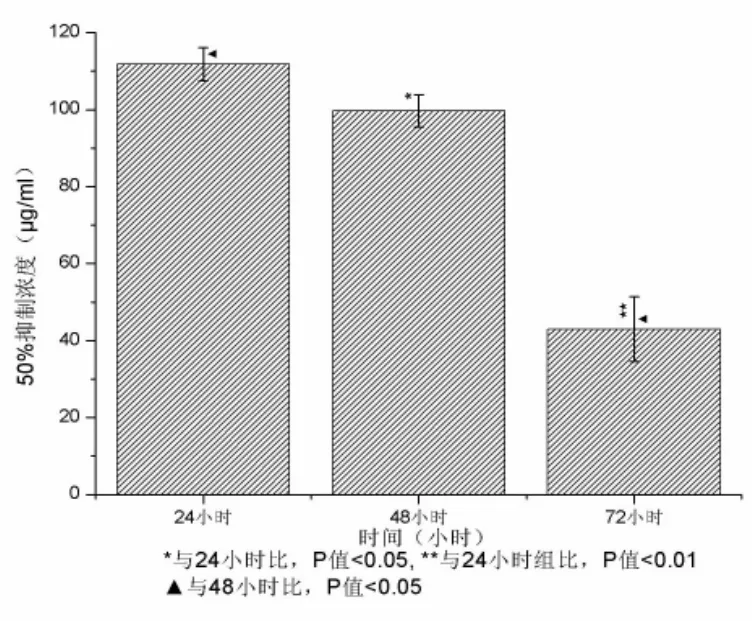
图2 不同时间点下南蛇藤乙酸乙酯提取物作用HepG2细胞的IC50
二、南蛇藤乙酸乙酯提取物作用前后细胞周期的变化 在G0-G1峰前出现一个DNA减少的亚二倍体峰,即凋亡峰,即随药物剂量增大凋亡峰增高(图3);与阴性对照组比较,在 30μg/ml、60μg/ml、120μg/ml和240μg/ml药物作用细胞24h后,细胞进入G0-G1增多(图 4)。
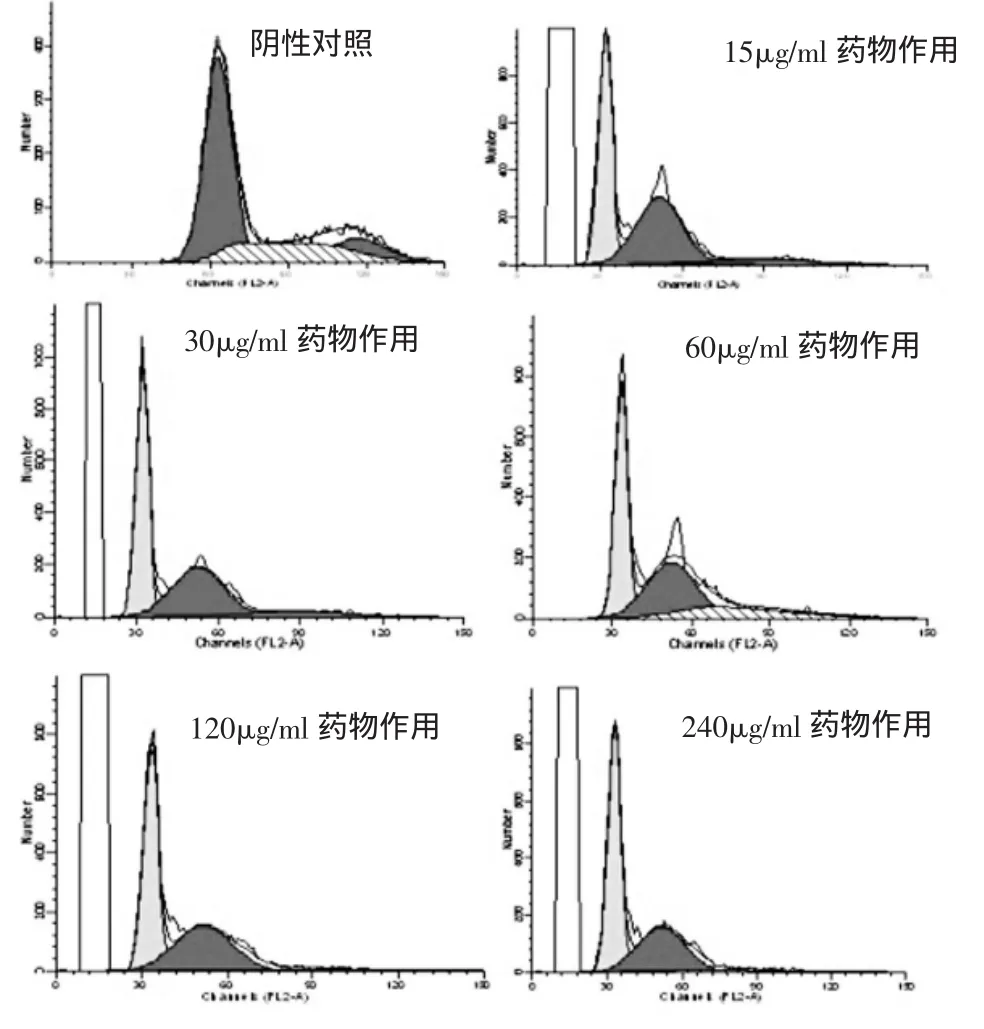
图3 南蛇藤乙酸乙酯提取物作用HepG2细胞后DNA水平的变化
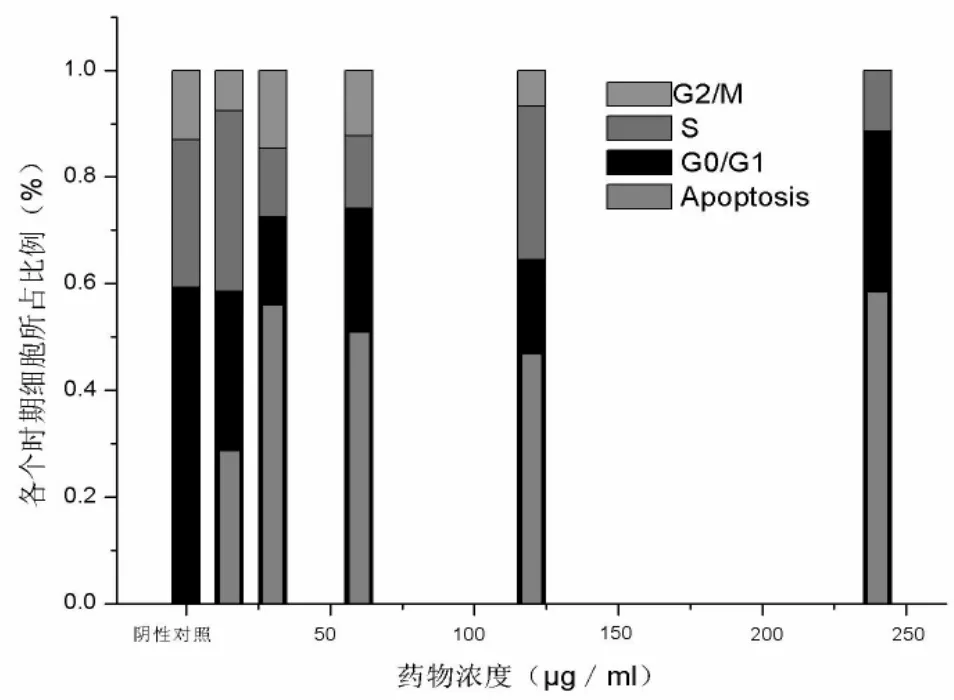
图4 不同浓度的南蛇藤乙酸乙酯提取物作用HepG2细胞后细胞周期的变化
三、南蛇藤乙酸乙酯提取物诱导HepG2细胞凋亡的作用 从annexin V和PI荧光双参数点图(图5)观察到,对照组细胞主要分布在3区,有少量因操作等原因引起的机械性细胞死亡(数量<8%);随南蛇藤提取物浓度升高,凋亡细胞相应增加。与对照组比较,15μg/ml、30μg/ml和 60μg/ml南蛇藤提取物处理组细胞凋亡率之间有显著性差异(F=5.449,P<0.05,图6)。但当药物浓度为120μg/ml和240μg/ml时并作用24h后,细胞凋亡率下降。

图5 南蛇藤乙酸乙酯提取物诱导HepG2细胞凋亡后的荧光双参数图
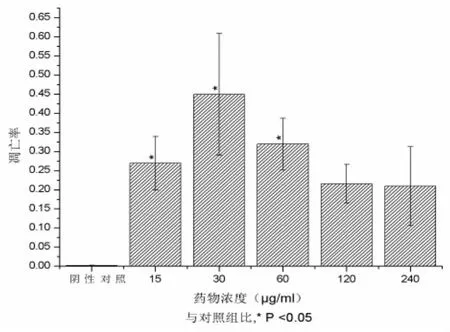
图6 不同浓度的南蛇藤乙酸乙酯提取物产生的HepG2细胞凋亡率
四、南蛇藤乙酸乙酯提取物对HepG2细胞中Caspase-3活性的影响 经药物处理24h后,细胞内caspase-3活性上升,有显著性统计学意义(F=53.439,P<0.01);经药物处理48h后,细胞内caspase-3活性上升,有显著性统计学意义(F=,3.558,P<0.05)。在120μg/ml南蛇藤提取物作用24h时,caspase-3活性出现峰浓度(图7)。
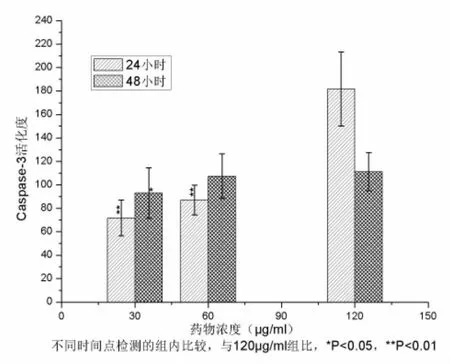
图7 不同浓度南蛇藤乙酸乙酯提取物作用细胞24h、48h的caspase-3活性
讨 论
有多种方法可检测细胞凋亡[2~8]。研究细胞凋亡和细胞周期的调控机制有助于抗癌药物的筛选。
南蛇藤提取物对HepG2细胞有明显的抑制作用,且与药物作用时间和剂量相关,即有量效和时效关系。当南蛇藤乙酸乙酯提取物在120μg/ml时,对细胞的抑制率大于 50%,其 IC50=111.8±2.90μg/ml,与张舰和许运明等[9]的研究结果接近。当药物作用48h时的 IC50 为 99.7±2.82μg/ml,而毛建山[10]应用从粉背南蛇藤中提取的新三萜化合物对RKO细胞作用48h时,其IC50为12.20±0.79μg/ml。有多种因素可造成这种偏差,如所用细胞系、凋亡诱导剂、药物浓度或刺激强度和暴露时间等[11]。经流式细胞仪分析表明,在15~240μg/ml南蛇藤提取物作用细胞24h促凋亡作用明显,细胞周期阻滞在G0-G1期,而G2-M期细胞明显减少,S期细胞则无明显变化。南蛇藤乙酸乙酯提取物在30μg/ml时即有明显地诱导肿瘤细胞凋亡的作用。由于细胞周期分析实验和Annexin V-PI细胞凋亡检测方法的局限性,在高浓度药物作用24h后,诱导的细胞有可能已经进入凋亡的中晚期,而细胞凋亡并不随药物浓度的增加而更明显。
本研究表明,南蛇藤乙酸乙酯提取物具有抑制HepG2细胞增殖和诱导细胞凋亡的作用,抑制细胞增殖的机制可能与它能使细胞周期停滞在G0-G1期和引起细胞凋亡有关,其促凋亡的机制可能与增加Caspase-3活性有关。
[1]张舰,刘延庆.南蛇藤的研究进展[J].国外医学中医中药分册,2004,26(6):335-338.
[2]汪茂荣.中药南蛇藤抗肿瘤作用的研究进展[J].中医学报,2010,25(6):1055-1057.
[3]OHUCHIDA T,OKAMOTO K,AKAHANE K,et al.Midkine protects hepatocellular carcinoma cells against TRAIL-mediated apoptosis through down-regulation of caspase-3 activity[J].Cancer,2004,100(11):2430-2436.
[4]WANG LM,LI QY,ZU YG,et al.Anti-proliferative and proapoptotic effect of CPT13,a novel camptothecin analog,on human colon cancer HCT8 cell line[J].Chem Biol Interact,2008,176(2-3):165-172.
[5]QIAN YF,WANG H,YAO WB,et al.Aqueous extract of the Chinese medicine,Danggui-Shaoyao-San,inhibits apoptosis in hydrogen peroxide-induced PC12 cells by preventing cytochrome c release and inactivating of caspase cascade[J].Cell Biol Int,2008,32(2):304-311.
[6]GRANVILLE DJ,CARTHY CM,HUNT DW,et al.Apoptosis:molecular aspects of cell death and disease[J].Lab Invest,1998,78(8):893-913.
[7]THOMBERRY NA,LAZEBNIK Y.Caspases:enemies within[J].Science,1998,281(5381):1312-1316.
[8]BUDIHARDJO I,OLIVER H,LUTTER M,et al.Biochemical pathways of caspase activation during apoptosis[J].Annu Rev Cell Dev Biol,1999,15:269-290.
[9]张舰,许运明,刘延庆.南蛇藤提取物体外抑瘤作用研究[J].中药药理与临床,2006,22(3、4):99-101.
[10]毛建山,王奎武,郑树,等.粉背南蛇藤中新三萜化合物对RKO细胞体外抗癌作用的研究[J].中国中药杂志,2006,31(17):1450-1453.
[11]TERRI S,RICH M,ANDREW N,et al.Timing your apoptosis assays[J].Cell Notes Promega,2009,16:18-21.
