自组装山羊颞下颌关节盘组织工程纤维软骨模型的构建
2011-03-07康宏李振强闭艳妲
康宏 李振强 闭艳妲
(兰州大学 口腔医学研究所,兰州 730000)
自组装山羊颞下颌关节盘组织工程纤维软骨模型的构建
康宏 李振强 闭艳妲
(兰州大学 口腔医学研究所,兰州 730000)
目的 构建山羊颞下颌关节盘纤维软骨自组装模型,观察自组装组织工程纤维软骨的生物学特征,为颞下颌关节盘及其他组织工程纤维软骨的进一步研究创造条件。方法 分离、培养山羊颞下颌关节盘细胞,按每井5.5×106个接种到预制的直径5mm×深10mm琼脂糖井内,每天换液,培养2周,观察和检测颞下颌关节盘形态和成分的变化。结果 接种后1 d,山羊颞下颌关节盘细胞在琼脂糖井内聚集,开始自组装成一圆盘状基体,后来逐渐变成圆球形。培养2周时,苏木精-伊红染色可观察到纤维软骨细胞呈圆形,周围有基质包绕;Safranin-O/fast green染色显示自组装基体内纤维软骨细胞分泌细胞外基质氨基多糖;picro-sirius red染色可见自组装基体内有大量胶原纤维。Ⅰ型胶原免疫组织化学染色可见胞浆和细胞外有棕黄色颗粒,表明自组装纤维软骨可以产生与自然关节盘组织一致的Ⅰ型胶原成分。结论 利用琼脂糖井构建的山羊颞下颌关节盘自组装组织工程模型,能产生与自然关节盘成分相似的细胞外基质,表明组织工程化颞下颌关节盘组织的途径是可行的。
颞下颌关节盘; 组织工程; 纤维软骨
颞下颌关节盘是位于下颌髁突和颞骨关节窝之间的纤维软骨样组织,是颞下颌关节(temporomandibular joint,TMJ)行使功能的主要组成部分,以关节盘变薄、透明样变和穿孔等不可逆性病变为特征的严重颞下颌关节紊乱病(temporomandibular disorder,TMD),给患者的进食、说话带来了困难和痛苦,长期以来没有很好的治疗方法,是目前口腔临床面临的疑难问题之一。近年来组织工程技术的发展为临床修复损伤和病变的关节盘提供了一种新的治疗方向[1]。
颞下颌关节盘组织工程的目标是在体外组装出与自然组织相似的复合基体,以实现病损关节盘的功能替换[2]。以往的组织工程纤维软骨研究模型大多利用三维支架构建[2-6],虽然支架材料不断改进,但是仍然存在一些不足,比如抑制细胞的移动和细胞之间的信息交流、应力遮挡作用阻碍细胞的机械信号转导、支架阻碍细胞生长和细胞外基质重塑、有些固体支架使细胞表型丧失、支架的不利降解产物及炎症反应等等,以琼脂糖为模具的自组装技术(selfassembly process)因可以克服上述缺点在关节软骨组织工程的研究中已有成功报道[7-9],但是,TMJ关节盘组织与关节软骨不同,细胞外基质以Ⅰ型胶原和氨基多糖(glycosaminoglycans,GAGs)为主而非Ⅱ型胶原,能否采用自组装技术进行组织构建并且能够产生与自然关节盘细胞外基质相似的复合基体成分还不清楚。因此,本研究旨在探索利用TMJ关节盘细胞体外自组装构建TMJ关节盘纤维软骨复合基体的可行性。
1 材料和方法
1.1 实验动物
1月龄山羊,体重10~15 kg,购自兰州市屠宰场。
1.2 实验方法
1.2.1 关节盘纤维软骨细胞的分离 将购回的死亡不超过12 h的山羊头6只,用自来水加洗洁剂洗净血污,浸没于75%乙醇中20min,置入超净工作台,无菌条件下取出双侧TMJ盘,剪去周围组织,浸入75%医用乙醇10 s,用含100 U·mL-1双抗(青霉素、链霉素)的PBS液于离心管内吹打冲洗3次,移入50mL烧杯,加入少量PBS,用眼科剪将关节盘剪成糊状,约1mm3大小。加入15mL用完全培养基(见单层细胞培养)配置的Ⅰ型胶原酶(2mg·mL-1),移入100mL锥形瓶,牛皮纸封口,于37℃、90 r·min-1摇床内消化16 h,100目筛网过滤,1 200 r·min-1离心10min,DMEM重悬洗涤(1 000 r·min-1离心5min)2次,以去除胶原酶,收集的细胞利用血细胞计数器计数,6只山羊的关节盘获得1.8×106细胞,按2×105进行单层细胞培养。备用细胞源采用冻存液(DMEM:胎牛血清:DMSO=5∶4∶1)置于-82℃冰箱中冻存。
1.2.2 单层细胞培养 用于细胞培养的完全培养基是含有2mmol·L-1L-谷氨酰胺、4.5 g·L-1葡萄糖、110mg·L-1丙酮酸钠的高糖DMEM培养基,其中添加了15%的胎牛血清、1%青-链霉素、1%非必需氨基酸、25μL·mL-1抗坏血酸[2]。6只羊头的原代TMJ盘细胞接种到8个25 cm2的培养瓶中,于5%CO2、饱和湿度、37℃恒温箱内培养至70%~90%汇合,然后用每瓶胰蛋白酶(0.25%)1mL消化,传代至第2代。
1.2.3 自组装基体制备 加工6个直径5mm、长10mm的不锈钢棒,两端尽量平整光滑,将其一端黏在48孔板的盖子内面,使之正对48孔板的6个孔,紫外线照射1 h,然后将消毒融化的2%的琼脂糖灌注于48孔板与不锈钢棒相对应的孔内,每孔1mL,合上盖子,琼脂糖在室温下30min成凝胶。然后小心将盖子连同不锈钢棒从琼脂糖中分离,向所形成的琼脂糖井中加入每井500μL完全培养基,加盖另一无菌盖子,在随后2 d中更换4次培养基,以使培养基完全置换出琼脂糖中的PBS,使琼脂糖井模具被培养基完全饱和到细胞接种时间为止。然后将150μL含有5.5×106个细胞的培养基加在每一个琼脂糖井内[8],4 h后添加每井350μL培养基,以后每天换液每井500μL,细胞24 h将自组装在琼脂糖井内形成圆盘状基体,培养2周后进行各项检测。
1.2.4 大体观察 2周时取出自组装基体,测量其湿重、直径、厚度。
1.2.5 组织学和免疫组织化学染色 样品冰冻,14μm切片,苏木精-伊红染色观察基体组织形态,Safranin-O/fast green染色检测GAGs分布情况,picro-sirius red染色检查胶原分布。切片用冰丙酮固定,缓冲液冲洗,用过氧化氢/甲醇终止过氧化物酶活动,山羊血清阻断(SP-9002免疫组化染色试盒),鼠抗Ⅰ型胶原抗体孵育,加入第二抗体(山羊抗小鼠IgG,SP-9002免疫组化染色试盒),DAB显色,检测Ⅰ型胶原的分布。
2 结果
2.1 自组装基体大体观察
高密度TMJ盘细胞接种到琼脂糖井内后,在光滑的琼脂糖表面不贴壁,不伸展,而是细胞间相互靠近汇聚,4 h后可见在井底琼脂糖表面形成圆盘状结构,乳白色,直径约(5.0±0.3)mm,厚约(3.0±0.2)mm,1 d后变成圆球状,直径略缩小(图1),以后直径逐渐缩小,10 d后趋于稳定,约(1.5±0.1)mm,表面日趋光滑,14 d时直径(1.6±0.1)mm,湿重(3.0±0.2)mg,如图2所示。
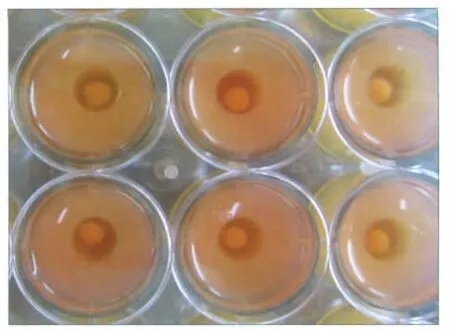
图1 1 d时自组装基体形态Fig 1 Gross morphology of the construct at the first day

图2 2周时自组装基体的正面(左)、侧面(右)形态Fig 2 Morphology of the construct from frontal(left)and sagittal(right)view at 2 weeks
2.2 自组装基体组织学观察
培养14 d时,苏木精-伊红染色可观察到纤维软骨细胞呈圆形,周围有基质包绕(图3)。Safranin-O/ fast green染色显示自组装基体内纤维软骨细胞分泌细胞外基质GAGs(图4)。
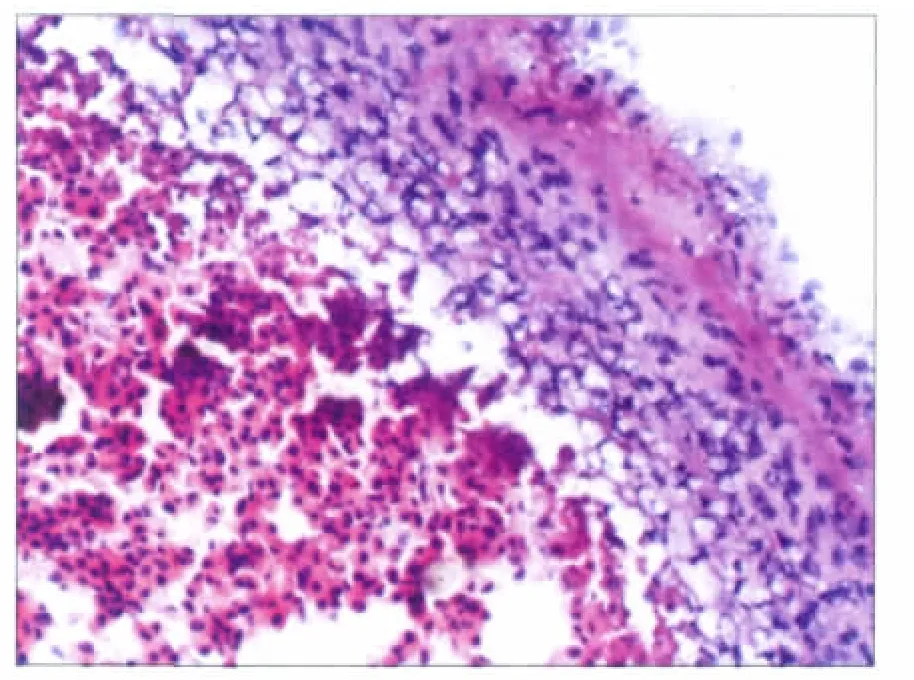
图3 纤维软骨细胞呈圆形(蓝色),周围有细胞外基质(粉红色)包绕 HE ×400Fig 3 Fibrocartilage cells(stained blue)are round,wrapped around by extracellular matrix(stained pink) HE ×400

图4 自组装基体内的纤维软骨细胞周围可见少量GAGs(红色)Safranin-O/fast green染色 ×400Fig 4 A little of GAGs(stained red)around the fibrochondrocytes in the construct Safranin-O/fast green staining ×400
picro-sirius red染色可见自组装基体内有大量胶原纤维(图5)。

图5 自组装基体含有大量胶原纤维,尤其是基体外周最多picro-sirius red染色 ×100Fig 5 Numerous collagen fibers in the construct,extremely densely in the periphery of the construct picro-sirius red staining ×100
2.3 自组装基体免疫组织化学观察
14 d时,Ⅰ型胶原免疫组织化学染色可见胞浆和细胞外有棕黄色颗粒分布(图6),表明自组装纤维软骨有分泌Ⅰ型胶原的能力。
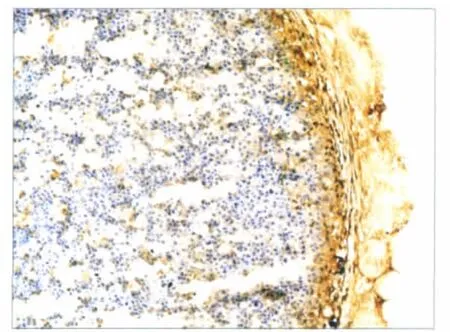
图6 Ⅰ型胶原表达于胞浆和细胞外,呈棕黄色颗粒 SP-9002染色 ×200Fig 6 Expression of collagenⅠwas brown-yellow particles in cytoplasm and extracellular matrix SP-9002 staining ×200
3 讨论
本实验的目标是构建与自然关节盘细胞外基质成分相似的复合基体组织。工程化细胞外基质可采取两种策略,一种是采用结构和性能与细胞外基质相似的生物材料作为支架自上而下进行工程化组织的构建;另一种是利用特异性能的小分子由下而上进行自组装生成工程化组织,以达到功能上的仿生[10]。自组装过程是组织工程一个独特的方法,它能使细胞源在不需要附着于支架结构的条件下,细胞彼此之间相互结合在一起形成功能性的新生组织。这种过程似乎遵循了Steinberg[11]关于差力黏附的假说,该假说指出单分散细胞通过细胞间黏附力的最大化及总自由能的最小化使细胞聚集并结合在一起。由于细胞的接种密度以及不同的黏附力是形成组织性能的决定性因素[12],本实验采用每150μL 5.5×106个的高细胞密度,使得细胞间距变小,细胞间黏附力增大,同时,光滑的琼脂糖井底和井壁极大地减小了聚集自由能,为纤维软骨细胞自组装基体的形成创造了必要条件。
细胞接种到琼脂糖井内的最初几天,由于组装成的基体较为疏松,换液时应尽量避免晃动培养板以防基体碎裂。本实验利用自组装技术构建的纤维软骨基体,在外观、组织学和组织化学上与自然关节盘组织相似。Ⅰ型胶原和GAGs是TMJ关节盘组织较为特异的标志性成分,免疫组织化学检测显示自组装基体内广泛分布有Ⅰ型胶原成分,Safranin-O/fast green染色也表明自组装基体内关节盘细胞分泌少量细胞外基质GAGs。无支架琼脂糖凝胶三维培养系统为细胞间信息的交流和自分泌生长因子的聚集提供便利,维系关节盘纤维软骨细胞的表型[13]。
自组装基体在细胞接种后的第1周出现明显的外形收缩现象。有人认为这种收缩可能与体外培养的纤维软骨中α-平滑肌肌动蛋白(α-smooth muscle actin,α-SMA)的表达增多有关,表达α-SMA的纤维软骨细胞会引起细胞外基质收缩、变形,对工程化纤维软骨构建产生不利影响[14]。研究提示碱性成纤维细胞生长因子(basic fibroblast growth factor,bFGF)[15]和星孢菌素[16]可抑制软骨细胞中α-SMA表达。
另外,有研究对影响自组装基体生长的外环境因素包括生长因子和生物力学刺激的效应进行了研究。血小板衍生生长因子、bFGF和转化生长因子-β1对接种到二维生长物与聚乙醇酸表面的关节盘细胞的代谢有一定的影响,对细胞增殖、胶原合成和复合物的力学性能具有上调效应和协同效应[3-4,17]。在体外细胞培养中,静水压、直接压缩力、剪切流环境等机械刺激都是纤维软骨细胞生存和不断生成细胞外基质的手段[9,18-19],尽管采用琼脂糖凝胶三维自组装模型为研究机械刺激对工程化组织的作用提供了便利,但是,干预基体生长的最佳因素目前还不明确。
[1] Allen KD,Athanasiou KA.Tissue engineering of the TMJ disc:A review[J].Tissue Eng,2006,12(5):1183-1196.
[2] Johns DE,Athanasiou KA.Improving culture conditions for temporomandibular joint disc tissue engineering[J].Cells Tissues Organs,2007,185(4):246-257.
[3] Detamore MS,Athanasiou KA.Evaluation of three growth factors for TMJ disc tissue engineering[J].Ann Biomed Eng,2005,33(3):383-390.
[4] Almarza AJ,Athanasiou KA.Evaluation of three growth factors in combinations of two for temporomandibular joint disc tissue engineering[J].Arch Oral Biol,2006,51(3):215-221.
[5] Almarza AJ,Athanasiou KA.Seeding techniques and scaffolding choice for tissue engineering of the temporomandibular joint disk [J].Tissue Eng,2004,10(11/12):1787-1795.
[6] Springer IN,Fleiner B,Jepsen S,et al.Culture of cells gained from temporomandibular joint cartilage on non-absorbable scaffolds[J].Biomaterials,2001,22(18):2569-2577.
[7] Hu JC,Athanasiou KA.A self-assembling process in articular cartilage tissue engineering[J].Tissue Eng,2006,12(4):969-979.
[8] Revell CM,Reynolds CE,Athanasiou KA.Effects of initial cell seeding in self assembly of articular cartilage[J].Ann Biomed Eng, 2008,36(9):1441-1448.
[9] Elder BD,Athanasiou KA.Effects of temporal hydrostatic pressure on tissue-engineered bovine articular cartilage constructs[J].Tissue Eng Part A,2009,15(5):1151-1158.
[10] 曹谊林.组织工程学[M].北京:科学出版社,2008:169.
CAO Yi-lin.Tissue engineering[M].Beijing:Science Publishing House,2008:169.
[11] Steinberg MS.Mechanism of tissue reconstruction by dissociated cells.Ⅱ.Time-course of events[J].Science,1962,137:762-763.
[12] Napolitano AP,Chai P,Dean DM,et al.Dynamics of the selfassembly of complex cellular aggregates on micromolded nonadhesive hydrogels[J].Tissue Eng,2007,13(8):2087-2094.
[13] Robinson D,Ash H,Yayon A,et al.Characteristics of cartilage biopsies used for autologous chondrocytes transplantation[J].Cell Transplant,2001,10(2):203-208.
[14] Mueller SM,Schneider TO,Shortkroff S,et al.alpha-smooth muscle actin and contractile behavior of bovine meniscus cells seeded in typeⅠand typeⅡcollagen-GAG matrices[J].J Biomed Mater Res,1999,45(3):157-166.
[15] Martin I,Suetterlin R,Baschong W,et al.Enhanced cartilage tissue engineering by sequential exposure of chondrocytes to FGF-2 during 2D expansion and BMP-2 during 3D cultivation[J].J Cell Biochem,2001,83(1):121-128.
[16] Zaleskas JM,Kinner B,Freyman TM,et al.Contractile forces generated by articular chondrocytes in collagen-glycosaminoglycan matrices[J].Biomaterials,2004,25(7/8):1299-1308.
[17] Hanaoka K,Tanaka E,Takata T,et al.Platelet-derived growth factor enhances proliferation and matrix synthesis of temporomandibular joint disc-derived cells[J].Angle Orthod,2006,76(3):486-492.
[18] Gunja NJ,Athanasiou KA.Effects of hydrostatic pressure on leporine meniscus cell-seeded PLLA scaffolds[J].JBiomed Mater Res A,2010,92(3):896-905.
[19] Elder BD,Athanasiou KA.Hydrostatic pressure in articular cartilage tissue engineering:From chondrocytes to tissue regeneration [J].Tissue Eng Part B Rev,2009,15(1):43-53.
(本文编辑 汤亚玲)
Self-assembly tissue engineering fibrocartilage model of goat tem poromandibular joint disc
KANG Hong,LI Zhen-qiang,BI Yan-da.(Institute of Stomatology,Lanzhou University,Lanzhou730000,China)
ObjectiveTo construct self-assembly fibrocartilage model of goat temporomandibular joint disc and observe the biological characteristics of the self-assembled fibrocartilage constructs,further to provide a basis for tissue engineering of the temporomandibular joint disc and other fibrocartilage.MethodsCells from temporomandibular joint discs of goats were harvested and cultured.5.5×106cells were seeded in each agarose well with diameter 5mm ×depth 10mm,daily replace of medium,cultured for 2 weeks.Results One day after seeding,goat temporomandibular joint disc cells in agarose wells were gathered and began to self-assemble into a disc-shaped base,then gradually turned into a round shape.When cultured for 2 weeks,hematoxylin-eosin staining was conducted and observed that cells were round and wrapped around by the matrix.Positive Safranin-O/fast green staining for glycosaminoglycans was observed throughout the entire constructs,and picro-sirius red staining was examined and distribution of numerous typeⅠcollagen was found.Immunohistochemistry staining demonstrated brown yellow particles in cytoplasm and around extracellular matrix, which showed self-assembly construct can produce typeⅠcollagen as native temporomandibular joint disc tissue.ConclusionProduction of extracellular matrix in self-assembly construct as native temporomandibular joint disc tissue indicates that the use of agarose wells to construct engineered temporomandibular joint disc will be possible and practicable.
temporomandibular joint disc; tissue engineering; fibrocartilage
R 782.6
A
10.3969/j.issn.1000-1182.2011.03.024
1000-1182(2011)03-0314-04
2010-06-15;
2010-11-22
甘肃省国际科技合作基金资助项目(0804WCGA127)
康宏(1966—),男,甘肃人,教授,博士
康宏,Tel:0931-6112809
