阿仑膦酸钠对骨质疏松种植体骨结合影响的力学研究
2011-03-07李春艳周延民王林李艳秋付丽宫琳
李春艳 周延民 王林 李艳秋 付丽 宫琳
(1.吉林大学口腔医院 种植中心,长春 130021;2.北京航天中心医院 口腔科,北京 100049)
阿仑膦酸钠对骨质疏松种植体骨结合影响的力学研究
李春艳1周延民1王林1李艳秋1付丽1宫琳2
(1.吉林大学口腔医院 种植中心,长春 130021;2.北京航天中心医院 口腔科,北京 100049)
目的 通过力学评估研究全身应用骨吸收抑制剂阿仑膦酸钠对骨质疏松模型种植体周围骨整合的影响。方法 27只5月龄日本大耳白兔随机分成3组,每组9只:单纯卵巢切除组(OVX组),伪手术组(S组),卵巢切除加阿仑膦酸钠组(ALN组)。卵巢摘除后12周,双侧股骨远心端、胫骨近心端植入4枚种植钉,ALN组腹腔给予阿仑膦酸钠,OVX组和S组给予等量的生理盐水,分别在种植后当日、4、8、12周测量骨密度,4、8、12周分别处死动物,立即旋出种植钉,测定旋出力矩值。结果 种植体植入8周后ALN组的胫骨密度接近S组,并且与OVX组有显著性差异(P<0.05);而12周时ALN组的胫骨和股骨密度都接近S组水平,与OVX组相比有显著性差异(P<0.05)。同时,8周时胫骨的旋出力矩值在ALN组已接近S组,并与OVX组有显著性差异(P<0.05);12周时,胫骨和股骨的旋出力矩值在ALN组已接近S组,并与OVX组有显著性差异(P<0.05)。结论 阿仑膦酸钠的全身应用对骨质疏松种植体的骨结合具有显著的加强作用。
骨性结合; 阿仑膦酸钠; 种植体; 旋出力矩
骨质疏松症是影响老年人以及绝经后妇女健康和生活质量的主要疾病之一,也是与种植修复关系最为密切的骨代谢性疾病[1],阿仑膦酸钠(Alendronate sodium)作为第3代二磷酸盐的代表被广泛的应用于治疗骨质丧失性疾病,以减少骨吸收、增加骨密度。阿仑膦酸钠增强全身骨重建的能力能否在种植体的骨结合中发挥作用?本实验旨在通过实验种植体旋出力矩测试种植体骨结合强度,研究阿仑膦酸钠对骨质疏松动物模型种植体骨结合的影响。
1 材料和方法
1.1 实验动物、试剂及仪器
清洁级5月龄的日本大耳白兔(长春高新医学动物实验研究中心提供)27只,雌性,体重1.8~2.2 kg。阿仑膦酸钠(美国默沙东公司提供),速眠新、陆醒宁(长春军事科学院军事兽医研究所)。螺纹种植钉(纯钛无表面处理,直径1.2mm,长度6mm),种植器械(北京莱顿公司提供),天平和BMD400E型骨密度仪(长春一汽总医院),BTG60CN型扭矩测试仪(量程5~60N·cm,Tohnichi公司,日本)。
1.2 实验分组及模型的建立
实验动物分笼喂养,自由饮水。室温控制在25℃左右。随机分为3组,每组9只,单纯卵巢切除组(OVX组),阿仑膦酸钠组(ALN组):全麻下切除兔双侧卵巢,丝线结扎血管,拉拢缝合创口撒青霉素,分层关闭创口。伪手术组(S组):同样术式只切除卵巢周围等量脂肪组织,不切除卵巢。术后抗炎治疗4 d,常规饮食。
1.3 种植体的植入
卵巢摘除12周后,全麻动物,取仰卧位固定于手术台上,备皮,强力碘消毒,常规铺巾。在股骨远心端,胫骨近心端沿长轴切开皮肤皮下组织,长各约10mm,钝性分离至骨膜面,切开骨膜,小心剥离。暴露股骨远心端,胫骨近心端的骨面。备孔,以5 N·cm旋入锁紧种植钛钉,术后初期稳定性好,不松动(图1)。

图1 种植术后大体观察Fig 1 General observation after implant installation
2处分层严密缝合。术后立即肌注青霉素40万单位,观察伤口出血肿胀情况。术后3 d每日肌注青霉素40万单位,局部碘伏消毒,预防伤口感染,常规护理。ALN组:种植术后用注射器腹腔注射阿仑膦酸钠0.5mg·kg-1,每3 d 1次,注射剂量严格按照当天体重执行。OVX组和S组:注射等量的生理盐水,直到实验结束。
1.4 骨密度测试
分别于种植术当日术中、术后第4、8和12周全麻动物取其种植体旁5mm处股骨和胫骨(每次取的位置接近,非同一位置),将所有标本均磨到薄厚一致,游标卡尺测得厚约1.5mm,将其夹持于骨密度仪上,骨密度仪自动分析除去软组织差异,进行骨密度测试。
1.5 旋出力矩测试
种植钉植入4、8、12周后分别在处死动物之前,全身麻醉,取仰卧位固定动物于手术台上。于种植钉部位切开皮肤,小心剥离至骨膜,露出种植钉。固定,使之不能移动而影响实验结果。用扭力测试仪(图2)读取胫骨和股骨处的旋出力矩值,力矩的值取种植体旋出克服最大阻力时的峰值,所有操作均采取单盲测试。

图2 BTG60CN型扭力测试仪Fig 2 Tohnichi BTG60CN torque wrench
1.6 统计学分析
2 结果
2.1 实验动物大体观察
所有动物经过2次手术都存活完好。在种植愈合过程中,2只OVX组动物左腿胫骨发生骨折,骨痂愈合,种植体未形成骨结合,其数据未计入。取OVX组动物双侧下颌骨观察,均未发生颌骨坏死。
2.2 骨密度测试结果
应用阿仑膦酸钠后股骨的骨密度变化见表1,种植手术当日,术后4、8周时,ALN组和OVX组的股骨骨密度显著的低于S组(P<0.05),而术后12周时ALN组股骨骨密度与S组未见显著差异,而OVX组的股骨骨密度显著的低于ALN组和S组(P<0.05)。
表1 股骨的骨密度值Tab 1 Bone m ineral density of femur n=18,g·cm-2,±s
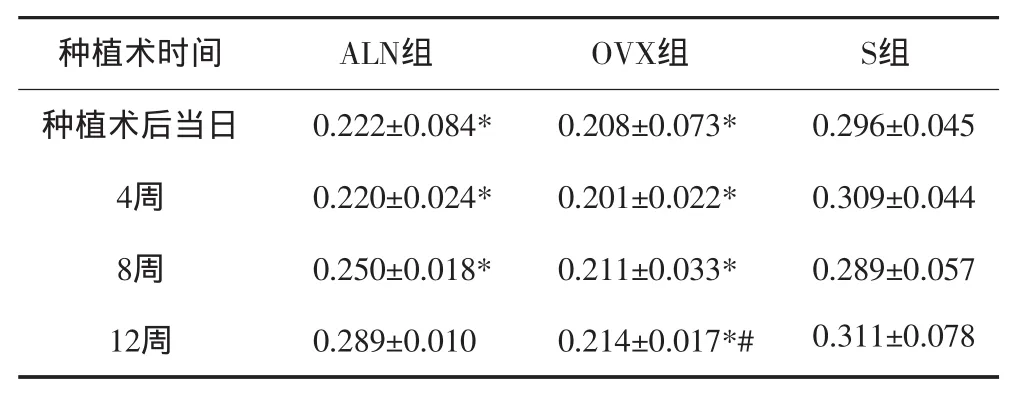
表1 股骨的骨密度值Tab 1 Bone m ineral density of femur n=18,g·cm-2,±s
注:*与S组相比,P<0.05;#与ALN组相比,P<0.05。
种植术时间 ALN组 OVX组 S组种植术后当日 0.222±0.084* 0.208±0.073* 0.296±0.045 4周 0.220±0.024* 0.201±0.022* 0.309±0.044 8周 0.250±0.018* 0.211±0.033* 0.289±0.057 12周 0.289±0.010 0.214±0.017*# 0.311±0.078
应用阿仑膦酸钠后胫骨的骨密度变化见表2,种植手术当日,术后4周时,ALN组和OVX组的胫骨骨密度显著的低于S组(P<0.05),而术后8、12周时OVX组的胫骨骨密度显著的低于ALN组和S组(P<0.05),而ALN组胫骨骨密度与S组未见显著差异。
表2 胫骨的骨密度值Tab 2 Bone m ineral density of tibia g·cm-2,±s

表2 胫骨的骨密度值Tab 2 Bone m ineral density of tibia g·cm-2,±s
注:*与S组相比,P<0.05;#与ALN组相比,P<0.05。
种植术时间 ALN组(n=18) OVX组(n=16) S组(n=18)种植术后当日 0.177±0.044* 0.189±0.037* 0.296±0.025 4周 0.169±0.028* 0.188±0.029* 0.209±0.031 8周 0.197±0.019 0.156±0.014*# 0.217±0.037 12周 0.215±0.018 0.135±0.019*# 0.211±0.054
2.3 旋出力矩实验结果
种植术后4、8、12周测得的股骨种植体旋出力矩见表3,表3显示术后4周时3组的股骨旋出力矩值无显著性差异,术后8周时OVX组股骨种植体旋出力矩值显著的低于ALN组和S组(P<0.05),术后12周时OVX组股骨种植体旋出力矩值显著的低于ALN组和S组(P<0.05),而ALN组与S组股骨种植体旋出力矩值接近,未见显著差异。
表3 股骨种植体旋出力矩值Tab 3 Torque-out values of imp lant in femur n=18,g·cm-2,±s

表3 股骨种植体旋出力矩值Tab 3 Torque-out values of imp lant in femur n=18,g·cm-2,±s
注:*与S组相比,P<0.05;#与ALN组相比,P<0.05。
种植术时间/周 ALN组 OVX组 S组4 10.95±4.34 11.63±5.39 9.44±2.69 8 15.33±2.21* 14.67±2.10* 18.27±1.76 12 24.25±1.90 18.50±3.90*# 25.66±4.97
种植术后测得的胫骨种植体旋出力矩值见表4,从表4可见:术后4周时3组的股骨旋出力矩值无显著性差异,而术后8、12周时OVX组胫骨种植体旋出扭矩值显著的低于ALN组和S组(P<0.05),ALN组与S组胫骨种植体旋出扭矩值接近,未见显著差异。
表4 胫骨种植体旋出力矩值Tab 4 Torque-out values of imp lant in tibia g·cm-2,±s
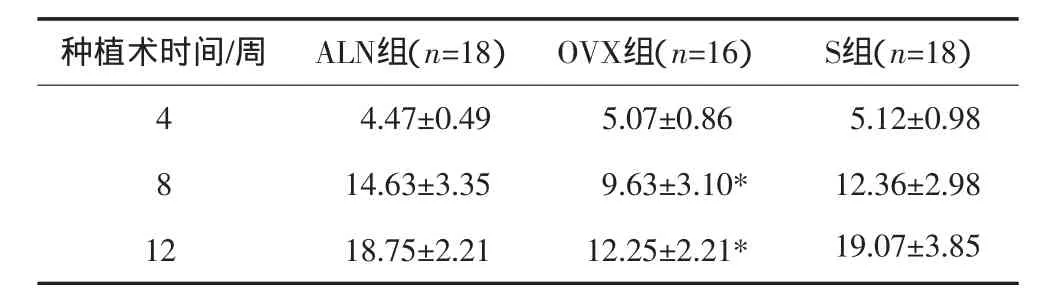
表4 胫骨种植体旋出力矩值Tab 4 Torque-out values of imp lant in tibia g·cm-2,±s
注:*与S组和ALN组相比,P<0.05。
种植术时间/周 ALN组(n=18) OVX组(n=16) S组(n=18)4 4.47±0.49 5.07±0.86 5.12±0.98 8 14.63±3.35 9.63±3.10* 12.36±2.98 12 18.75±2.21 12.25±2.21* 19.07±3.85
3 讨论
近年来一些学者在骨质疏松对种植体骨结合的影响方面做了研究[2]。骨质疏松症的骨代谢异常会导致上颌骨、下颌骨骨质疏松,导致种植体骨结合界面不稳定。骨质疏松症的骨代谢异常在骨内种植体的骨结合过程中多数表现为骨结合时间变长,但是最终可以达到骨性结合[3]。雌激素仍然是治疗骨质疏松的首选药物,其改善种植体周围的骨结合作用已有许多文献报道[4-5]。但是雌激素会增加子宫内膜癌的患病率,不仅增加了患者的疑虑,也给内分泌专科医生用药带来了困难[6]。阿仑膦酸钠是雌激素良好的替代药物,疗效较其更明显。研究[7]表明:阿仑膦酸钠作用于破骨细胞,影响破骨细胞内某些酶或信号传递,早期就可以影响骨代谢,增加骨密度,增强健康骨小梁结构特性的作用。阿仑膦酸钠治疗后能增加骨小梁的体积分数,骨小梁厚度显著增加,但骨小梁间距保持恒定,骨小梁各向异性下降,而骨表面密度增高。同时一些学者认为阿仑膦酸钠可以在多个方面提高种植体周围骨的性能,缩短种植体骨结合的时间,有利于种植体骨结合的形成[8]。
本实验骨质疏松模型的建立所得到的相关数据的变化[9]与以往的研究[10]结果一致,胫骨、股骨骨密度在种植术前ALN组和OVX组就与S组有显著性差异(P<0.05),表明骨质疏松模型的骨密度显著的低于S组。在给予阿仑膦酸钠8周后ALN组的胫骨密度开始与S组无显著差异,而12周时ALN组的胫骨和股骨密度都与S组无显著差异。4周时骨结合未形成。所以3组旋出力矩值无显著差异,8周时胫骨的旋出力矩值在ALN组已接近S组,并和OVX组有显著性差异(P<0.05),12周时,胫骨和股骨的旋出力矩值在ALN组已接近S组,并和OVX组有显著差异(P<0.05)。由此可以看出应用阿仑膦酸钠会在12周内骨质密度得到改善,同时提高种植体的抗扭力,说明阿仑膦酸钠的应用可以加速骨质疏松状态下骨结合的形成,旋出力矩值和骨密度都有所变化,但是其相关性有待于进一步的研究。
国外研究从组织学上证实阿仑膦酸钠对疏松骨质种植体-骨界面的结合率有显著影响[11],本实验通过旋出力矩峰值从另一个方面证实了阿仑膦酸钠在骨质疏松条件下对种植体骨结合具有增强作用。Chacon等[12]发现对雌性新西兰大耳白兔用阿仑膦酸钠灌胃3个月后,旋出力矩峰值与生理盐水灌胃组无显著性差异。这更加说明阿仑膦酸钠对骨质疏松条件下种植体周围骨的影响,它可以很好地提高种植体初期的骨结合率,它为骨质疏松患者的种植修复治疗提供了一个很好的方案,对口腔种植临床有着非常重要的参考意义。
阿仑膦酸钠口服吸收极差,生物利用度大约0.7%,且食物和矿物质影响其吸收,降低吸收率。局部给药虽然减少了副作用,但是由于药物是经过血液代谢而作用于骨细胞,且局部作用的药物由于其本身的生物利用率低,加之流入组织间隙,扩散至其他部位,以及运动后的药物扩散等种种因素,使得局部给药的生物利用率更加降低。骨质疏松症对种植体的愈合有影响,骨质疏松是整个骨骼系统的疏松而不是某一个区域骨的疏松,所以采取全身给药是可行的。研究[13-15]表明:全身给予阿仑膦酸钠后会出现颌骨的骨坏死。但是这些病例都是用来治疗恶性肿瘤相关的疾病且用药剂量大,而且最近有研究表明在口腔应用二膦酸盐与下颌骨坏死的发生没有必然的联系[16]。本实验以颌骨为观察对象,在实验过程中也未发现颌骨坏死,但是应该严格的控制一切易引起颌骨骨坏死的潜在因素。
[1] Martin RB.Consensus development conference:Diagnosis,prophylaxis,and treatment of osteoporosis[J].Am J Med,1993,94(6):646-650.
[2] Lugero GG,de Falco Caparbo V,Guzzo ML,et al.Histomorphometric evaluation of titanium implants in osteoporotic rabbits[J]. Implant Dent,2000,9(4):303-309.
[3] Motohashi M,Shirota T,Tokugawa Y,et al.Bone reactions around hydroxyapatite-coated implants in ovariectomized rats[J].Oral Surg Oral Med Oral Pathol Oral Radiol Endod,1999,87(2):145-152.
[4] Nociti FH Jr,Sallum AW,Sallum EA,et al.Effect of estrogen replacement and calcitonin therapies on bone around titanium implants placed in ovariectomized rats:A histometric study[J]. Int J Oral Maxillofac Implants,2002,17(6):786-792.
[5] 戚孟春,周秀青,杜兆军,等.雌激素对骨质疏松时种植体骨愈合的影响:Ⅱ骨计量学和电镜观察[J].中国口腔种植学杂志,2002, 7(3):104-117.
QIMeng-chun,ZHOU Xiu-qing,DU Zhao-jun,et al.The effect of estrogen replacement therapy on bone healing around titanium implants in osteoporotic rats:Ⅱ bone histomorphometry and SEM observation[J].Chin J Oral Implant,2002,7(3):104-117.
[6] 王艺,贾国栋,潘可风,等.阿仑膦酸钠与雌激素对实验性骨质疏松大鼠种植体周围骨结合作用的比较研究[J].现代口腔医学杂志,2006,20(5):526-530.
WANG Yi,JIA Guo-dong,PAN Ke-feng,et al.A comparison of the effect of alendronate and estrogen on the osseointegration in ovariectomized rats[J].J Modern Stomatol,2006,20(5):526-530.
[7] Pols HA,Felsenberg D,Hanley DA,et al.Multinational,placebocontrolled,randomized trial of the effects of alendronate on bone density and fracture risk in postmenopausal women with low bone mass:Results of the FOSIT study.Fosamax International Trial Study Group[J].Osteoporos Int,1999,9(5):461-468.
[8] Giro G,Gonçalves D,Sakakura CE,et al.Influence of estrogen deficiency and its treatment with alendronate and estrogen on bone density around osseointegrated implants:Radiographic study in female rats[J].Oral Surg Oral Med Oral Pathol Oral Radiol Endod,2008,105(2):162-167.
[9] 宫琳,周延民,李春艳,等.快速建立兔骨质疏松症动物模型的方法[J].吉林大学学报:医学版,2008,34(5):903-906.
GONG Lin,ZHOU Yan-min,LI Chun-yan,et al.Method of fast establishment of rabbit osteoporotic model[J].J Jilin University:Medicine Edition,2008,34(5):903-906.
[10]Thompson DD,Simmons HA,Pirie CM,et al.FDA Guidelines and animal models for osteoporosis[J].Bone,1995,17(4 Suppl):125S-133S.
[11]Duarte PM,de Vasconcelos Gurgel BC,Sallum AW,et al.Alendronate therapy may be effective in the prevention of bone loss around titanium implants inserted in estrogen-deficient rats[J].J Periodontol,2005,76(1):107-114.
[12] Chacon GE,Stine EA,Larsen PE,et al.Effect of alendronate on endosseous implant integration:An in vivo study in rabbits [J].J Oral Maxillofac Surg,2006,64(7):1005-1009.
[13] Marx RE,Sawatari Y,Fortin M,et al.Bisphosphonate-induced exposed bone(osteonecrosis/osteopetrosis)of the jaws:Risk factors, recognition,prevention,and treatment[J].J Oral Maxillofac Surg, 2005,63(11):1567-1575.
[14] Farrugia MC,Summerlin DJ,Krowiak E,et al.Osteonecrosis of the mandible or maxilla associated with the use of new generation bisphosphonates[J].Laryngoscope,2006,116(1):115-120.
[15] Ruggiero SL,Fantasia J,Carlson E.Bisphosphonate-related osteonecrosis of the jaw:Background and guidelines for diagnosis, staging and management[J].Oral Surg Oral Med Oral Pathol Oral Radiol Endod,2006,102(4):433-441.
[16] Jeffcoat MK.Safety of oral bisphosphonates:Controlled studies on alveolar bone[J].Int JOral Maxillofac Implants,2006,21(3):349-353.
(本文编辑 汤亚玲)
Effect of Alendronate sodium on torque-out testing on im plant-bone interfaces in estrogen-deficient rabbits with alendronate system ic adm inistration
LI Chun-yan1,ZHOU Yan-min1,WANG Lin1,LI Yan-qiu1,FU Li1,GONG Lin2.(1.Implant Center,Stomatological Hospital of Jilin University,Changchun130021,China;2.Dept.of Stomatology,Central Hospital of China Aerospace Corporation,Beijing100049,China)
ObjectiveTo investigate the influence of systemic application of Alendronate sodium,a bone resorption inhibitor,on the osseointegration of implant-bone interface in estrogen-deficient rabbits through mechanical assessment.Methods27 five-month-old Japanese white female rabbits were randomly divided into three groups(9 rabbits each group).An ovariectomy group(OVX),an ovariectomy and Alendronate sodium group(ALN)and a shamed-operated group(S).12 weeks after operation,implants were installed into bilateral distal femurs and proximal tibias in each group.Alendronate sodium was administrated by intraperitoneal injection in ALN group;meanwhile equivalent of normal saline was administrated by intraperitoneal injection in OVX group and S group.Bone mineral density was measured right after the implant operation and also in 4,8,12 weeks.Torque-out values were measured in 4,8,12 weeks after animal sacrifice.Results Bone mineral density of tibias in ALN group was closed to S group and was significantly different from OVX group(P<0.05)after 8 weeks.While after 12 weeks,the bone mineral density of tibias and femurs in ALN group was both closed to S group and was significantly different from OVX group(P<0.05). The torque-out values of tibias in ALN group were closed to S group and were significantly different from OVX group(P<0.05)after 8 weeks.After 12 weeks,the torque-out values of tibias and femurs in ALN group were both closed to S group and were significantly different from OVX group(P<0.05).ConclusionSystemic application of Alendronate sodium in osteoporosis rabbits can improve the bone-implant osseointegration significantly.
osseointegration; Alendronate sodium; implant; torque-out testing
R 62
A
10.3969/j.issn.1000-1182.2011.03.003
1000-1182(2011)03-0233-04
2010-08-09;
2010-12-26
教育部留学归国人员科研启动基金资助项目(教外司留2005383号)
李春艳(1976—),女,吉林人,主治医师,博士
周延民,Tel:0431-88796025
