三维培养模型中胰岛素样生长因子-Ⅰ对人牙周膜细胞增殖及碱性磷酸酶活性的影响
2011-03-07李彦牛忠英汤楚华包博师天鹏司少艳
李彦 牛忠英 汤楚华 包博 师天鹏 司少艳
(1.解放军总医院 军医进修学院,北京 100853;
2.解放军第306医院 全军口腔疾病诊治中心;3.病理实验科,北京 100101)
三维培养模型中胰岛素样生长因子-Ⅰ对人牙周膜细胞增殖及碱性磷酸酶活性的影响
李彦1,2牛忠英2汤楚华2包博2师天鹏2司少艳3
(1.解放军总医院 军医进修学院,北京 100853;
2.解放军第306医院 全军口腔疾病诊治中心;3.病理实验科,北京 100101)
目的 了解胰岛素样生长因子-Ⅰ(IGF-Ⅰ)在三维培养条件下对人牙周膜细胞(hPDLCs)增殖及碱性磷酸酶(ALP)活性的影响。方法 通过组织块法分离培养hPDLCs。采用旋转细胞培养系统(RCCS)建立三维培养环境。将细胞分为4组,分别为阴性对照组、阳性对照组(三维培养组、IGF-Ⅰ组)、实验组(三维培养加IGF-Ⅰ组)。各组细胞分别培养1、3、5、7 d。采用甲基噻唑基四唑(MTT)法检测各组各时间点细胞增殖情况,分光光度计法检测ALP活性。结果 与阴性对照组相比,三维培养加IGF-Ⅰ组细胞增殖自3 d时显著增加(P<0.05),且高于三维培养组(P<0.05)。在培养3、5、7 d时,三维培养加IGF-Ⅰ组ALP活性显著高于阴性对照组(P<0.05);与三维培养组相比,三维培养加IGF-Ⅰ组ALP活性在3、5、7 d均显著增高(P<0.05)。结论 IGF-Ⅰ在三维培养条件下仍可显著促进hPDLCs增殖及其ALP活性。
人牙周膜细胞; 胰岛素样生长因子-Ⅰ; 增殖; 碱性磷酸酶; 三维培养
牙周炎是导致成年人失牙的主要原因,缺损牙周组织的修复催生了牙周组织工程的发展。而体外构建具有生理结构和功能的牙周组织需建立能够使细胞三维生长的培养环境,细胞三维培养体系应运而生。已有学者成功利用三维培养体系构建了与体内组织形态及功能相似的软骨组织块,并在唾液腺上皮细胞、成骨细胞、肝细胞、心肌细胞等多种细胞的三维培养上取得了进展[1-2]。笔者在前期研究中也成功地建立了人牙周膜细胞(human periodontal ligament cells,hPDLCs)的三维培养模型,并观察到三维培养环境可促进细胞增殖及成骨向分化[3]。
胰岛素样生长因子-Ⅰ(insulin-like growth factor-Ⅰ,IGF-Ⅰ)是一种重要的调控因子。研究表明:IGF-Ⅰ在牙周膜细胞外基质及血管周围有表达,并可通过自分泌及旁分泌等方式作用于靶细胞,是调节细胞增殖和分化的关键因子。本研究中分离培养了hPDLCs,通过比较各组细胞增殖及碱性磷酸酶(alkaline phosphatase,ALP)活性,探讨IGF-Ⅰ在三维培养环境中对hPDLCs增殖及成骨向分化的调控作用,并且为进一步研究体外构建牙周组织提供实验依据。
1 材料和方法
1.1 主要试剂和仪器
双抗PBS液、胎牛血清(fetal bovine serum,FBS)、DMEM培养基、谷氨酰胺、0.25%胰蛋白酶、抗坏血酸、甲基噻唑基四唑(methylthiazolyl tetrazolium,MTT)试剂(Gibco公司,美国),IGF-Ⅰ、ALP检测试剂盒、Triton X-100、考马斯亮兰(Sigma公司,美国),二甲基亚砜(dimethylsulfoxide,DMSO)、青霉素、链霉素(Amresco公司,美国),抗波形丝蛋白抗体、抗角蛋白抗体(Dako公司,美国),流式细胞分析仪(Coulter公司,美国),紫外线分光光度仪(Eppendorf公司,德国),55mL旋转细胞培养体系(rotary cell culture system,RCCS)(Synthecon公司,美国),软骨细胞微载体(Cytodex-3,GE Healthcare公司,美国)。
1.2 实验方法
1.2.1 细胞的培养和鉴定 经受试者知情同意后,收集因正畸拔除、牙周组织健康、无龋的新鲜前磨牙或第三磨牙共8颗,经双抗PBS液及DMEM液反复清洗后刮取根中1/3牙周膜组织,剪成1mm3的小块,以5mm间隔将所得组织块均匀接种于25 cm2培养瓶瓶底,翻转培养瓶,向内加入4mL DMEM培养基(含10%胎牛血清、100μmol·L-1抗坏血酸、2mmol·L-1谷氨酰胺、1×105U·L-1青霉素、1×105U·L-1链霉素)。在37℃、5%CO2和饱和湿度条件下孵育2 h,使组织块贴壁,再翻转培养瓶,3 d后更换培养液,2~3 d换液1次,细胞汇合至培养瓶80%时用胰酶消化传代,取生长良好的第1代细胞制备细胞爬片,用免疫组化SP法进行波形丝蛋白和角蛋白染色,检测细胞来源并于光镜下观察。
1.2.2 实验分组 为研究IGF-Ⅰ在三维培养环境中对hPDLCs增殖及ALP活性的影响,将细胞分为4组,分别为阴性对照组(即常规平皿培养)、阳性对照组(三维培养组和IGF-Ⅰ组)和实验组(三维培养加IGF-Ⅰ组)。预实验在三维模型中培养hPDLCs 72 h,经MTT法检测加入不同浓度IGF-Ⅰ(0.1、1、10、100μg·L-1)的各实验组细胞增殖活性与对照组(三维培养但无IGF-Ⅰ加入)的差异。分光光度计法检测各组ALP活性。结果显示各实验组增殖活性均显著高于对照组(P<0.05),0.1μg·L-1组与100μg·L-1组间细胞增殖活性差异有统计学意义(F=26.741,P<0.05)。各实验组的ALP活性均显著高于对照组(P<0.05),100μg·L-1组的ALP活性显著高于其他浓度组(F= 194.362,P<0.05)。根据预实验结果选择IGF-Ⅰ实验浓度为100μg·L-1。
1.2.3 hPDLCs的三维培养 在生物反应器中加入150 mg Cytodex-3及含10%FBS的DMEM培养基,37℃孵育2 h。将hPDLCs单细胞悬液缓慢均匀加入生物反应器中并补充新鲜DMEM培养基至半量容积。反应器重新放入37℃孵箱中孵育。12 h后从孵箱中取出反应器,补充预热的含10%FBS的α-MEM培养基,排净气泡,调整反应器旋转速度使微载体悬浮于培养液中,再将其放入37℃、5%CO2、饱和湿度培养箱内培养。
1.2.4 MTT法检测细胞增殖 上述各组分别于培养1、3、5、7 d后,将细胞置于六孔板中,加2mL培养基及MTT液(5 g·L-1)20μL混匀,细胞培养箱培养4 h。小心吸弃孔内培养液,每孔加入DMSO 0.2mL,室温下放置并振荡20min,充分溶解结晶物并混匀。酶标仪在波长490 nm下测定各孔光密度值(A值)。将每组A值的均值作为实验结果,代表细胞增殖情况。
1.2.5 分光光度计法检测ALP活性 检测时间点同MTT实验,方法如下:用0.01mol·L-1的PBS洗涤细胞3次,吸干,每孔加入50μL 0.2%的TritonX-100裂解液,37℃裂解30min,倒置显微镜下观察到细胞形态完全消失后,使用ALP检测试剂盒检测各组细胞的ALP活性。采用国际临床化学和实验室医学联盟(IFCC)推荐法测定hPDLCs的ALP活性,考马斯亮兰微板法定量测定样本中蛋白量,计算每毫克冻融蛋白中所含的ALP比活性。
1.3 统计学方法
采用SPSS 17.0软件对实验数据进行分析,计量资料应用2组独立样本t检验比较均数差异,单因素方差分析(ANOVA)法分析组间是否存在差别,存在组间差别时采用Tukey法进行组间两两比较,P<0.05为差异有统计学意义。
2 结果
2.1 细胞来源鉴定结果
培养细胞的鉴定结果为波形丝蛋白染色阳性(图1),角蛋白染色阴性(图2),证实为hPDLCs。

图1 波形丝蛋白染色阳性 SP ×100Fig 1 Staining of crinkle fibroin was positive SP ×100
图2 角蛋白染色阴性 SP ×100Fig 2 Staining of keratin was negative SP ×100
2.2 不同培养条件对hPDLCs增殖活性的影响
MTT法检测不同培养条件下hPDLCs增殖活性的结果见表1。由表1可见,在培养1、3 d时,阴性对照组与三维培养组细胞增殖差异无统计学意义(P>0.05);培养5、7 d时,三维培养组细胞增殖显著高于阴性对照组(P<0.05)。培养3、5、7 d时,三维培养加IGF-Ⅰ组细胞增殖均显著高于阴性对照组(P<0.05)。在培养3、5、7 d时,三维培养加IGF-Ⅰ组细胞增殖活性较三维培养组显著增强(P<0.05)。三维培养加IGF-Ⅰ组与IGF-Ⅰ组相比,细胞增殖差异无统计学意义。
表1 不同培养条件下IGF-Ⅰ对hPDLCs细胞增殖的影响Tab 1 The effect of IGF-Ⅰon hPDLCs proliferation in different culture conditions ±s
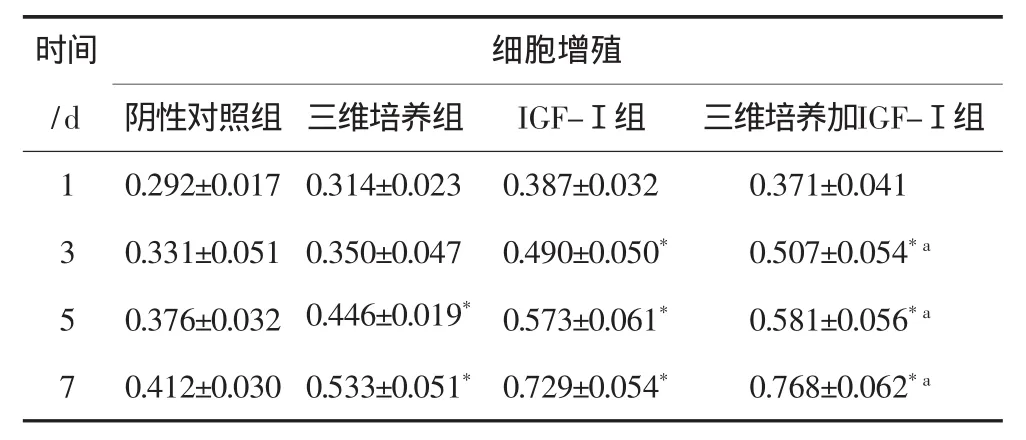
表1 不同培养条件下IGF-Ⅰ对hPDLCs细胞增殖的影响Tab 1 The effect of IGF-Ⅰon hPDLCs proliferation in different culture conditions ±s
注:*为与阴性对照组相比,P<0.05;a为与三维培养组相比,P<0.05。
时间/d细胞增殖阴性对照组 三维培养组 IGF-Ⅰ组 三维培养加IGF-Ⅰ组1 0.292±0.017 0.314±0.023 0.387±0.032 0.371±0.041 3 0.331±0.051 0.350±0.047 0.490±0.050* 0.507±0.054*a 5 0.376±0.032 0.446±0.019* 0.573±0.061* 0.581±0.056*a 7 0.412±0.030 0.533±0.051* 0.729±0.054* 0.768±0.062*a
2.3 不同培养条件对hPDLCs ALP活性的影响
与阴性对照组相比,三维培养组、IGF-Ⅰ组及三维培养加IGF-Ⅰ组ALP活性在培养3、5、7d时均显著增强(P<0.05)。与三维培养组相比,三维培养加IGF-Ⅰ组ALP活性在培养3、5、7 d显著增强(P<0.05)(图3)。
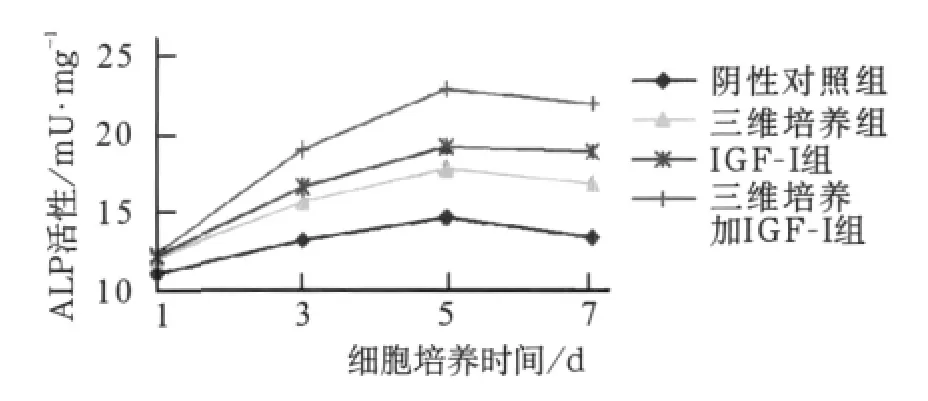
图3 不同培养条件下IGF-Ⅰ对hPDLCs ALP活性的影响Fig 3 ALP activity of hPDLCs in different culture conditions
3 讨论
hPDLCs是牙周膜的主体细胞,具有多种分化潜能[4],在维持牙周组织代谢更新的动态平衡中扮演了重要角色。牙周组织工程正是利用hPDLCs的多向分化特性,通过体外培养获得具有生理结构及功能的牙周组织。
牙周组织工程的关键在于构建三维组织形态以及调控细胞分化。RCCS可使细胞随所附着的载体旋转并悬浮于培养液中,形成培养细胞的三维环境。有研究表明:RCCS建立的三维细胞培养体系有利于细胞聚集成组织样结构,并可使细胞间桥连增多[5-6]。这一技术使体外构建三维组织结构成为可能,并已在软骨细胞、成骨细胞、心肌细胞、唾液腺上皮细胞、卵泡瘤细胞以及肝细胞等多种细胞的三维培养中取得进展[7-12]。
生理状态下,hPDLCs的各向分化受多种生长因子的共同调控。在体外三维培养条件下,模拟体内环境加入相应生长因子,将有助于诱导hPDLCs的多向分化,从而构建具有生理结构及功能的牙周组织。IGFs广泛存在于机体组织,其中IGF-Ⅰ在hPDLCs外基质及血管周围含量较高,并通过旁分泌等方式作用于周围细胞[13]。研究表明:IGF-Ⅰ在间充质细胞、成骨细胞及软骨细胞等细胞类型中扮演着重要的调控增殖、分化的角色[14-15]。研究结果显示,IGF-Ⅰ能够抑制牙周膜成纤维细胞的DNA裂解,并通过调控抗凋亡及前凋亡分子的表达而呈现出显著的抗凋亡作用,此外还观察到IGF-Ⅰ具有促进骨形成、抑制胶原降解以及介导其他生长因子调控等作用。然而上述研究均是在平皿培养环境下得出的,在三维培养模型中IGF-Ⅰ对hPDLCs的作用尚未见报道。
本实验通过建立三维细胞培养模型,比较IGF-Ⅰ在常规平皿培养与三维培养的不同条件下对hPDLCs增殖及其ALP活性的影响。通过对MTT检测结果的分析可知,与单纯的三维培养相比,加入100μg·L-1的IGF-Ⅰ可进一步促进细胞增殖。说明IGF-Ⅰ在三维培养条件下仍具有显著的促增殖作用。IGF-Ⅰ受体由四聚体糖蛋白组成,其中2个α亚基位于细胞外部,2个β亚基为跨膜蛋白。上述结果提示三维培养造成的悬浮状态并未影响IGF-Ⅰ受体与IGF-Ⅰ的结合。
ALP作为一种膜结合蛋白,是牙周膜细胞中成骨细胞亚群的标志性蛋白[16],其活性可以反映牙周组织改建的活跃程度,ALP活性检测也是评价hPDLCs功能的重要指标。本研究结果显示,无论是常规培养条件还是三维培养条件,加入IGF-Ⅰ后ALP的活性都表现为显著增强的趋势,提示IGF-Ⅰ在常规培养和三维培养条件下均可以促进hPDLCs的成骨向分化。
综合分析上述实验结果可知,三维培养加IGF-Ⅰ组在细胞增殖及ALP活性两方面都显著高于阴性对照组及阳性对照中的三维培养组,说明IGF-Ⅰ在三维培养下对hPDLCs具有促增殖和提高ALP活性的作用,并且IGF-Ⅰ与三维培养系统具有协同作用。但三维培养加IGF-Ⅰ组的细胞增殖及ALP活性与阳性对照中的IGF-Ⅰ组并无显著差异(仅在5 d时ALP活性高于IGF-Ⅰ组),这一结果提示IGF-Ⅰ与三维培养系统间的协同作用并非简单的相加关系,具体机制尚待深入研究。阳性对照的三维培养组在细胞增殖及ALP活性等方面均显著高于阴性对照组,这一结果与之前研究结果一致,表明三维培养对细胞增殖及成骨向分化具有一定的促进作用。
本研究结果提示,通过RCCS构建的三维培养模型可用于体外培养hPDLCs,且IGF-Ⅰ在此培养体系可显著促进细胞增殖及成骨向分化。但成功构建具有生理结构及功能的牙周组织需多种生长因子的共同调控,掌握其作用规律尚待深入研究。
[1] Freed LE,Martin I,Vunjak-Novakovic G.Frontiers in tissue engineering.In vitro modulation of chondrogenesis[J].Clin Orthop Relat Res,1999,(367 Suppl):S46-S58.
[2] Gorti GK,Lo J,Falsafi S,et al.Cartilage tissue engineering using cryogenic chondrocytes[J].Arch Otolaryngol Head Neck Surg,2003, 129(8):889-893.
[3] Li S,Ma Z,Niu Z,et al.NASA-approved rotary bioreactor enhances proliferation and osteogenesis of human periodontal ligament stem cells[J].Stem Cells Dev,2009,18(9):1273-1282.
[4] Seo BM,Miura M,Gronthos S,et al.Investigation of multipotent postnatal stem cells from human periodontal ligament[J].Lancet, 2004,364(9429):149-155.
[5] Boehrs J,Zaharias RS,Laffoon J,et al.Three-dimensional culture environments enhance osteoblast differentiation[J].J Prosthodont, 2008,17(7):517-521.
[6] Facer SR,Zaharias RS,Andracki ME,et al.Rotary culture enhances pre-osteoblast aggregation and mineralization[J].J Dent Res, 2005,84(6):542-547.
[7] Meyers VE,Zayzafoon M,Douglas JT,et al.RhoA and cytoskeletal disruption mediate reduced osteoblastogenesis and enhanced adipogenesis of human mesenchymal stem cells in modeled microgravity[J].J Bone Miner Res,2005,20(10):1858-1866.
[8] Hasegawa M,Yamato M,Kikuchi A,et al.Human periodontal ligament cell sheets can regenerate periodontal ligament tissue in an athymic rat model[J].Tissue Eng,2005,11(3/4):469-478.
[9] Rutzky LP,Bilinski S,Kloc M,et al.Microgravity culture condition reduces immunogenicity and improves function of pancreatic islets1[J].Transplantation,2002,74(1):13-21.
[10] Song C,Duan XQ,Li X,et al.Experimental study of rat beta islet cells cultured under simulated microgravity conditions[J].Acta Biochim Biophys Sin(Shanghai),2004,36(1):47-50.
[11] Dabos KJ,Nelson LJ,Bradnock TJ,et al.The simulated microgravity environment maintains key metabolic functions and promotes aggregation of primary porcine hepatocytes[J].Biochim Biophys Acta,2001,1526(2):119-130.
[12] Khaoustov VI,Darlington GJ,Soriano HE,et al.Induction of threedimensional assembly of human liver cells by simulated microgravity[J].In Vitro Cell Dev Biol Anim,1999,35(9):501-509.
[13] Suda T,Takahashi N,Udagawa N,et al.Modulation of osteoclast differentiation and function by the new members of the tumor necrosis factor receptor and ligand families[J].Endocr Rev,1999, 20(3):345-357.
[14] Yasuda H,Shima N,Nakagawa N,et al.Identity of osteoclastogenesis inhibitory factor(OCIF)and osteoprotegerin(OPG):A mechanism by which OPG/OCIF inhibits osteoclastogenesis in vitro [J].Endocrinology,1998,139(3):1329-1337.
[15] Simonet WS,Lacey DL,Dunstan CR,et al.Osteoprotegerin:A novel secreted protein involved in the regulation of bone density [J].Cell,1997,89(2):309-319.
[16] Ivanovski S,Haase HR,Bartold PM.Expression of bone matrix protein mRNAs by primary and cloned cultures of the regenerative phenotype of human periodontal fibroblasts[J].J Dent Res, 2001,80(7):1665-1671.
(本文编辑 胡兴戎)
The effect of insulin-like grow th factor-I on the proliferation and alkaline phosphatase activity of human periodontal ligament cells under three-dimensional culture system
LI Yan1,2,NIU Zhong-ying2,TANG Chu-hua2,BAO Bo2,SHI Tian-peng2,SI Shao-yan3.(1.Military Postgraduate Medical College,General Hospital of PLA,Beijing100853,China;2.Oral Disease Treatment Center of PLA,306Hospital of PLA,Beijing100101,China;3.Dept.of Pathology and Laboratory,306Hospital of PLA,Beijing100101,China)
ObjectiveTo investigate the effect of insulin-like growth factor-Ⅰ(IGF-Ⅰ)on the proliferation and alkaline phosphatase(ALP)activity of human periodontal ligament cells(hPDLCs)under three-dimensional(3D)culture system.MethodsThe hPDLCs were cultured from periodontium of human teeth by the outgrowth method.Rotary cell culture system(RCCS)was enrolled to set 3D culture system.Samples were set to four groups:Negative control group,positive control group(3D group,IGF-Ⅰgroup),and experimental group(3D with IGF-Ⅰgroup).Proliferation was tested with methylthiazolyl tetrazolium(MTT),and ALP activity was assayed by spectrophotometer at 1,3,5,7 d respectively.Results Compared with that of negative control group,cell proliferation increased significantly in 3D with IGF-Ⅰgroup since 3 d(P<0.05).Besides,the cell proliferation of 3D with IGF-Ⅰgroup was significantly higher than that of 3D group(P<0.05).ALP activity of 3D with IGF-Ⅰgroup was significantly higher than that of negative control group,and 3D group at 3,5,7 d(P<0.05).ConclusionIGF-Ⅰsignificantly promotes the proliferation and ALP activity of hPDLCs under 3D culture system.
human periodontal ligament cells; insulin-like growth factor-Ⅰ; proliferation; alkaline phosphatase;three-dimensional culture
R 780.2
A
10.3969/j.issn.1000-1182.2011.03.002
1000-1182(2011)03-0229-04
2010-12-28;
2011-04-05
国家自然科学基金资助项目(30870598)
李彦(1979—),女,天津人,主治医师,硕士
牛忠英,Tel:010-66355041
