冻融胚胎植入前遗传学筛查的研究
2011-03-06李晓晔白晓红
李晓晔 白晓红
天津医科大学生殖医学中心(300052)
在体外受精 -胚胎移植(IVF-ET)周期中易发生染色体异常,尤其是出现非整倍体改变,在高龄妇女中尤其突出[1]。染色体的非整倍体改变是导致胚胎移植后受孕率和着床率低而流产率高的重要原因之一。本研究通过荧光原位杂交(FISH)方法检测体外受精胚胎的 18及 X/Y等染色体的单体、三体、多倍体等异常分布情况,探讨 FISH技术对植入前胚胎进行常见染色体异常诊断的可行性与实用性,以及影响胚胎染色体异常的可能因素。
1 材料与方法
1.1 材料
选取 2007~2009年在本生殖中心冻存的 42枚正常胚胎,经患者夫妇知情同意后将其解冻。IVF组胚胎 24枚,卵细胞浆内单精子注射(ICSI)组胚胎 18枚。女方年龄 31.41±5.17(26~42)岁,男方年龄34.23±4.58(24~43)岁。按病因分类为输卵管因素 18例(42.85%),男方少弱精症 14例(33.33%),排卵障碍 6例(14.29%),双方因素 4例(9.52%)。
1.2 主要试剂及来源
胚胎解冻及培养 :G-IVF、HSA-solution、解冻液等均购自 Sigma公司;卵裂球固定:Tyrode酸性液购自 Sigma公司;PBS干粉、牛血清白蛋白(BSA)、乙酸钠、Tween-20均购自天津市康科德科技有限公司;浓盐酸、甲醇、冰乙酸等购自天津市北辰区柳滩工业区;FISH试剂:FISH DNA探针、杂交缓冲液、DAPI复染剂购自北京金菩嘉医疗科技有限公司;NP-40购自 Sigma公司;20×SSC、2×SSC、无水乙醇和氢氧化钠(NaOH)购自天津市化学试剂一厂。
1.3 方法
1.3.1 卵裂球活检 ①胚胎解冻后移入无 Ca2+,Mg2+的 PBS微滴中,于 37℃、5%CO2培养箱中培养 10min;②将胚胎转移入 G-IVF培养液微滴中,清洗两次后移入 pH 2.2 Tyrode液中消化透明带;③将酸性液清洗干净后,用毛细玻璃管反复吹打胚胎,直到卵裂球完全裂开,吸取单个卵裂球;④活检出的卵裂球移入置乙酸钠微滴的培养皿中低渗 5min。每个胚胎活检后剩余卵裂球均与活检卵裂球行同样操作。
1.3.2 卵裂球细胞固定 用口吸管将单个卵裂球移至 0.1%Tween-20/0.01M HCl裂解液中,并以裂解液为辅展液迅速转移至载玻片标定区域内。在倒置显微镜下观察细胞膨胀、破裂、核游离情况。自然干燥后固定。
1.3.3 FISH ①避光条件下制备探针混合物;②置 75℃水浴中共变性;③42℃温箱杂交过夜;④洗脱非特异性杂交;⑤ DAPI复染;⑥荧光观察和结果判断:应用 FISH 2.0分析软件进行图像分析。CSP18、CSPX和 CSPY激发信号分别呈蓝色、绿色和红色。细胞核中出现 2个荧光信号为二体型胚胎,出现一个信号为单体型胚胎,出现≥3个信号为多体型胚胎。若同一胚胎中每个卵裂球杂交信号一致,则认为整个胚胎为该染色体核型;有杂交信号而卵裂球间出现的信号不一致,则该胚胎为嵌合体。
1.3.4对照实验 随机选取 2010年 6~12月本院产前诊断中心唐氏综合征(DS)血清学筛查高风险的孕妇 20例。B超引导下行经腹羊膜腔穿刺术抽取羊水 20m l,其中 15m l行染色体核型分析,羊水细胞培养制片、G显带,并按照人类细胞遗传学国际命名体制(ISCN,1995)进行核型分析;余 2~3m l经低渗、固定处理后,直接与固定好的单个卵裂球细胞在相同条件下行 FISH检测。计数至少 100个细胞,异常细胞比例 >60%,提示该样本异常;异常细胞比例 <10%,提示该样本无异常;如果异常细胞比例 10%~60%,加大观测样本细胞数目,如实记录异常细胞比例。
1.4 统计学分析
采用 SPSS17.0统计软件包进行统计分析,计量资料用±s表示,采用χ2检验。
2 结果
2.1 FISH与核型分析结果的一致性
核型分析结果显示,20例羊水细胞培养均成功,检测出异常核型 1例:47,XXY。FISH分析结果显示,20例羊水标本均出现清晰杂交信号并成功分析得出结果,成功率 100%,1例样本指标异常(47,XXY),与核型分析一致。FISH的非整倍体敏感性为 50%,特异性为 100%,与核型分析的符合率达 95%。
2.2 胚胎活检和卵裂球固定情况
共获取单个卵裂球 39个,均细胞完整、胞核清晰,活检成功率为 92.86%(39/42)。剩余卵裂球 73个,全部进行 FISH检测。共 112只卵裂球细胞,成功固定了 97个,固定成功率为 82.61%(97/112)。
2.3 卵裂球细胞的杂交情况
固定成功的 97只卵裂球中,90只可见荧光信号,杂交成功率为 92.78%(90/97)。
2.4 受精方式与胚胎染色体异常的关系
IVF组与 ICSI组嵌合体及染色体异常发生率见表 1,两组胚胎染色体异常率(χ2=0.198,P>0.05)和嵌合体发生率(χ2=1.206,P>0.05)比较,均无明显差异。

表 1 受精方式与胚胎染色体异常的关系
2.5 年龄、超促排卵(COH)方案与胚胎染色体异常的关系
将所有患者以年龄 35岁为界分为两组,年龄≥35岁组染色体异常率(56.52%)高于 <35岁组(34.78%),但两组差异无统计学意义(χ2=1.768,P=0.184)。两组嵌合率的差异有统计学意义(43.75%vs 17.39%,χ2=6.865,P<0.05)应用促性腺激素释放激素激动剂(GnRH-a)长方案的胚胎染色体异常率(35.29%)与应用短方案(45.45%)的比较,差异无统计学意义(χ2=0.666,P>0.05)。
2.6 促性腺激素(Gn)用量和 Gn给药天数与染色体异常的关系
Gn用量为 23.98±9.171支,Gn用药天数为9.02±1.248天。按 Gn用量分为≥20支和 <20支两组;按 Gn给药天数分为≥9d和 <9d两组。由表 2可知,Gn用量与染色体异常的发生关系较密切(χ2=4.744,P=0.029),而 Gn给药天数对染色体异常的发生无明显影响(P>0.05)。
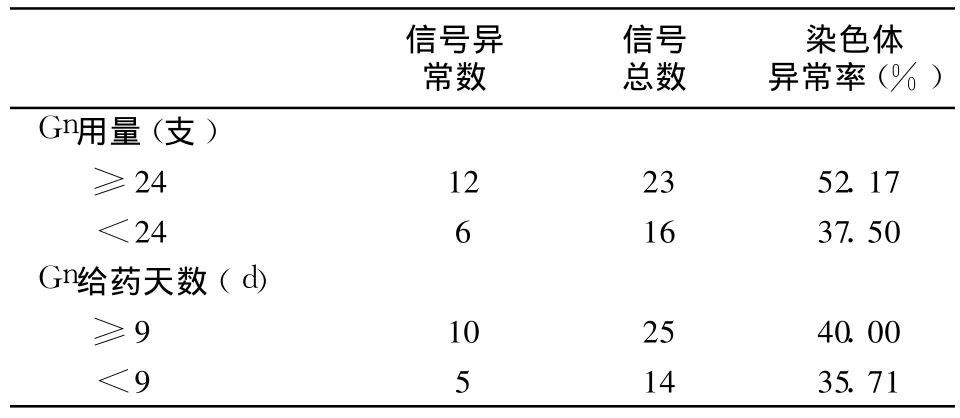
表 2 Gn用量和 Gn给药天数与染色体异常的关系
3 讨论
虽然单周期 IVF-ET技术的临床妊娠率己高达60%,总体妊娠率却依然较低。为了提高 IVF-ET成功率,降低染色体病患儿出生率,对胚胎染色体进行非整倍体筛查,选择最佳胚胎移植显得十分必要,因为胚胎质量与染色体整倍体性相关,胚胎质量越差,染色体异常率也越高[2]。在 IVF周期中,首选正常受精且质量较好的胚胎进行移植,然而尽管有些胚胎有较好的外形及发育程度,但因其染色体异常,仍导致移植失败。Baart等[3]于 2006年利用 FISH方法研究了年轻女性胚胎的 10条染色体,发现仅 36%的胚胎有正常二倍体状态。本研究中所选样本均为正常受精的优质冻存胚胎,理论上染色体应该为正常的二倍体核型,但结果发现优质冻存胚胎的染色体异常率约为 35.90%,二倍体率为 64.10%,与 Baart等的研究结果一致。另外,我们选择的研究对象是正常冻存胚胎,解冻后也可能有一定程度的染色体畸变[4]。
35岁以上,尤其 40~45岁女性卵细胞的染色体非整倍体率明显上升,确切原因尚不清楚,可能与高龄女性卵细胞的纺锤体老化和同源染色体间的交叉互换减少有关[5],也可能与环境中各种物理、化学、生物等不良因素的积累效应有关。且各种环境因素均可引起卵细胞的减数分裂异常,长期综合作用所产生的累积效应对高龄女性卵细胞产生的影响较年轻女性大[6]。本研究中,高龄患者的染色体异常嵌合率明显增高。因而对于35岁以上行 IVF-ET治疗的女性,应做好遗传咨询工作,建议对其胚胎或卵细胞进行染色体非整倍体的植入前诊断。故提高非整倍体疾病的产前诊断水平,在当前尤为重要。
COH方案对胚胎染色体异常的影响不明确。Gn用量则能影响染色体异常的发生率。本研究结果显示,促排卵药物剂量越大,胚胎染色体异常率越高。有研究表明,体外成熟(IVM)培养过程中,高浓度的卵泡刺激素(FSH)可明显提高第一次减数分裂的错误几率,从而出现更多的非整倍体卵母细胞[7]。Roberts等[8]对 IVM过程中的小鼠卵母细胞进行研究,结果表明暴露在高浓度 FSH中的卵母细胞核成熟率提高得非常明显,而胞浆成熟缺陷可能导致卵裂时的纺锤体缺陷,增加其非整倍体发生率和染色体异常发生率。另外,COH过程中患者体内激素水平发生巨大改变,卵泡液中激素水平的改变会影响卵子质量,较高的雌激素可能在 ICSI时影响卵子的正常受精[9]。
受精方式可能会影响胚胎染色体异常情况。ICSI技术是一种有创性操作,向卵母细胞注入精子的同时,可能会造成细胞骨架或纺锤体的损伤,而人为的精子选择不当、外源性物质的侵入等也会导致胚胎染色体异常的形成机会增加;非 ICSI技术因素,如有遗传学方面缺陷的精子,可能会避开自然筛选和淘汰的过程直接将缺陷垂直遗传给子代[10]。Retzloff等[11]却认为常规 IVF获得的胚胎和 ICSI获得的胚胎染色体异常率无统计学上的差异。本研究中也未得出某种受精方式会增加胚胎染色体异常的结论。因此,关于受精方式对染色体异常情况的影响,仍需要进一步大量的实验研究进行验证。
嵌合体在人类植入前胚胎中很常见,可能是影响 IVF-ET周期成功率的重要因素之一。产生机制仍不明确,应该是在胚胎发育过程中,减数分裂发生错误,导致染色体丢失。Ren等[12]发现在正常受精但不适宜移植和冷冻的胚胎中 31.4%是嵌合体。由于胚胎的来源和选用的探针不同,在各种报道中,嵌合型胚胎的比例也不甚相同。但能确定的是,随着胚胎的发育,细胞连续分裂次数的增多,发生分裂错误的机会增加,发生染色体嵌合的机会也增加。在人类正常受精的胚胎中,染色体嵌合现象非常普遍,有可能导致胚胎种植前遗传学诊断(PGD)的误诊,并降低 PGD的准确性[13]。本研究显示,胚胎的嵌合率为 20.51%,较之前研究比率偏低,可能与检测的染色体数目较少有关。Baart等[14]发现筛查更多的染色体可能提高异常胚胎的检出率。但是由于嵌合体胚胎移植后的结局也尚未明确,临床植入前遗传学筛查(PGS)中额外检查其他染色体的价值仍不明确。
传统的 PGD诊断直接对单细胞进行多重 PCR扩增,较 FISH方法更经济。但由于 DNA模板量少,难以满足一个基因多种突变、多个基因检测以及对结果行重复性验证的需要,最突出的问题是扩增失败、等位基因脱扣和易受到其他 DNA序列的污染。虽然FISH方法花费较高,增加了不孕患者的负担,但在遗传学诊断中利用 FISH法对植入前胚胎的染色体进行分析有较高的准确性,可以筛选高质量的胚胎,以利于提高植入率;可以避免性染色体异常以及三体患儿出生;还可以对患有遗传学疾病夫妇的胚胎进行筛选,排除病变胚胎,避免将疾病遗传给子代。随着分子生物学技术的迅速发展,FISH技术已得到不断改进和完善,灵敏度和分辨率不断提高,已成为生殖医学以及遗传学领域中极为重要的研究和检查手段。
1 陈竺.医学遗传学[M].北京:人民卫生出版社,2005:63,71-79,307.
2 Baltaci V,Satiroglu H,Kabukçu C,et al.Relationship between embryo quality and neuploidies[J].Reprod Biomed Online,2006,12(1):77-82.
3 Baart EB,Martini E,van den Berg I,et al.Preimplantation genetic screening reveals a high incidence of aneuploidy and mosaicism in embryos from young women undergoing IVF[J].Hum Reprod,2006,21:223-233.
4 Salumets A,Horelli-Kuitunen N,SuikkariAM,etal.Elevated incidence of chromosomally chaotic embryos among frozen-thawed preimplantation embryos[J].Eur JObstet Gynecol Reprod Biol,2004,114(1):59-63.
5 Angell R.First-meiotic-division nodisjunction in human oocytes[J].Am JHum Genet,1997,61(1):23-32.
6 张丽珠.临床生殖内分泌与不孕症[M].北京:科学出版社,2001:226-229.
7 Xu YW,Peng YT,Wang B,et al.High follic le-stimulating hormone increases aneuploidy in human oocytesmatured in vitro[J].Fertil Steril,2011,95(1):99-104.
8 Roberts R,Iatropoulou A,Ciantar D,etal.Follicle-stimulating hormone affects metaphase I chromosome alignment and increase aneuploidy inmouse oocytesmatured in vitro[J].Biol Reprod,2005,72(1):107-118.
9 Lamb JD,Zamah AM,Shen S,et al.Follicular fluid steroid hormone levels are associated with fertilization outcome after intracytoplasmic sperm injection[J].Fertil Steril,2010,94(3):952-957.
10 Plachot M,Belaisch-Allart J,Mayenga JM,et al.Outcome of conventional IVF and ICSIon sibling oocytes inm ildmale factor infertility[J].Hum Reprod,2002,17(2):362-369.
11 Retzloff MG,Hornstein MD.Is intracytoplasm ic sperm injection safe?[J].Fertil Steril,2003,80(4):851-859.
12 Ren XL,Xu YW,Zhou CQ,et al.Analysis of chromosomemosaicism in preimplantation embryos by using 2 sequential rounds of fluorescence in situ hybridization.Zhonghua Yi Xue Yi Chuan Xue Za Zhi.2007,24(6):706-708.
13 Dupont C,Segars J,DeCherney A,et al.Incidence of chromosomal mosaicism in morphologically normal nonhuman primate preimplantation embryos[J].Fertil Steril,2010,93(8):2545-2550.
14 Baart EB,van den Berg I,Martini E,et al.FISH analysis of 15 chromosomes in human day 4 and 5preimplantation embryos:the added value of extended aneuploidy detection[J].Prenat Diagn,2007,27(1):55-63.
