注射用氨磷汀安全性研究
2011-03-06
(河南省食品药品检验所,河南 郑州 450003)
注射用氨磷汀是一种有机硫化磷酸化合物,在组织中被与细胞膜结合的碱性磷酸酶水解脱磷酸后成为具有活性的代谢产物WR-1065,所含巯基具有清除组织中自由基的作用,能降低顺铂、环磷酰胺、丝裂霉素等药物的毒性[1],故笔者根据药物分类及注射剂研制要求,结合注射剂安全性试验指导原则,对注射用氨磷汀做了安全性试验,现报道如下。
1 材料
1.1 药物和试剂
注射用氨磷汀(批号为20090301,规格为0.4 g/瓶,河南省大明制药有限公司);氯化钠注射液(批号为090212211,郑州永和制药有限公司);牛血清白蛋白(批号为32093239,北京索莱宝科技有限公司);依文思蓝(批号为87-04-01,上海化学试剂采购供应站分装厂进口分装);甲醛(天津市化学试剂三厂)。
1.2 动物
豚鼠,普通级,体重300~400 g(雌雄不拘),购自北京沙河通利试验动物养殖场,许可证号为SCXK(京)2005-0003;SD大鼠,清洁级,体重180~220 g(雌雄各半),购自河南省实验动物中心,许可证号为SCXK(豫)2005-0001;日本大耳白家兔,普通级,体重2.0~3.0 kg(雌雄不拘),购自河南省康达实验动物有限公司,许可证号为SCXK(豫)2005-0002。雌雄动物分笼饲养,自由饮水。环境温度(23±2)℃,相对湿度50% ~65%,12 h光照明暗交替,通风良好。
1.3 仪器
CP225D型电子天平(德国Sartorius公司);PB4002-S型电子天平(瑞士Mettler Toledo仪器有限公司);SF2000型三按键电子数显卡尺(桂林广陆数字测控股份有限公司);RTZ-10A-RT型婴儿秤(无锡市衡器厂);DR-HW-1型电热恒温水温箱(北京西城区医疗器械厂);CH30型显微镜(日本Olympus公司)。
2 方法与结果
2.1 全身主动过敏性试验(ASA)
取健康豚鼠24只,随机分为4组(每组6只):阴性对照组给予0.9%氯化钠注射液;阳性对照组给予0.5%牛血清白蛋白;注射用氨磷汀高剂量组给予注射用氨磷汀,致敏剂量为163 mg/kg,激发剂量为326 mg/kg;注射用氨磷汀低剂量组给予注射用氨磷汀,致敏剂量为81 mg/kg,激发剂量为163 mg/kg;给药质量浓度均为57 g/L。隔日每只每次腹腔注射注射用氨磷汀0.5 mL(高剂量组致敏容积为1.0 mL),共3次,进行致敏,然后各组再分为2组,每组3只,分别在首次注射后第14日和第21日由耳缘静脉注射注射用氨磷汀1.0 mL进行攻击(高剂量组激发容积为2.0 mL)。每日观察动物的症状,静脉注射后30 min内观察每只动物的症状反应,根据过敏反应发生率和发生程度进行综合判断[2-4]。结果阳性对照组6只豚鼠均出现过敏反应,为极强阳性(++++);阴性对照组和注射用氨磷汀高、低剂量组豚鼠均未出现过敏反应。
2.2 被动皮肤过敏性试验(PCA)
抗体制备:取大鼠8只,随机分为4组(每组2只):阴性对照组给予0.9%氯化钠注射液;阳性对照组给予1%牛血清白蛋白;注射用氨磷汀高剂量组给予注射用氨磷汀,给药质量浓度为20 g/L,致敏剂量为200 mg/kg;注射用氨磷汀低剂量组给予注射用氨磷汀,给药质量浓度为10 g/L,致敏剂量为100 mg/kg(均以0.9%氯化钠注射液复溶)。隔日每只每次腹腔注射注射用氨磷汀每100 g体重1.0 mL/100 g,共3次,进行致敏。末次致敏后10 d采血,以2 000 r/min转速离心处理10 min,分离血清,合并每组大鼠血清,分别制得混合抗血清,-20℃保存,2周内备用。
试验方法:取大鼠24只,随机分为4组(每组6只),分组及给药方法同抗体制备项下方法。试验前,动物背部脱毛3 cm×4 cm,然后皮内注射各对应组的抗血清0.1 mL(抗血清的稀释度为1∶2),进行被动致敏。48 h后分别在各组尾静脉注射含1%依文思蓝的对应供试品,给药容积均为每100 g体重0.5 mL。30 min后脱臼处死各组动物,剪取背部皮肤,测量皮肤内层蓝色反应斑的直径,并进行比较。
结果:阳性对照组大鼠蓝斑直径大于5 mm,为(6.63±1.66)mm,呈阳性;高剂量组为(1.06±1.66)mm,阴性对照组和注射用氨磷汀低剂量组大鼠蓝斑直径小于5 mm,呈阴性。
2.3 体外溶血试验
2%红细胞悬液配制:取健康家兔1只,自心脏取血10 mL左右,放入含玻璃珠的干燥三角烧瓶中,振摇10 min,除去纤维蛋白原,使成脱纤血液。将去纤维蛋白血移入刻度离心管内,加5%葡萄糖注射液约10倍量,摇匀,以1 500 r/min转速离心处理15 min,倾去上清液,沉淀的红细胞再用5%葡萄糖注射液按上述方法洗涤2~3次,至上清液不显红色为止。将所得红细胞按其容积用5%葡萄糖注射液配成2%的混悬液。
试验方法:取洁净试管7支,编号,1号至5号管为供试品管,6号管为阴性对照管,7号管为阳性对照管。按表1依次加2%红细胞悬液、5%葡萄糖注射液、纯化水、受试药物,混匀后立即置(37±0.5)℃的水浴锅内温育。开始每隔15 min观察1次,1 h后,每隔1 h观察1次,最长观察3 h。
结果:阳性对照管有溶血发生,溶液呈澄明红色,管底几无红细胞残留;阴性对照管和注射用氨磷汀各管均无溶血和凝聚发生,红细胞全部下沉,上清液无色澄明。显微镜下观察,阴性对照管和注射用氨磷汀各管红细胞形态正常。
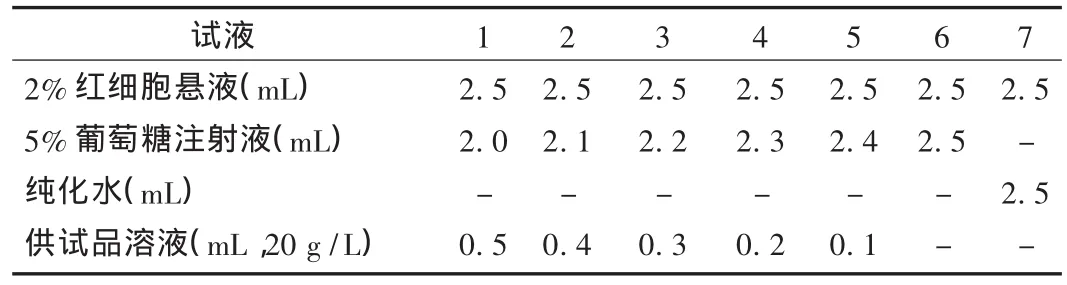
表1 体外溶血试验加药方法
2.4 血管刺激性试验
取健康家兔4只,采用同体左右侧自身对比法,于左侧耳缘静脉注射0.9%氯化钠注射液,右侧耳缘静脉缓缓注射氨磷汀40 mg/kg,给药质量浓度为20 g/L,给药容积均为2.0 mL/kg,1天1次,连续5 d。每天给药前及末次给药后48,72,96 h对动物和注射部位进行肉眼观察,观察期结束时,取2只动物的耳缘静脉近心端血管2~3 cm供病理组织学检查,留下的2只动物继续观察14 d再进行病理组织学检查,以了解刺激性反应的可逆程度。在规定的时间内观察,结果家兔双侧耳未见明显充血水肿,血管均正常。病理组织学检查显示,给药结束时左耳鳞状上皮无增生、萎缩、上皮下无充血、水肿及炎症。恢复14 d后各动物左右耳均未见血管扩张和炎细胞浸润,提示本品对家兔血管无刺激性。
3 讨论
注射药物的安全性评价是药物临床前试验研究的一个重要组成部分,主要由过敏性试验、体外溶血试验、血管刺激性试验等组成,其试验方法和评定标准可参照2005年国家食品药品监督管理局《化学药物刺激性、过敏性和溶血性研究技术指导原则》。
本试验受试药物剂量依据注射用氨磷汀使用说明书,用于化学治疗患者最大剂量,按体表面积一次600 mg/m2,溶于0.9%氯化钠注射液50 mL中静脉滴注。计算的人用剂量为16.2 mg/kg(按60 kg体重计),折算成动物等效剂量。在预试验给予此剂量未发生毒性反应的原则下,将此剂量设为受试物低剂量的致敏剂量,受试物高剂量则给予低剂量的数倍量,本试验设定的高剂量为低剂量的2倍量,激发剂量一般为致敏剂量的2~5倍。
试验结果显示,注射用氨磷汀对红细胞未见溶血和凝聚作用,全身主动过敏试验及被动皮肤过敏性试验均未见过敏反应,家兔静脉注射给药后未见血管刺激性,说明本品安全性良好,可静脉注射给药。
[1]国家药典委员会.中华人民共和国药典(二部)[M].北京:化学工业出版社,2005:附录ⅪK.
[2]陈 奇.中药药理研究方法学[M].第2版.北京:人民卫生出版社,2006:157.
[3]徐叔云,卞如廉,陈 修.药理实验方法学[M].第3版.北京:人民卫生出版社,2002:237.
[4]袁伯俊,王治乔.新药临床前安全性评价与实践[M].北京:军事医学科学出版社,1997:46.
