LiBOB基电解液在锂离子动力电池中的应用
2011-02-28邢桃峰仇卫华
连 芳,闫 坤,邢桃峰,仇卫华
(北京科技大学材料科学与工程学院,北京 100083)
新能源汽车领域对锂离子电池的电化学性能,如充放电效率、倍率性能等提出了更高的要求,安全性和环保性成为首要问题[1]。电解液的化学稳定性、安全性等是实现锂离子电池低内阻、长寿命和高安全性的重要条件[2]。目前,商品化锂离子电池所用的电解液主要由电解质锂盐和高纯有机溶剂组成。LiPF6/碳酸乙烯酯(EC)+共溶剂电解液体系在便携式电子产品中应用成熟,但无法满足大容量车用锂离子动力电池-30~52℃的工作温度等要求[3]。
在众多候选电解质锂盐中,双草酸硼酸锂LiB(C2O4)2(LiBOB[4])以独特的分子结构消除了使用LiPF6时产生HF、腐蚀电极的隐患;在以碳酸丙烯酯(PC)为溶剂的条件下,可在负极表面形成稳定的固体电解质相界面(SEI)膜,稳定石墨负极[5],电解液溶剂的选择范围更宽;LiBOB基电解液比LiPF6基电解液的热稳定性更高,可满足电动汽车(EV)或混合电动车(HEV)的高温需要,提高了锂离子电池的使用安全性。LiBOB有望替代现有商品化锂盐LiPF6,成为锂离子动力电池电解质盐,但LiBOB基电解液体系的应用还存在一些亟待解决的问题。
本文作者综述了杂质对LiBOB性能的影响,LiBOB基电解液体系溶剂的优化,以及 LiBOB与 LiMn2O4、LiFePO4正极材料的相容性等。
1 LiBOB中杂质的控制
水、硼酸、草酸及草酸酯等杂质,会影响LiBOB基电解液的性能。K.Xu等[6]发现:杂质导致使用LiBOB/环状羧酸酯电解液的HEV用大容量(8 Ah)锂离子电池的循环寿命缩短,且草酸类杂质和羧酸类残留物的阴离子分解产生的气体,会造成电池气胀。L.Yang等[7]指出,杂质会降低 LiBOB在碳酸酯类溶剂中的溶解度、增加电池的内阻,而且存在于LiBOB中的水会诱发水解反应,加剧电池性能恶化。
LiBOB在有机溶剂中的化学稳定性较好,但有水存在时会缓慢水解。W.Xu等[8]认为,LiBOB首先发生螯合环的开环反应,逐渐生成LiBO2和草酸氢锂。在高湿度的环境中,LiBOB/碳酸酯电解液会发生水解反应,生成不溶于常用碳酸酯类溶剂的B(C2O4)(OH)和LiB(C2O4)(OH)2,导致电解液体系的阻抗增加,电池的容量降低和循环稳定性变差[7]。
降低LiBOB中的杂质,尤其是水含量,可发挥LiBOB基电解液的优势。产物纯度达到要求的主要合成方法见表1。

表1 不同合成方法对LiBOB中杂质的控制对比Table 1 Contrast of different synthesis method to control the impurities in LiBOB
固相合成法原料廉价易得,合成工艺简单,易于工业化,人们常在固相合成法的基础上结合预处理锂源、预热及改变原料混合方式等方法提高产品的纯度。采用重结晶方法对产物提纯,也是控制LiBOB杂质含量的关键步骤。
M.Amereller等[13]对LiBOB水解动力学的研究表明,与B—O键相比,B—F键不易断裂,因此,将LiBOB中的部分B—O键用B—F键替换,如制成草酸二氟硼酸锂(LiBF2OB)盐,可降低水解反应能力。B—F键越多,体系越容易水解,水解反应速率常数的大小为:双[1,2-苯二醇基(2-)-O,O']硼酸锂(LiBBDB)<双[氟-1,2-苯二醇基(2-)-O,O']硼酸锂(LiBFBDB)<双[3,4,5,6-四氟-1,2-苯二醇基(2-)-O,O']硼酸锂(LiBF4BDB)。这可能是由于电负性较大的-F基使B周围的成键电子云发生偏移、电荷密度降低,造成分子极化,加剧了水解反应。
2 LiBOB基电解液的有机溶剂优化
2.1 存在的问题
LiBOB基电解液大多沿用LiPF6基电解液的有机溶剂配方,但LiBOB与 EC+线性碳酸酯的溶剂体系不匹配,无法达到锂离子动力电池对高倍率和安全性能的更高要求。
2.1.1 溶解度较小
LiBOB在线状碳酸酯中的溶解度比LiPF6小,通过减小LiBOB晶粒尺寸以及提高EC的含量,可适当提高LiBOB在EC+线性碳酸酯体系中的溶解度。环状碳酸酯EC的增多,会使电解液粘度增大、对隔膜和电极的润湿性下降、造成电池的低温性能和倍率性能下降。
2.1.2 室温下的电导率较低
室温下,LiBOB在碳酸酯类溶剂中的电导率比 LiPF6低。在EC和线性碳酸酯组成的溶剂体系中,LiBOB的溶解性及电导率都低于LiPF6,造成使用LiBOB/EC+线性碳酸酯电解液的电池大电流放电性能恶化。
2.1.3 高温使用时有气体产生
LiBOB与碳酸酯类有机溶剂配合组成的电解液在高温使用时会产生CO2和O2,造成电池气胀,降低安全性。
2.2 优化方法
寻找合适的溶剂、改变溶剂配比、拓宽工作温度范围、增大电导率、提高化学稳定性,是发挥LiBOB优点的关键。
线性羧酸酯的凝固点平均比碳酸酯低20~30℃,且黏度较小、介电常数高,在碳酸丙烯酯(PC)[14]替代 EC所组成的溶剂体系中,使用沸点更低、介电常数更高的乙酸乙酯(EA)代替碳酸二乙酯(DEC)等线性碳酸酯,可降低电解液的黏度、提高体系的电导率,如电解液0.7 mol/L LiBOB/PC+EA(质量比 4∶6)在室温下的电导率为 10 mS/cm[15]。H.G.Schweiger等[16]通过简单算法预测的 0.95 mo1/kg Li-BOB/EC+PC+DMC+EMC+EA(质量比 0.37∶8.96∶0.30∶19.62∶70.76)在25℃时的最大电导率是12.27 mS/cm。线状羧酸酯的沸点、闪点较低,液相区域比DEC等线性碳酸酯有机溶剂小。线性羧酸酯较活泼,在金属锂负极上的稳定性差,高温时还可能与碳酸酯类溶剂发生反应。
由于LiBOB在碳酸酯溶剂中存在以上问题,人们对以γ-丁内酯(GBL)为代表的环状羧酸酯等溶剂体系进行了研究。GBL作为溶剂的优势主要有:①熔点和沸点分别为-43.53℃和204℃,液程温度范围宽;②熔点低于室温,有利于提高电解液在低温下的性能;③与EC相比,GBL更易于聚集在溶质分子周围,形成配位、发生溶剂化作用,将溶质锂盐解离,黄佳原[17]研究表明,这可能与GBL的构向可调性相关;④LiBOB在GBL中的浓度可达2.5 mol/L,电解液的电导率也有所提高。
将GBL作为添加剂加到LiBOB基电解液中,0.7 mol/L LiBOB/EC+DMC+GBL+EA(质量比 1∶1∶3∶5)电解液在室温下的电导率提高到11 mS/cm[15]。配方为LiBOB/GBL+低粘度溶剂(如腈、醚、线性碳酸酯及线性羧酸酯)的电解液,适用于石墨为负极的锂离子电池[18],可减轻电池的极化、提高电导率和放电比容量。表2列出了部分LiBOB基电解液体系在25℃时的电导率。

表2 LiBOB基电解液体系在25℃时的电导率Table 2 Conductivity of LiBOB-based electrolyte at 25℃
从表2可知,LiBOB/EC+PC+DMC+EMC+EA和Li-BOB/GBL+EA+EC体系的电导率较高,电化学稳定性较好。电解液为 1.0 mol/L LiBOB/GBL+DMC(质量比 1∶1)的Li/LiFePO4半电池,在室温下以 0.5C在 2.60~4.25 V循环,放电比容量可达115 mAh/g左右;在55℃下以0.5C循环,放电比容量为135~140 mAh/g。LiBOB+LiPF6混合锂盐电解液体系已开始在锂离子电池中小批量使用[19]。
3 LiBOB基电解液与正极材料的相容性
LiMn2O4、LiFePO4成为锂离子动力电池的候选正极材料,因此电解液与它们的相容性,成为影响正极材料性能发挥的关键因素。与负极材料不同,正极材料在电化学过程中不存在溶剂分子嵌入晶格内部的问题,而电解质组分在电极表面,尤其是高电压下的氧化分解和电极集流体的腐蚀,是正极材料在电化学过程中的主要副反应。
3.1 具有的优势
LiBOB基电解液在 LiMn2O4、LiFePO4动力电池体系中的应用,具有以下优势。
3.1.1 提高正极材料和电池的热稳定性
J.Jiang等[20]用加速燃烧法(ARC)比较了充电态正极材料的热稳定性,发现LiBOB在LiFePO4电池体系中的热稳定性较好,与充电态LiFePO4反应的起始温度为240℃,比LiPF6的起始反应温度约高50℃。在0.7 mol/L LiBOB/EC+DEC(体积比1∶1)中,掺杂Al的尖晶石LiMn2O4在温度低于250℃时没有显著的放热峰,热稳定性比在LiPF6基电解液中要好些。使用 LiBOB基电解液,在过充的情况下,LiMn2O4、LiCo1/3Ni1/3Mn1/3O2及 LiFePO4等正极材料产生的热量低于使用LiPF6基电解液时。
3.1.2 降低正极材料向电解液中的溶解
与其他正极材料,如 LiCoO2、LiNiO2等相比,尖晶石LiMn2O4、LiFePO4在 LiPF6基电解液中的溶解严重得多。在 LiPF6基电解液中,Fe2+的浓度可达6×10-4mol/L;而在LiBOB基电解液中只有3.7×10-6mol/L,因此提高了电池的循环性能、延长了电池的寿命[21]。
3.1.3 改善电池的高温循环性能
B.T.Yu等[22]发现,使用 0.8 mol/L LiBOB/EC+EMC+DEC(质量比 1∶1∶1)电解液的 LiMn2O4/Li电池在 60℃时,1C以上的倍率性能、循环性能较好,在室温和60℃时的容量利用率、容量保持率均高于使用1 mol/L LiPF6/EC+EMC+DEC(质量比1∶1∶1)电解液的电池(见图1)。
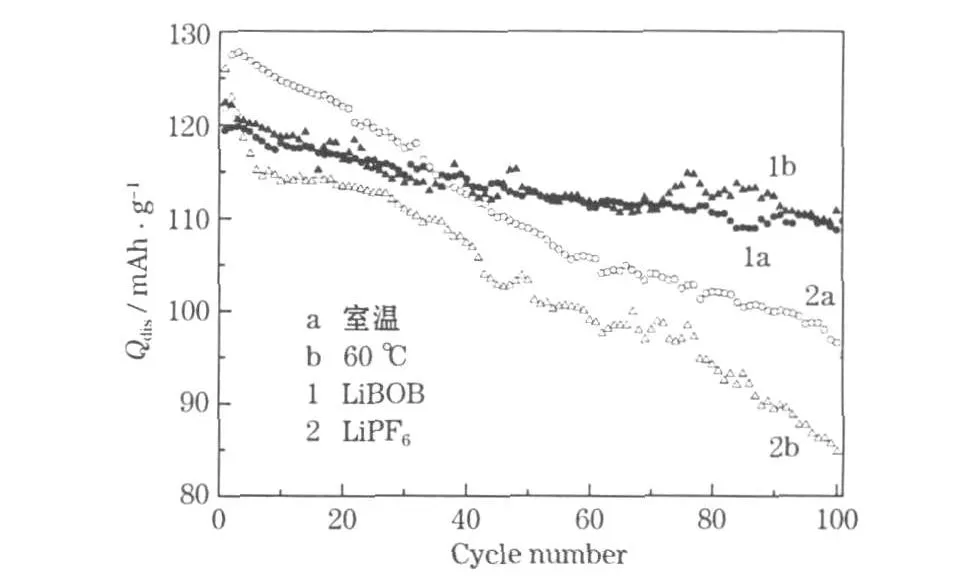
图1 使用不同电解液的Li/LiMn2O4电池的循环性能[22]Fig.1 Cycle performance of Li/LiMn2O4cell using different electrolyte
3.2 存在的问题
LiBOB基电解液在以LiMn2O4、LiFePO4为正极材料的电池体系中,还存在以下一些问题。
使用LiBOB基电解液的电池电阻较高,达40 Ω◦cm2,比使用 LiPF6基电解液电池的28 Ω◦cm2高[23],且高倍率性能不理想。康晓丽[24]研究发现,使用 LiBOB电解液体系的LiMn2O4/石墨电池,SEI膜电阻和电荷转移电阻都比使用LiPF6电解液体系的高;首次循环时的负极/电解液界面电阻明显增加,经过几次循环后,负极/电解液界面电阻稳定,而正极/电解液界面电阻增加。在LiBOB基电解液中,正极材料形成的SEI膜较疏松,在LiPF6基电解液中则较致密、电导率高。使用LiBOB基电解液的电池,电阻增大,会导致倍率性能变差。刘静静等[25]发现,LiMn1/3Ni1/3Co1/3O2在电解液 0.8 mol/L LiBOB/EC+DEC+EMC(体积比 1∶1∶1)中的0.5C(2.75~4.35 V)首次放电比容量为 160 mAh/g。Li|LiBOB/GBL|LiFePO4电池在25℃、60℃下的0.2C放电(2.60~4.25 V)比容量分别为140 mAh/g、152 mAh/g,与使用1 mol/L LiPF6/EC+DMC+EMC(体积比 1∶1∶1)电解液时接近,但高倍率下的比容量下降。引入沸点较低的EA组成GBL+EA+EC(体积比1∶1∶1)多组分溶剂,在 60℃下的5C放电(2.60~4.25 V)比容量可达120 mAh/g[24]。
在循环测试的过程中,LiMn2O4/电解液界面的阻抗基本保持稳定,电解液的电导率成为容量的主要影响因素[25]。LiFePO4电极的循环伏安特性与LiBOB/GBL基电解液中有机溶剂的组分有关,即LiBOB基电解液的组成成为影响放电比容量的主要因素。在高温下,随着溶剂中EC含量的增加,首次电极过程的极化减轻、动力学速度加快。以上现象可能与不同正极材料在LiBOB基电解液中SEI膜的形成机理和组成存在差异有关。LiBOB基电解液与正极材料相容性的规律不能一概而论,需要有针对性地深入研究。
4 结论
LiBOB作为电解质锂盐具有独特的优势,羧酸酯类有机溶剂的使用,可提高LiBOB的溶解度和电导率,因此LiBOB有望成为部分或全部替代商用LiPF6的电解质材料。为了最大限度地发挥LiBOB的优点、获得最佳的使用性能,可在以下方面进行研究:①改进合成工艺、制备高纯精细LiBOB;②优化溶剂体系;③深入研究正、负极材料在LiBOB基电解液中SEI膜的形成机理。
[1] Kang K,Meng Y S,Bréger J.Electrodes with high power and high capacity for rechargeable lithium batteries[J].Science,2006,311(17):977-980.
[2] Abraham D P,Furczon M M,Kang S H,et al.Effect of electrolyte composition on initial cycling and impedance characteristics of lithium-ion cells[J].J Power Sources,2008,180(1):612-620.
[3] Idaho National Engineering and Environmental Laboratory.Partnership of New Generation Vehicle Battery Test Manual Revision 3[M].U.S.Department of Energy DOE/ID-10597.2001.37
[4] Larush-Asraf L,Biton M,Teller H,et al.On the electrochemical and thermal behavior of lithium bis(oxalato)borate(LiBOB)solutions[J].J Power Sources,2007,174(2):400-407.
[5] Xu K,Zhang S S,Jow T R.Electrochemical impendence study of graphite/electrolyte interface formed in LiBOB/PC electrolyte[J].J Power Sources,2005,143(1-2):197-202.
[6] Xu K,Deveney B,Nechev K,et al.Evaluating LiBOB/lactone electrolytes in large-format lithium-ion cells based on nickelate and iron phosphate[J].J Electrochem Soc,2008,155(12):A959-A964.
[7] Yang L,Furczon M M,Xiao A,et al.Effect of impurities and moisture on lithium bis(oxalato)borate(LiBOB).Electrolyte performance in lithium-ion cells[J].J Power Sources,2010,195(6):1 698-1 705.
[8] Xu W,Angell C A.Weakly coordinating anions,and the exceptional conductivity of their nonaqueous solutions[J].Electrochem Solid-State Lett,2001,4(1):E1-E4.
[9] Lischka U,Wietelmann U,Wegner M.Lithium bisoxalatoborat,herstellung und verwendung als leitsalz[P].DE:19829030C1,1999-06-07.
[10] Yu B T,Qiu W H,Li F S.The electrochemical characterization of lithium bis(oxalato)borate synthesized by a novel method[J].Electrochem Solid-State Lett,2006,9(1):A1-A4.
[11] WANG Sai(王赛).LiBOB盐的制备及性能研究[D].Beijing(北京):University of Science and Technology Beijing(北京科技大学),2007.
[12] LIU Jian-wen(刘建文),LI Xin-hai(李新海),WANG Zhi-xin(王志兴),et al.双草酸硼酸锂的制备新方法、表征及性能研究[J].Journal of Inorganic Materials(无机材料学报),2009,24(4):808-812.
[13] Amereller M,Multerer M,Schreiner C,et al.Investigation of the hydrolysis of lithium bis[1,2-oxalato(2-)-O,O′] borate(Li-BOB)in water and acetonitrile by conductivity and NMR measurements in comparison to some other borates[J].J Chem Eng Data,2009,54(2):468-471.
[14] NING Ying-kun(宁英坤),YU Bi-tao(余碧涛),LI Fu-sheng(李福焱木).LiBOB/PC电解液的性能研究[J].Battery Bimonthly(电池),2006,36(2):84-86.
[15] Jow T R,Xu K,Ding M S.LiBOB-based electrolytes for Li-ion batteries for transportation applications[J].J Electrochem Soc,2004,151(10):A1 702-A1 706.
[16] Schweiger H G,Multerer M,Schweizer-Berberich M.Finding conductivity optima of battery electrolytes by conductivity measurements guided by a simplex algorithm[J].J Electrochem Soc,2005,152(3):A577-A582.
[17] HUANG Jia-yuan(黄佳原).LiBOB基电解液新型有机溶剂的研究[D].Beijing(北京):University of Science and Technology Beijing(北京科技大学),2009.
[18] Paillard E,Iojoiu C,Alloin F,et al.Poly(oxyethylene)electrolytes based on lithium pentafluorobenzene sulfonate[J].Electrochim Acta,2007,52(11):3 758-3 765.
[19] Chen Z H,Lu W Q,Liu J,et al.LiPF6/LiBOB blend salt electrolyte for high-power lithium-ion batteries[J].Electrochim Acta,2006,51(16):3 322-3 326.
[20] Jiang J,Dahn J R.ARC studies of the thermal stability of three different cathode materials:LiCoO2;Li[Ni0.1Co0.8Mn0.1]O2;and LiFePO4,in LiPF6and LiBOB EC/DEC electrolytes[J].Electrochem Commun,2004,6(1):39-43.
[21] Amine K,Liu J,Belharouak I.High-temperature storage and cycling of C-LiFePO4/graphite Li-ion cells[J].Electrochem Commun,2005,7(7):669-673.
[22] Yu B T,Qiu W H,Li F S,et al.Comparison of electrochemical properties of LiBOB and LiPF6in eletrolytes for LiMn2O4/Li cells[J].J Power Sources,2007,166(2):499-502.
[23] Amine K,Liu J,Belharouak I.Advanced cathode materials for high-power applications[J].J Power Sources,2005,146(1-2):111-115.
[24] KANG Xiao-li(康晓丽).LiBOB-GBL基电解液在LiFePO4和LiMn2O4正极中的应用[D].Beijing(北京):University of Science and Technology Beijing(北京科技大学),2009.
[25] LIU Jing-jing(刘静静),QIU Wei-hua(仇卫华),YU Ling-yan(于凌燕).锂离子电池正极材料 LiNi1/3Co1/3M n1/3O2在不同电解液中的性能研究[J].Electrochemistry(电化学),2006,12(4):373-377.
