回收LiCoO2中钴用螯合剂的合成及性能
2011-02-28湛雪辉周随安李朝辉
湛雪辉,周随安,李朝辉,方 芳
(长沙理工大学化学与生物工程学院,湖南长沙 410076)
回收废旧锂离子电池中钴的方法主要有沉淀法[1]、萃取法[2]、浮选法[3]及电解还原法[4]等。这些方法耗费巨大,且易造成二次污染。含有氨基的螯合剂由于结构特殊及具备较强的螯合能力,在水处理、重金属离子回收等方面的应用前景广泛。I.Hatay等[5]在硅胶表面引入亚胺基团,发现产物对Co2+有较好的吸附效果,并显示出良好的选择性。
本文作者对原料先后采用硝化、锌粉还原法,在乙醇与水的混合溶剂中还原得到4-甲基-2-氨基硫酚,反应过程简单,原料成本低,对产物进行FT-IR分析,并研究了回收废旧锂离子电池浸出液中Co2+的效果。
1 实验
分析仪器为Nicolet 6700红外光谱仪(美国产)、AA-6800原子吸收光谱仪(日本产),金属离子溶液酸度使用pHS-3C实验室pH计(上海产)测定。
1.1 螯合剂的制备
1.1.1 4-甲基-2-硝基硫酚的合成
将0.62 g(0.00 5 mol)对甲基苯硫酚(苏州产,>99%)溶于 15 ml二氯甲烷(湖南产,AR)、10 ml乙醇(湖南产,AR)的混合溶剂中,控制温度在约15℃,在1 h内将物质的量比为3∶2的浓H2SO4(湖南产,AR)与浓HNO3(湖南产,AR)组成的混酸滴入上述溶液中,保持温度为 15℃,继续反应3 h。反应完毕后,将反应液倒入冰水中,分液得到下层黄绿色溶液。在40℃下减压蒸馏,除去溶剂,用乙醇与水的混合溶液重结晶2次,得到黄色晶体,即产物4-甲基-2-硝基硫酚。
1.1.2 4-甲基-2-氨基硫酚的合成
在装有温度计、电动搅拌器、冷凝器的100 ml三口烧瓶中加入乙醇与蒸馏水作为混合溶剂,称量一定量的锌粉(湖南产,AR)、0.1 g NH4Cl(湖南产,AR)置于三口烧瓶中,最后加入0.7 ml冰醋酸(湖南产,AR),在70℃下预蚀 1 h,加入0.4 g所得 4-甲基-2-硝基硫酚,升温到80℃反应3 h[6-7]。反应完毕后,将反应液倒入烧杯中,用少量乙醇洗涤三口烧瓶中的锌粉,并与反应液混合,冷却至室温。向溶液中加入10 ml 1 mol/L HCl(湖南产,AR),过滤后,用 1 mol/L HCl洗涤沉淀3次,以除去Zn2+,再过滤,用蒸馏水洗涤沉淀 3次。将所得白色沉淀在-18℃下冷冻干燥1 h,称重。采用酰氯实验检测产物中的氨基值[8]。
1.2 螯合性能的研究
1.2.1 废旧锂离子电池中钴的浸出
将一块废旧锂离子电池(JLB105N926,深圳产)破碎,分离出正极材料。称量0.60 g正极材料,用二甲基乙酰胺(湖南产,AR)溶解正极中的粘结剂,过滤,将所得黑渣用蒸馏水洗涤 3次,在50℃下真空(真空度为-0.8 M Pa)干燥6 h。用20 ml 3 mol/L H2SO4+10 ml 2.4 mol/L H2O2的混合溶液浸渍黑渣1 h,过滤后,用蒸馏水将浸出液稀释至100 ml。
1.2.2 浸出液中Co2+的螯合
称量0.1 g(0.000 7 mol)4-甲基-2-氨基硫酚置于烧杯中,加入少量水及0.2 g NaOH(汕头产,AR),微热溶解。用1 mol/L HCl将溶液的pH值调至8,备用。
量取3 ml上述所得的浸出液置于烧杯中,搅拌1 h,取少部分浸出液置于西林瓶中,待测。过滤后,取少部分滤液进行检测。螯合率(A)的计算公式见式(1)。

式(1)中:ρ1、ρ2分别为螯合前后溶液中 Co2+的浓度,V1、V2分别为螯合前后溶液的体积。
1.2.3 螯合物中Co2+的回收
将螯合所得沉淀置于20 ml 1 mol/L HCl中,搅拌2 h进行解析,然后过滤,取少部分解析液进行检测。解析率(D)的计算公式见式(2)。
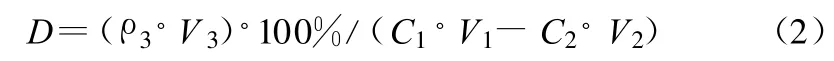
式(2)中:ρ3为解析后溶液中Co2+的浓度,V3为解析后溶液的体积。
2 结果与讨论
2.1 螯合剂的合成分析
2.1.1 产物的红外光谱分析
原料对甲基苯硫酚和制备的4-甲基-2-氨基硫酚的红外谱见图1。
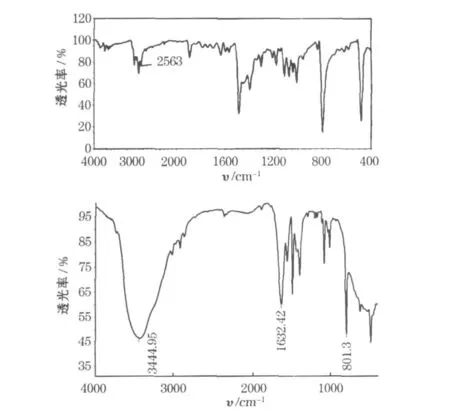
图1 原料对甲基苯硫酚和制备的4-甲基-2-氨基硫酚的红外谱Fig.1 Infrared spectra of the raw material P-thiophenol and prepared 4-methly-2-amino thiophenol
图1中,3 444 cm-1处的峰为芳香环上N—H键的对称振动峰,而1 632 cm-1、801 cm-1处的峰为 N—H 键的变形振动峰[9]。实验结果表明,氨基已经连接到苯环上。
2.1.2 反应物配比的影响
采用乙醇与水的比例为 3∶2、总体积为 15 ml,温度为80℃,考察锌粉与硝基化合物物质的量比对产率的影响,结果见图2。
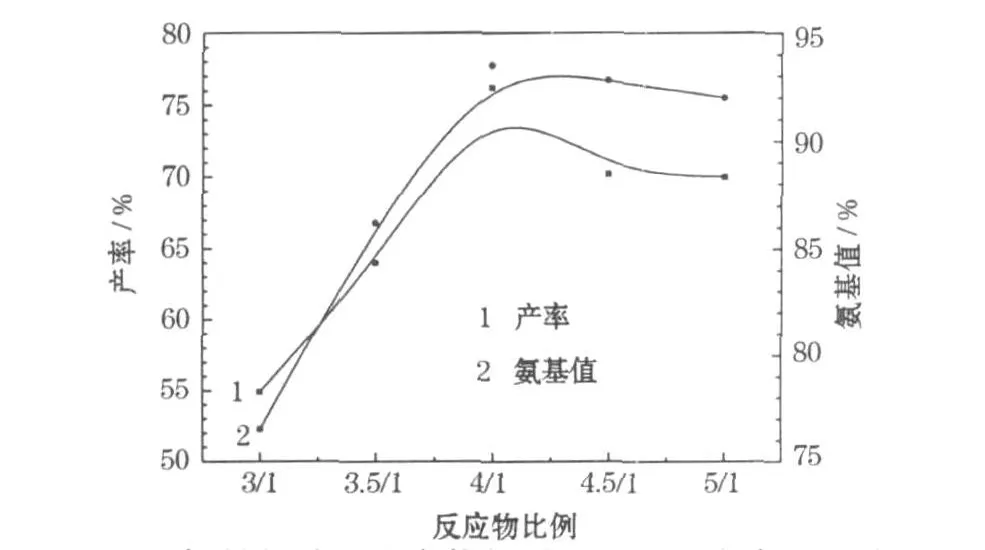
图2 锌粉与硝基化合物物质的量比对产率的影响Fig.2 The influence of the ratio of amount of substance of zinc powder and nitro compounds on yield
根据理论,1 mol硝基化合物还原需要3 mol锌粉,但从图2可知,加入理论值的锌粉得到的产物产率和氨基值较低。当锌粉与硝基化合物物质的量比为4∶1时,产率和氨基值都达到最大值;继续增加锌粉用量,产率降低。这可能是由于巯基与锌离子的键合作用,导致化合物溶解性能降低。
2.1.3 溶液中乙醇与水的体积的影响
采用锌粉与硝基化合物物质的量比为4∶1,反应温度为80℃,乙醇与水的总体积为15 ml,考察乙醇与水的比例对产率的影响,结果见图3。
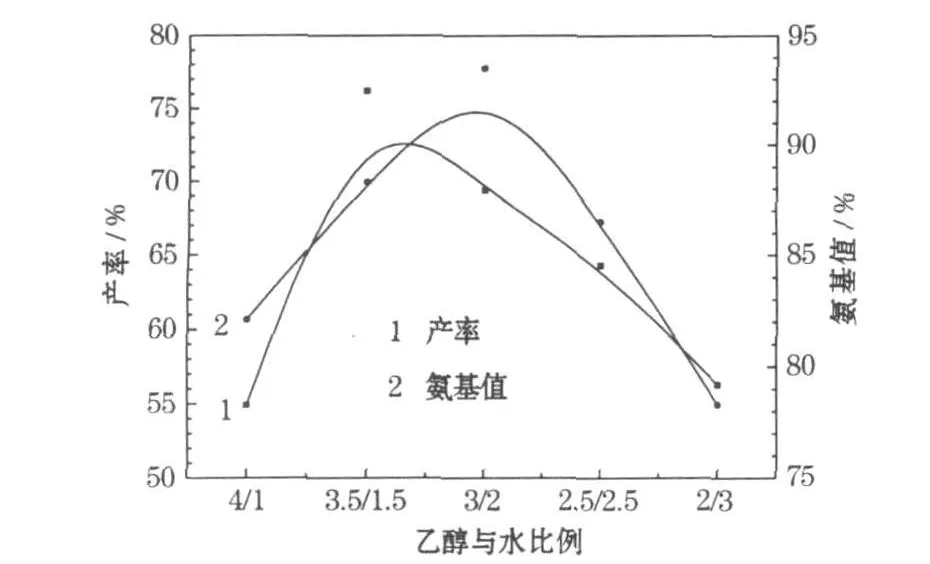
图3 乙醇与水的比例对产率的影响Fig.3 The influence of the ratio of alcohol to water on yield
从图3可知,当溶液中水较少时,产物的溶解性能较好,但溶剂的传质与传热能力降低,且溶液中醋酸的电离受影响,导致溶液中锌离子有限,产率较低;增加溶液中的水而减少乙醇,硝基化合物的溶解性能降低,不能有效地接触锌离子,且产物溶解度降低,导致氨基在空气中易被氧化。当乙醇与水的体积比为7∶3时,氨基化合物的产率达到最大值。
2.1.4 反应温度的影响
采用乙醇与水的比例为7∶3、总体积为15 ml,锌粉与硝基化合物物质的量比为4∶1,考察温度对产率的影响,结果见图4。
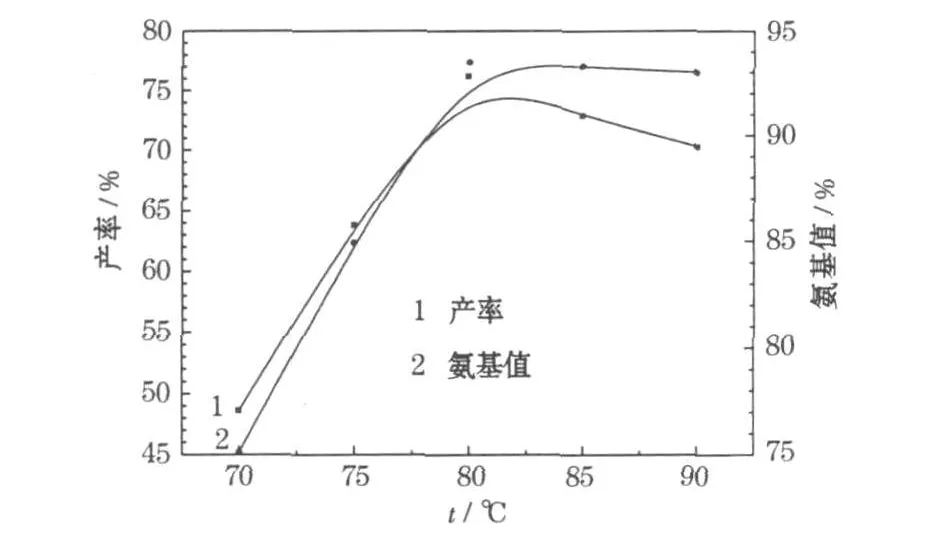
图4 温度对产率的影响Fig.4 The influence of temperature on yield
从图4可知,随着温度的升高,产率逐渐增加,在80℃时达到最大值76.2%;继续升高温度,产率反而下降。升温有利于硝基化合物及产物的溶解,有利于反应进行;温度高于80℃时产率下降,可能是温度过高,产物被氧化所致。
2.2 螯合性能研究
选择5 mlρCo2+=1 194 mg/L的溶液进行螯合,考察螯合剂用量对螯合性能的影响,结果见表1。

表1 4-甲基-2-氨基硫酚螯合性能Table 1 Chelating performance of 4-methyl-2-amino thiophenol
从表1可知,随着螯合剂的增加,螯合率增加,因此溶液中残留的Co2+含量逐渐降低;当螯合剂质量为0.25 g时,螯合趋于平衡,继续增加螯合剂质量,对螯合率的影响很小。
用20 ml 1 mol/L HCl对沉淀进行解螯合,在室温下搅拌2 h,最大解析率达到96.7%。由此可知,由于螯合剂与Co2+弱的键合作用,用HCl能得到较高的解析率。
3 结论
用浓H2SO4、浓HNO3组成的混酸硝化、锌粉还原,合成了 4-甲基-2-氨基硫酚,讨论了反应物比例、乙醇/水体积比及温度对还原反应的影响。
该反应过程工艺简单,容易操作。合成的4-甲基-2-氨基硫酚用于回收废旧离子电池中的Co2+,能与Co2+有效螯合,用1 mol/L HCl能够解析出 Co2+,达到回收利用的目的。
致谢:李飞、李侠、曹芬等同学参与本论文的研究,并做了大量的工作,在此表示感谢!
[1] GUO Li-ping(郭丽萍),HUANG Zhi-liang(黄志良),FANG Wei(方伟),et al.化学沉淀法回收 LiCoOy2中的Co和Li[J].Battery Bimonthly(电池),2005,35(4):266-267.
[2] Mantuano D P,Dorella G,Elias R C A,et al.Analysis of a hydrometallurigical route to recover base metals from spent rechargeable batteries by liquid-liquid extraction with Cyanex 272[J].J Power Sources,2006,159(2):1 510-1 518.
[3] JIN Yong-xun(金泳勋),Matsuda Hikari(松田光明),DONG Xiao-hui(董晓辉),et al.用浮选法从废旧离子电池中中回收钴锂氧化物[J].Metallic Ore Dressing Abroad(国外金属矿选矿),2004,40(7):32-37.
[4] WEI Chang-mei(韦长梅).Pd/C催化水合肼还原法制备邻氨基苯酚[J].Journal of Huaiyin Teachers College(Natural Science Edition)[淮阴师范学院学报(自然科学版)],2007,6(3):233-236.
[5] Hatay I,R Gup,M Ersoz.Silica gel functionalized with 4-phenylacetophynone 4-aminobenzoylhydrazone:synthesis of a new chelating matrix and its application as metal ion collector[J].J Hazard Mater,2008,150(3):546-553.
[6] Michael B S,Jerry M.高等有机化学——反应、机理与结构[M].LI Yan-mei(李艳梅)译.Beijing(北京):Chemical Industry Press(化学工业出版社),2009.333.
[7] WANG Qing-lian(王清廉),SHEN Feng-jia(沈凤嘉).有机化学实验[M].Beijing(北京):Higher Education Press(高等教育出版社),1994.299-301.
[8] Chen C Y,Chiang C L,Chen C R.Removal of heavy metal ions by a chelating resin containing glycine as chelating groups[J].Sep Purif Technol,2007,54(3):396-403.
[9] Erno P,Philippe B,M artin B.Structure Determination of Organic Compounds[M].Berlin:Springer,2009.293.
