孕酮干预对缺氧缺血性脑损伤新生鼠脑组织胶质纤维酸性蛋白表达的影响*
2011-02-28王小引李晓娟李东亮郭学鹏
王小引 李晓娟 李东亮 郭学鹏
新生儿缺氧缺血性脑病(hypoxic-ischemic en⁃cephalopathy,HIE)是由于围产期缺氧缺血引起胎儿、新生儿的脑损伤所致,是引起儿童神经系统慢性伤残的常见原因,已成为研究的热点[1]。孕酮(progesterone)在缺氧缺血脑损伤(hypoxicischemic brain damage,HIBD)发病过程中起着保护脑组织的作用,可拮抗自由基的产生和抑制细胞凋亡等[2],但这些研究多集中在神经细胞方面,对胶质细胞影响的研究不多,本实验采用免疫组化和RT-PCR技术研究孕酮对新生鼠HIBD脑组织中胶质纤维酸性蛋白(gial fibrillary acidic protein,GFAP)表达的影响,旨在从分子水平探讨孕酮对星形胶质细胞的保护作用及其机制。
1 材料与方法
1.1 材料 7日龄Wistar大鼠24只。雌雄不拘,体质量12~18 g,平均(14.58±3.29)g,由新乡医学院实验动物中心提供。总RNA提取试剂盒和M-MLV逆转录酶购自Takara公司,引物均由上海生物工程有限公司合成。α-actin、GFAP一抗、即用型链霉亲和素-生物素-酶复合物(strept avidin-biotin com⁃plex,SABC)免疫组化染色试剂盒及DAB显色试剂盒购自北京中杉生物工程有限公司。
1.2 造模与分组 24只大鼠随机分成3组,每组8只。假手术组平均体质量(14.06±1.36)g,仅分离左侧颈总动脉,做颈部切口,不结扎,不做缺血缺氧处理;缺氧缺血组平均体质量(14.83±1.78)g,行缺氧缺血处理;药物预防组平均体质量(14.90±1.67)g,行缺氧缺血处理且在缺氧前30 min按8 mg/kg腹腔注射浓度为0.5 g/L的孕酮溶液。各组间体质量比较差异无统计学意义(F=2.54,P>0.05)。其中,缺氧缺血组和药物预防组新生大鼠参照参考文献[3]处理,用无水乙醚麻醉后,分离左侧颈总动脉,丝线结扎,置于37℃恒温的密闭容器中,以1.5 L/min通入80 mL/L氧气和920 mL/L氮气的混合气体2.5 h,制备缺氧缺血动物模型。对模型制备后6 h内没有出现向左侧旋转运动的动物给予剔除。本研究全部造模成功。
1.3 检测指标 (1)免疫组化检测各组脑组织GFAP的表达:缺氧缺血组和药物预防组于HIBD后24 h处死,假手术组同时处死,迅速取脑,常规方法进行固定、脱水、透明、包埋、切片及烤片,GFAP免疫组织化学染色按试剂使用说明进行。GFAP蛋白表达阳性细胞的胞浆和胞核呈棕黄色,计数方法:在400倍光镜下随机计数皮质6个高倍视野,计数视野内GFAP染色阳性细胞,以平均值作为阳性细胞数。(2)RT-PCR检测各组脑组织GFAP mRNA的表达:采用总RNA提取试剂盒从大鼠的脑组织中提取总RNA,并用Takara公司的逆转录试剂盒将其逆转录合成cDNA。PCR检测GFAP mRNA的表达,β-actin为内参,上游引物5′-CGTTGACATCC GTAAAGACC-3′,下游引物5′-GCTAGGAGCCAGGGCAGTA-3′,产物长度280 bp。GFAP上游引物5′-CGTTGACATCCGTA AAGACC-3′,下游引物5′-GCTAGGAGCCAGGGCAGTA-3′,产物长度488bp。PCR扩增产物经2%琼脂糖凝胶电泳后,Bander leader 3.0凝胶图像处理软件进行灰度分析,GFAP与β-actin的产物条带灰度值之比作为反映目的基因mRNA水平的相对指标。
1.4 统计学处理 采用SPSS 12.0进行统计学处理,计量资料数据用±s表示,成组设计的两样本均数比较采用t检验,多个样本均数比较采用单因素方差分析,两两比较方差齐者采用LSD-t法,方差不齐者采用Dunnett′ s T3法,P<0.05为差异有统计学意义。
2 结果
2.1 各组大鼠GFAP表达的变化 假手术组GFAP阳性星形胶质细胞胞体瘦小且细胞数目很少,突起细短,散在分布;缺氧缺血组GFAP阳性星形胶质细胞胞体肥大、增粗、突起增多,细胞数目明显增多;药物预防组GFAP阳性星形胶质细胞也较多,胞体较大,突起较多,见图1。

2.2 各组GFAP及GFAP mRNA表达的变化 GFAP mRNA及GFAP阳性细胞数在各组大鼠中的表达水平差异有统计学意义(P<0.01),见图2、表1。

图2 各组大鼠GFAP mRNA的表达
表1 各组大鼠GFAP及GFAP mRNA表达表达比较(±s)
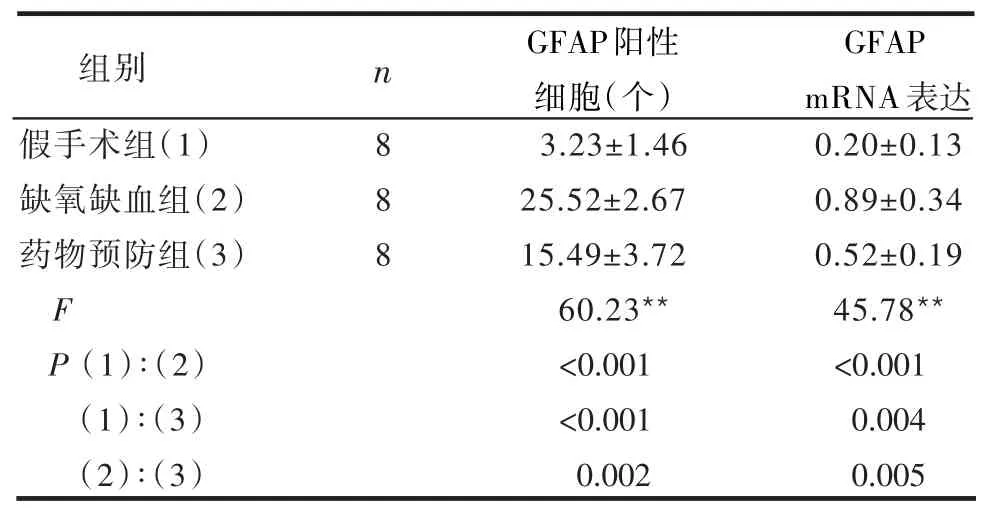
表1 各组大鼠GFAP及GFAP mRNA表达表达比较(±s)
**P<0.01
组别 n GFAP阳性细胞(个)GFAP mRNA表达假手术组(1)缺氧缺血组(2)药物预防组(3)F P(1)∶(2)(1)∶(3)(2)∶(3)888 3.23±1.46 25.52±2.67 15.49±3.72 60.23**<0.001<0.001 0.002 0.20±0.13 0.89±0.34 0.52±0.19 45.78**<0.001 0.004 0.005
3 讨论
神经系统中,胶质细胞数量为神经细胞的10~50倍,其中星形胶质细胞(astrocyte,Ast)是中枢神经系统中主要的胶质细胞,约占脑总体积的50%,数量远远超过了神经元[4-5]。其在血管、室管膜、软脑膜周围形成一个“屏障”,将神经元与外界环境隔开,其胞质的突起也紧密地围绕于突触复合体及郎飞节周围。Ast可调节细胞内外离子浓度、pH值、维持内环境的稳定、调节渗透压、供应营养物质和代谢产物、形成和维持血脑屏障、清除氧自由基、摄取神经递质、参与炎症和免疫反应,具有吞噬、神经营养等方面的作用,在神经元发育过程中指导其迁移,调控突触形成及突触传递,并在神经元损伤后的可塑性和再生方面起着重要作用。脑缺氧缺血后,Ast的分布、形态和数量以及生物功能等方面都将发生变化[4-5]。
本研究结果显示,脑缺氧缺血损伤后星形胶质细胞反应性增生,GFAP表达增加,与相关文献报道一致[4]。脑缺氧缺血后,常诱发Ast激活并活化。Ast作为中枢神经系统缺血后第一个受损细胞,在脑缺血几秒钟后即开始肥大,随着缺血的连续刺激,出现细胞形态学的改变,随后出现细胞增殖,在梗死灶、梗死灶周围出现大量反应性Ast,又称为Ast的活化,活化的Ast一方面表现为胞体肥大,胞浆增多,嗜酸性,突起增粗、分支增多[5-6];另一方面相关蛋白表达的增加,波形蛋白、GFAP是Ast的特异性标记物,在活化的Ast中显著表达,常用来鉴别中枢神经系统中损伤区和未受损区的星形胶质反应性。其中GFAP为Ast特有的细胞骨架蛋白,在缺血缺氧后的反应性胶质细胞中尤为明显,因此,GFAP被公认为Ast活化的一种特异性标志蛋白,GFAP增加意味着Ast的活化,活化的Ast可通过合成多种蛋白质、细胞因子对神经元起保护或毒性作用,对缺血性脑损伤的发展和转归具有重要意义[7]。一方面其自身分泌大量神经营养因子对脑组织损伤起着潜在的保护作用;另一方面亦可因过度增生形成胶质瘢痕,影响神经元的结构和功能的恢复,导致多种神经毒性作用产生。
目前有研究认为,脑损伤后星形胶质细胞GFAP表达增加,其早期以保护神经组织为主,晚期则以促进胶质瘢痕形成,阻碍神经再生为主[8]。本实验中PT-PCR和免疫组化的研究结果提示,孕酮在缺氧缺血性脑损伤24 h后可能通过干预反应性Ast GFAP的表达,抑制Ast的过度活化、增生与肿胀以及随之发生的Ast死亡。研究表明Ast的肿胀及死亡会造成血脑屏障功能的破坏[8]。本结果表明,孕酮可以明显减少反应性Ast缺氧缺血24 h的增生程度,且Ast没有过度活化,故其充分发挥了对细胞间液谷氨酸(Glu)的吸收和转化以及K+的缓冲作用,减少了向细胞间液Glu的释放;并抑制缺氧缺血后胶质细胞分泌一些对神经元及其他胶质细胞产生毒性作用的物质[5],这可能就是孕酮对神经元保护作用的机制。因此,孕酮对于治疗脑血管疾病有着良好的应用前景,对其神经保护作用及机制的研究,将为临床上预防和治疗缺血性脑血管病提供更有效的途径。
[1]李新娟,韩华,田香勤.孕酮干预缺氧缺血性脑损伤新生大鼠海马葡萄糖转运蛋白1、3基因的表达[J].实用儿科临床杂志,2009, 24(14):1088-1089.
[2] Stein DG,Wright DW.Progesterone in the clinical treatment of acute traumatic brain injury[J].Expert Opin Investig Drugs,2010,19 (7):847-857.
[3]连俊兰,余勤,王艳.幼年大鼠缺氧缺血性脑病动物模型的研究[J].现代中西医结合杂志,2007,16(27):3947-3950.
[4]闫世军,何晓明,李昕华,等.局灶性脑缺血预处理星形胶质细胞GFAP表达的变化[J].中国实验诊断学,2009,13(10):1345-1346.
[5]杨慧,关永源.星型胶质细胞在脑缺血性疾病中的神经元保护机制[J].中国药理学通报,2009,25(3):284-286.
[6]何璐,翟丽东,李云生.孕酮抗氧化作用对去卵巢小鼠学习记忆能力的影响[J].解剖学研究,2009,31(1):21-23
[7]Wang J,Jiang C,Li X,et al.The protective mechanism of progester⁃one on blood-brain barrier in cerebral ischemia in rats[J].Brain Res Bull,2009,79(6):426-430.
[8]Coughlan T,Gibson C,Murphy S.Progesterone,BDNF and neuro⁃protection in the injured CNS[J].Int J Neurosci,2009,119(10): 1718-1740.
