非小细胞肺癌肿瘤组织中 C巨噬细胞表达水平变化
2011-02-21罗殿中党裔武何艳娟
陈 源,罗殿中*,马 薇,党裔武,何艳娟
(1广西医科大学,南宁 530021;2广西医科大学第一附属医院;3浙江新华医院)
研究发现,在肿瘤组织中常存在大量的炎症细胞,其中以巨噬细胞为主。有报道发现,巨噬细胞与非小细胞肺癌(NSCLC)预后有关[1~4]。CD163分子是单核巨噬细胞的特异性标记。2010年 1~7月,我们观察了NSCLC中C巨噬细胞表达水平变化,并探讨其临床意义。
1 资料与方法
1.1 临床资料 47例NSCLC患者中,男28例,女 19例,年龄29~75岁,中位年龄 58岁;pTNM分期Ⅰ期 18例,Ⅱ期5例,Ⅲ期 21例,Ⅳ期 3例;鳞癌 19例,腺癌 28例。病理分级 1级 7例,2级 22例,3级18例。2005年 3月 ~2007年 8月行肿瘤切除并经病理检查证实,排除免疫性疾病及术前放、化疗和长期糖皮质激素用药史者。随访从术后开始,至 2009年 12月 30日截止,随访率 100%。患者生存时间为 90~1 575 d,中位生存期 1 041 d,3 a生存率47%。
1.3 统计学方法 采用SPSS13.0统计软件。不同部位的巨噬细胞表达与临床病理指标采用 χ2检验;生存分析资料采用Kaplan-meier及Log-rank检验法分析;独立预后因素采用Cox风险回归多因素分析。P≤0.05为差异有统计学意义。
2 结果
表1 癌巢、间质及交界区 C巨噬细胞高表达与NSCLC临床病理参数的关系
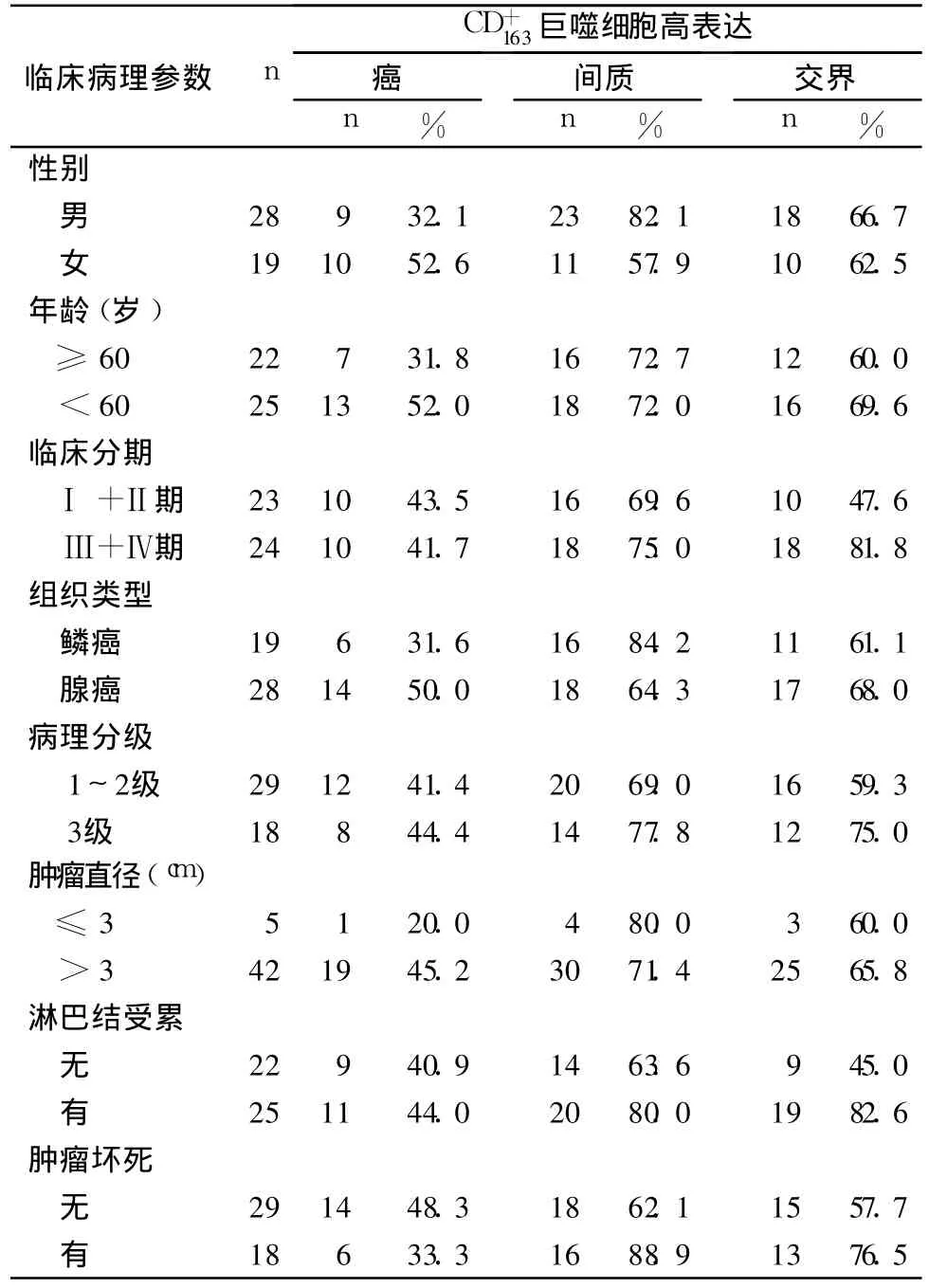
表1 癌巢、间质及交界区 C巨噬细胞高表达与NSCLC临床病理参数的关系
临床病理参数 n CD163+巨噬细胞高表达癌n%间质n%交界n%性别男28 9 32.1 23 82.1 18 66.7女19 10 52.6 11 57.9 10 62.5年龄(岁)≥60 22 7 31.8 16 72.7 12 60.0<60 25 13 52.0 18 72.0 16 69.6临床分期Ⅰ+Ⅱ期 23 10 43.5 16 69.6 10 47.6Ⅲ+Ⅳ期 24 10 41.7 18 75.0 18 81.8组织类型鳞癌 19 6 31.6 16 84.2 11 61.1腺癌 28 14 50.0 18 64.3 17 68.0病理分级1~2级 29 12 41.4 20 69.0 16 59.3 3级 18 8 44.4 14 77.8 12 75.0肿瘤直径(cm)≤3 5 1 20.0 4 80.0 3 60.0>3 42 19 45.2 30 71.4 25 65.8淋巴结受累无22 9 40.9 14 63.6 9 45.0有25 11 44.0 20 80.0 19 82.6肿瘤坏死无29 14 48.3 18 62.1 15 57.7有18 6 33.3 16 88.9 13 76.5
3 讨论
早期免疫组化研究多用 CD68作为巨噬细胞标记,但发现 CD68还可表达于肿瘤细胞、成纤维细胞、内皮细胞、粒细胞及平滑肌细胞[5,6],因此不能作为巨噬细胞的特异性标记。CD163是富含半胱氨酸清道夫受体超家族一员,特异性的表达在单核巨噬细胞系,并受到抗炎/促炎细胞因子的调控。促炎因子如IFNγ、GM-CSF等诱导CD163的表达下调,抗炎因子如IL-10、M-CSF等诱导CD163的合成及高表达。本研究发现,NSCLC不同部位均有C巨噬细胞表达,主要表达于肿瘤间质及癌与正常交界区,说明巨噬细胞来源于外周血单核细胞。在肿瘤微环境中,在生物活性分子如IL-10、M-CSF等的趋化作用下,外周血单核细胞进入肿瘤微环境,并活化为高表达 CD163的替代活化型巨噬细胞[7]。
Ma等[1]发现,NSCLC组织的癌巢、间质中均有C巨噬细胞,但均与患者预后无关,但并未分析NSCLC组织中肿瘤交界区C巨噬细胞与预后的关系。Chen等[2,3]发现,NSCLC肿瘤内的C巨噬细胞与患者预后呈负相关,但并未分析肿瘤内不同部位C巨噬细胞与预后的关系。本研究结果显示,癌巢、癌内间质C巨噬细胞与NSCLC患者预后无关,与 Ma等[1]的研究结果一致;而交界区C巨噬细胞与NSCLC患者预后呈负相关。本研究还发现,交界区的 C巨噬细胞高表达与临床分期升高呈正相关,与淋巴结受累呈正相关,进一步说明肿瘤交界区表达的巨噬细胞促进肿瘤的表达与转移。Lewis等[8]认为,在肿瘤不同区域的巨噬细胞作用不同,肿瘤交界区的巨噬细胞在交界区微环境作用下发生表型和功能改变,通过分泌一系列的生长因子、趋化因子、蛋白酶(如VEGF、MMPs、uPA)等的生物活性分子,促进交界区肿瘤周围基质的降解、血管密度增加、肿瘤细胞迁移活性的增强等,进而促进肿瘤发生表达和转移。我们认为,NSCLC患者的肿瘤交界区的巨噬细胞与患者预后呈负相关的机制可能与交界区微环境有关,交界区肿瘤细胞和巨噬细胞通过自分泌及旁分泌方式相互作用,在肿瘤细胞分泌的细胞因子(如巨噬细胞集落刺激因子)活化下交界区巨噬细胞高表达CD163分子,并分泌表皮生长因子等细胞因子作用于交界区肿瘤细胞,进而促进肿瘤的表达。
[1]Ma J,Liu L,Che G,et al.The M 1 form of tumor-associated macrophages in non-small cell lung cancer is positively associated with survival[J].BMC Cancer,2010,10(10):112.
[2]Chen JJ,Lin YC,Yao PL,et al.Tumor-associated macrophages:the double-edged sword in cancer progression[J].JClin Oncol,2005, 23(5):953-964.
[3]Chen JJ,Yao PL,Yuan A,et al.Up-regulation of tumor interleukin-8 expression by infiltratingmacrophages:its correlation with tumor angiogenesisand patient survival in non-small cell lung cancer[J]. Clin Cancer Res,2003,9(2):729-737.
[4]Toomey D,Smyth G,Condron C,et al.Infiltrating immune cells,but not tumour cells,express FasL in non-small cell lung cancer:No association with prognosis identified in 3-year follow-up[J].Int J Cancer,2003,103(3):408-412.
[5]Beranek JT.CD68is not a macrophage-specific antigen[J].Ann Rheum Dis,2005,64(2):343-344.
[6]Kunisch E,Fuhrmann R,Roth A,et al.Macrophage specificity of three anti-CD68monoclonal antibodies(KP1,EBM11,and PGM1) widely used for immunohistochemistry and flow cytometry[J].Ann Rheum Dis,2004,63(7):774-784.
[7]Mantovani A,Sozzani S,Locati M,et al.Macrophage polarization: tumor-associated macrophages as a paradigm for polarized M2mononuclear phagocytes[J].Trends Immunol,2002,23(11):549-555.
[8]Lewis CE,Pollard JW.Distinct role ofmacrophages in different tumor microenvironments[J].Cancer Res,2006,66(2):605-612.
