果糖和麦芽糖作为有氧碳源对大肠杆菌NZN111两阶段发酵中厌氧发酵的影响
2011-02-09吴辉李志敏叶勤
吴辉,李志敏,叶勤
华东理工大学 生物反应器工程国家重点实验室,上海 200237
大肠杆菌NZN111是大肠杆菌W1485的丙酮酸甲酸裂解酶 (PFL) 和乳酸脱氢酶 (LDH) 双突变株。文献报道即使在复合培养基中添加了乙酸盐它也不能在厌氧条件下代谢葡萄糖进行生长[1-2],普遍认为这是由于NZN111缺失了消耗NADH的乳酸脱氢酶以及为乙醇合成提供前体乙酰辅酶A (Ac-CoA)的丙酮酸甲酸裂解酶,整个厌氧代谢的氧化还原系统平衡遭到破坏,细胞不能够有效氧化葡萄糖经糖酵解 (EMP) 途径产生的 NADH,导致了胞内不寻常高的 NADH/NAD+比例,从而导致代谢的停滞。NZN111表达LDH改善了NADH消耗,NAD的生成使EMP途径能够运行[3]。然而NZN111能够以甘露糖、乳糖、果糖和海藻糖等与葡萄糖相同氧原状态的糖进行厌氧生长,NZN111的代谢途径 (见图 1) 中仍然存在其他一些能够消耗 NADH产生NAD+的酶,如富马酸还原酶 (FR)、苹果酸脱氢酶(MDH) 以及苹果酸酶 (ME) 等,NZN111本应该具有通过三羧酸 (TCA) 循环还原段来调节氧化还原平衡的能力。由此可以看出 NZN111不能代谢葡萄糖的主要原因可能是葡萄糖代谢调控产生的酶系统中补给途径和NADH消耗途径活性不够导致的。

图1 大肠杆菌葡萄糖厌氧发酵途径Fig. 1 Metabolic pathways in E. coli strain NZN111 under anaerobic condition. Not all the enzyme catalyzed steps and intermediates are shown. PTS: phosphotransferase transport system; PPC: PEP carboxylase; PCK: PEP carboxykinase; PK: pyruvate kinase; PPS: PEP synthetase; PDHc: pyruvate dehydrogenase complex; PTA: phosphoacetyltransferase; ACK: acetate kinase; ICL: isocitrate lyase; MS: malate synthase; MDH: malate dehydrogenase; ME: malic enzyme; FUM: fumarase; SDH: succinate dehydrogenase; and FRD: fumarate reductase. × indicates inactivated reactions. Dashed line indicates the enzyme activity formed in aerobic culture.
葡萄糖对胞内 cAMP和 cAMP的受体蛋白质(Cyclic AMP receptor protein,CRP) 水平具有调节作用,分解代谢物敏感操纵子 (Catabolite-sensitive operons) 的转录受到 CRP和 cAMP结合产物cAMP-CRP的调节,cAMP-CRP与这些基因启动子上游特定保守序列结合,激活这些操纵子的转录[4],而葡萄糖通过对胞内的腺苷酸环化酶 (Adenylate cyclase,AC) 活性[5]和crp转录表达的调控[6]来控制cAMP和CRP的浓度,从而达到对分解代谢敏感操纵子代谢阻遏作用。补给途径、TCA循环以及乙醛酸支路的酶如 MDH[7-8]、磷酸烯醇式丙酮酸 (PEP)羧激酶 (PCK)[8-10]、富马酸酶 (FUM)[11-12]、异柠檬酸裂解酶 (ICL)[8,11]等的表达都受到葡萄糖的分解代谢物阻遏作用,当大肠杆菌在糖异生碳源 (如乙酸、丙酮酸、苹果酸、琥珀酸以及延胡索酸等) 或分解代谢物阻遏效应较弱的碳源 (如甘油等) 上生长时这些酶的表达受到不同程度的诱导[13-14]。葡萄糖对大肠杆菌中心代谢途径存在强烈的分解代谢物阻遏作用,直接导致了NZN111在厌氧条件下不能高效代谢葡萄糖,有氧阶段以C2-C5等有机酸作为NZN111碳源可以诱导补给途径、TCA循环以及乙醛酸支路的酶系,恢复NZN111在厌氧条件下快速代谢葡萄糖的能力[13-14]。
葡萄糖和糖异生碳源对 NZN111代谢调节存在如此巨大差异,其他单糖或双糖作为有氧碳源对NZN111代谢途径的调节作用是否影响其厌氧代谢葡萄糖的性能?产生的效果是否与葡萄糖类似呢?本研究选用PTS依赖型的单糖果糖以及非PTS依赖的双糖麦芽糖作为研究对象,发现以这两种糖为有氧碳源培养得到的NZN111,在厌氧条件下发酵葡萄糖的性能明显要优于葡萄糖,产物分配比例与糖异生碳源培养的菌体差异较大。
1 材料与方法
1.1 菌种和培养基
本研究中采用的菌种为LDH和PFL缺失的基因工程大肠杆菌NZN111 [F+λ−rpoS396 (Am) rph-1 ΔpflB::Cam ΔldhA::Kan],由美国南伊利诺依大学(Southern Illinois University,US) 的D. P. Clark 教授提供。该菌种−20 ℃保存于25% (W/V) 甘油中。
Luria-Bertani (LB) 培养基 (g/L):胰蛋白胨10,酵母抽提物5.0,NaCl 10,pH 7.2。
基本盐 (SM) 培养基 (g/L):Na2HPO4·12H2O 15.12,KH2PO43.0,NaCl 0.5,MgSO4·7H2O 0.5,CaCl20.011,NH4Cl 1.0,1%维生素B1 0.2 mL/L以及微量元素混合液0.2 mL/L,pH 7.0。微量元素混合液 (g/L):FeSO4·7H2O 80,MnSO4·nH2O 10,AlCl3·6H2O 10,CoCl24.0,ZnSO4·7H2O 2.0,Na2MoO4·2H2O 2.0,CuCl2·2H2O 1.0,H3BO40.5,溶于3.0 mol/L HCl中。其中维生素B1溶液和微量元素混合液采用微孔滤膜 (0.22 μm) 过滤除菌,待培养基灭菌冷却后加入;葡萄糖、硫酸镁和氯化钙单独灭菌后再加入,其他无机盐混合溶液121 ℃灭菌30 min。
FSM和MSM培养基:SM培养基中分别添加5.0 g/L果糖和麦芽糖。
SMN培养基 (厌氧摇瓶发酵培养基):不含氮源的SM培养基,添加15 g/L的葡萄糖和10 g/L的NaHCO3。
5 L发酵罐使用培养基:添加4.0 g/L的NH4Cl,其他成分与 SM培养基中相同,按不同情况在培养基中分别添加15 g/L果糖和麦芽糖。
抗生素用于种子培养,培养基中卡那霉素的终浓度为30 mg/L,氯霉素的终浓度为34 mg/L。
1.2 培养方法
1.2.1 种子培养
将1 mL冷冻保存的菌种NZN111接入装有30 mL LB培养基的250 mL锥形瓶中,于37 ℃,220 r/min的摇床培养9 h。
1.2.2 摇瓶培养
整个实验主要采用的是两阶段培养法,即先有氧培养增殖菌体,然后再转入厌氧发酵[13]。各实验条件采用2~3个平行实验。有氧阶段,取2 mL活化的种子培养液转接于装有100 mL FSM或MSM的500 mL摇瓶中,于37 ℃、220 r/min摇床培养9 h。培养结束后,于4 ℃、3 300×g离心10 min,弃去上清液,收集菌体,然后重悬于厌氧SMN培养基中,使菌体密度约为4.0 g DCW/L。50 mL厌氧瓶中加入25 mL菌悬液,通过液面上方空间充以CO2来建立厌氧环境,于转速150 r/min,温度37 ℃的水浴摇床,厌氧培养10 h。
1.2.3 5 L罐培养
5 L玻璃发酵罐是华东理工大学原生化工程研究所设计制造的RIBE-5型,搅拌桨采用本实验室自行设计的自吸式搅拌桨,发酵控制软件为国家生化工程技术研究中心 (上海) 的 Tophawk发酵控制系统,数据由计算机采集。
根据5 L罐初始有氧培养的碳源的不同,转接2 mL一级种子于装有100 mL FSM或MSM培养基的500 mL锥形瓶中,37 ℃、220 r/min培养12 h,作为5 L罐两阶段培养的二级种子。
发酵罐装2.8 L培养基,接入二级种子200 mL,有氧阶段培养条件为温度37 ℃,初始搅拌转速400 r/min,初始通气量2.0 L/min,通气量和搅拌速率根据溶氧 (DO) 进行手动调整,以保证整个有氧培养过程中DO在10%以上。NZN111细胞首先在含有15 g/L果糖 (或麦芽糖) 的培养基中生长,当细胞消耗完果糖 (或麦芽糖) 后,直接转入厌氧发酵阶段。厌氧状态通过在发酵罐中通入CO2来实现:关闭空气入口,从CO2钢瓶中向发酵罐液面上方通入CO2,通气持续5.0 min,关闭钢瓶和发酵罐排气口,将发酵罐上方进气口与装有纯CO2的橡胶气袋连接。橡胶袋置于电子秤上,以计量CO2的吸收量。罐液面上方气体通过自吸式搅拌桨吸入并分散到培养基中并在发酵罐内不断循环。厌氧发酵开始时加入20 g/L葡萄糖,当葡萄糖的浓度降低到5.0 g/L左右时再次加入葡萄糖。pH通过8.0 mol/L的NaOH来控制,有氧阶段控制在7.0,厌氧阶段控制在6.3。
1.3 分析方法
菌体浓度测定采用浊度法,培养液适当稀释后,在600 nm测定其光密度 (OD600),在一定的范围内OD600与菌体干重成线性关系。
葡萄糖浓度用葡萄糖试剂盒 (上海科欣生物技术研究所) 测定。
果糖和麦芽糖浓度的测定采用高压液相色谱法(HPLC)。高压液相色谱仪是日本岛津公司的LC-10AT vp,色谱柱为Bio-Rad Aminex HPX-87H,柱温65 ℃,检测器为Knauer RI detector,流动相为5.0 mmol/L的H2SO4,流速为0.6 mL/min,进样20 μL。色谱工作站是杭州英谱科技开发有限公司开发的HS2000色谱处理软件。
发酵液中乙酸、丙酮酸和琥珀酸浓度用离子色谱法测定。离子色谱仪是Dionex ICS1500,阴离子分析柱为Ionpac AS11-HC (4 mm×250 mm),保护柱为Ionpac AG11-HC (4 mm×50 mm),DS6电导检测器以及阴离子再生抑制器ASRS ULTRAII,梯度仪为Reagent Free Controller-30,Chromeleon Client 6.8色谱工作站。柱温和检测器温度都为30 ℃,流动相为KOH,浓度梯度程序:1.0 mmol/L KOH,8.0 min;在20 min内,KOH浓度从1.0 mmol/L匀速增加到30 mmol/L;最后维持30 mmol/L KOH,5.0 min。淋洗液的流速为1.0 mL/min。
2 结果
2.1 果糖、麦芽糖对NZN111厌氧代谢的影响
摇瓶实验中,大肠杆菌NZN111在FSM和MSM培养基中有氧培养,培养9 h细胞浓度分别为1.31和1.11 g DCW/L,pH在7.3左右,离心分离的菌体重悬于SMN培养基中厌氧发酵葡萄糖。NaHCO3为琥珀酸发酵提供CO2来源,同时起着缓冲pH的作用。以果糖和麦芽糖有氧培养的NZN111细胞在厌氧阶段葡萄糖的代谢见表1。
以葡萄糖为有氧培养碳源得到的 NZN111在SMN培养基中厌氧培养只消耗了3.3 g/L的葡萄糖[13],而用果糖和麦芽糖培养的NZN111厌氧代谢葡萄糖的性能都有明显提高,葡萄糖的消耗分别增加了1.82和1.78倍,厌氧代谢终产物主要是琥珀酸和丙酮酸,琥珀酸的浓度分别达到了 5.39和5.03 g/L,琥珀酸和丙酮酸的浓度比分别为1.63∶1和1.45∶1。摇瓶实验结果表明,果糖为碳源有氧培养的 NZN111在厌氧发酵中更倾向于琥珀酸的合成,琥珀酸的得率 (0.88 mol/mol) 比用麦芽糖时(0.84 mol/mol) 略高。对比以葡萄糖为有氧碳源的情况,虽然厌氧条件下葡萄糖代谢和琥珀酸生产得到了提高,但是细胞自溶现象没有缓解,果糖为有氧碳源培养的细胞10 h后细胞浓度下降了15.2%,麦芽糖为碳源时则达到了 21.3%,而以乙酸为有氧碳源培养得到的细胞基本没有自溶现象[13]。
2.2 5 L罐中的发酵
5 L罐中的发酵同样采用两阶段发酵方法,细胞在消耗完15 g/L的果糖或麦芽糖后补加葡萄糖,直接进入厌氧发酵过程,发酵过程曲线见图 2。有氧阶段 NZN111在果糖和麦芽糖为碳源生长时的代谢差异如表2所示。
NZN111以麦芽糖为碳源有氧生长的时间比以果糖为碳源时明显缩短,但果糖为碳源时几乎没有乙酸产生。由表2可以看出,NZN111消耗麦芽糖的时间 (tSE) 为消耗果糖时间的81.4%,最大比生长速率 (μmax) 是果糖的 1.24倍;麦芽糖为碳源时菌体对碳源的得率 (YX/S) 略低,主要原因是有少量的乙酸生成;麦芽糖的比消耗速率 (qs) 比果糖高26.2%。
以果糖或麦芽糖为碳源的有氧培养结束后,得到的 NZN111菌体不经离心分离和浓缩直接转入厌氧发酵,厌氧发酵开始时添加的葡萄糖浓度为20 g/L左右,当葡萄糖浓度降低到5 g/L左右时,第2次添加葡萄糖。第1次加入葡萄糖后,果糖和麦芽糖培养的细胞葡萄糖消耗较快,葡萄糖消耗速率分别达到2.92和2.31 g/(L·h),主要产物为琥珀酸和丙酮酸,果糖培养的菌体琥珀酸和丙酮酸浓度比为1.63∶1,而麦芽糖培养的菌体则为1∶1,降低了 38.7%,两种菌体的碳流在丙酮酸节点上差异较大。这阶段果糖培养的细胞琥珀酸生产速率(1.54 g/(L·h)) 高于麦芽糖培养的细胞 (0.98 g/(L·h)),琥珀酸的得率分别为0.81和0.65 mol/mol,丙酮酸的得率分别为0.66和0.86 mol/mol。

表1 摇瓶实验中有氧阶段以果糖和麦芽糖作为碳源对NZN111厌氧代谢葡萄糖和产物形成的影响Table 1 Effects of fructose and maltose as the carbon sources in aerobic culture of E. coli NZN111 on glucose consumption and product formation in subsequent anaerobic fermentation in flasks

表2 在5 L罐两阶段培养过程中NZN111以果糖和麦芽糖为有氧碳源分批培养的代谢特性Table 2 Metabolic performances of NZN111 cultured on fructose and maltose in the aerobic phase of the two-stage cultivation
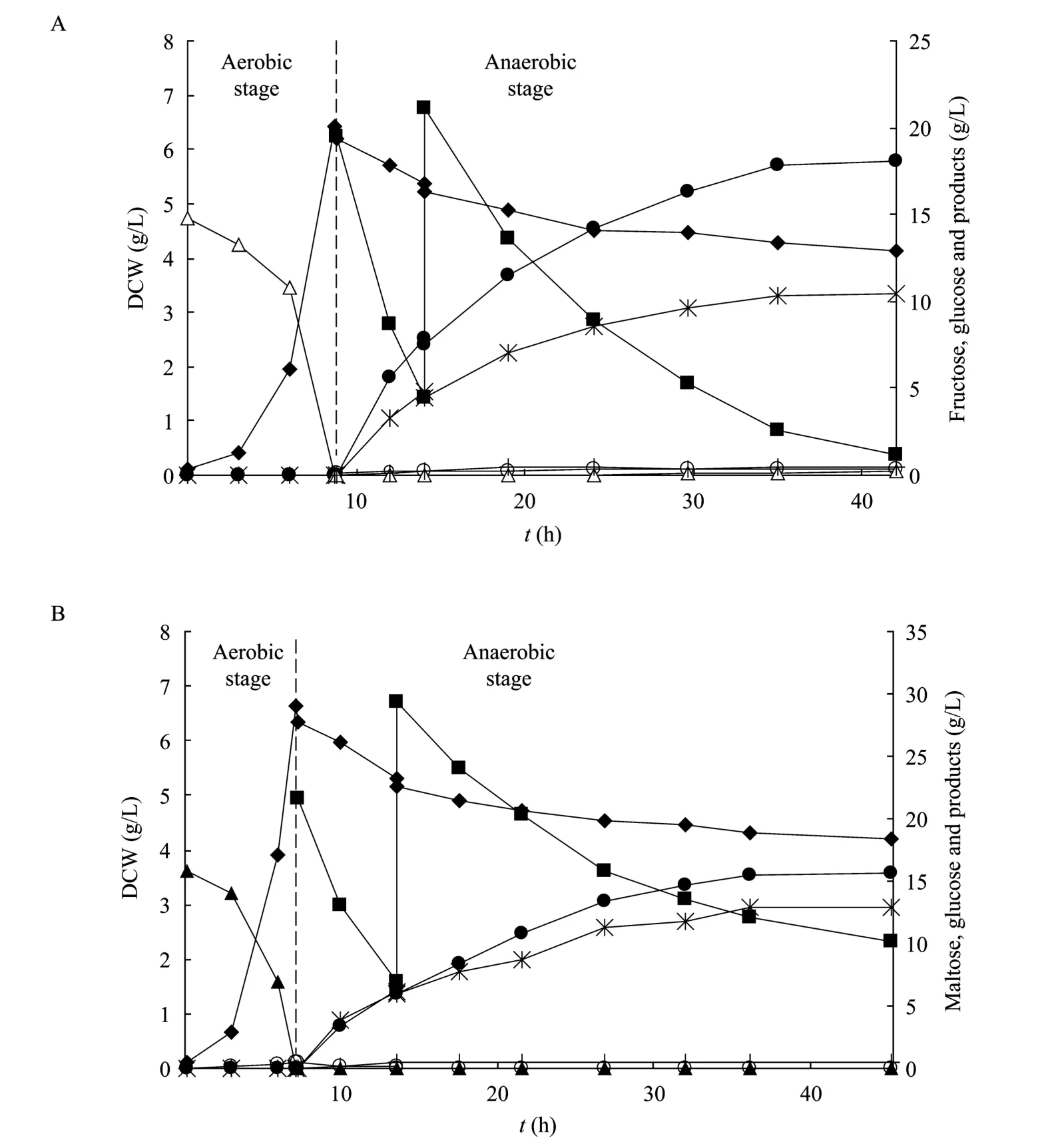
图2 NZN111在5 L发酵罐两阶段发酵过程菌体生长、葡萄糖消耗、产物生成曲线Fig. 2 Profiles of cell growth, glucose consumption, metabolites accumulation in two-stage cultivation of NZN111 in a 5 L bioreactor. (A) Fructose as the aerobic carbon source. (B) Maltose as the aerobic carbon source. △ fructose; ▲ maltose; cell density;■ glucose; ● succinic acid; *pyruvic acid; ○ acetic acid; + ethanol.
在第2次加入葡萄糖后,葡萄糖消耗速率和琥珀酸的生产速率明显降低。果糖培养的细胞基本耗完了加入的葡萄糖 (残留仅为1.21 g/L),而麦芽糖培养的细胞在厌氧发酵终了时残糖浓度还有10.2 g/L。麦芽糖培养的细胞琥珀酸和丙酮酸浓度比有所增加,达到了 1.38,整个厌氧发酵最终的比值为 1.21;果糖培养得到的菌体厌氧产物的比值增加的幅度不大 (1.76),整体较为稳定,发酵结束时的比值为 1.73。以果糖和麦芽糖为碳源有氧培养的细胞厌氧发酵阶段分别维持了33.2和38.0 h,最终琥珀酸得率分别为0.84和0.75 mol/mol,丙酮酸得率分别达到了0.65和0.83 mol/mol,琥珀酸最终浓度分别为18.0和15.7 g/L,丙酮酸最终浓度分别达到了10.5和13 g/L。
两种情况的厌氧发酵阶段都存在细胞自溶现象,第一次加糖阶段尤为明显,果糖培养的菌体下降了13.1%,麦芽糖得到的菌体下降了16.1%,这一趋势与摇瓶实验相同,发酵终了时两者细胞浓度下降相差不大 (33%左右)。
3 讨论
自然界中存在多种糖类化合物,Monod把这些糖分为两类:A类包括甘露糖、甘露醇和果糖,它们与葡萄糖同时存在于培养基中时,细菌不会出现二次生长现象,它们主要通过与葡萄糖类似的 PTS系统进入细胞;B类包括阿拉伯糖、麦芽糖、乳糖、木糖和半乳糖等,它们和葡萄糖同时加入培养基中后,细菌则表现出二次生长现象,它们通过非 PTS的透性酶系统进入细胞[15-16]。果糖通过果糖相关的PTS系统进入细胞,果糖操纵子 (fruBKA基因) 受到果糖阻遏蛋白 (Fructose repressor,FruR,也称为Cra) 的阻遏,中间代谢产物1-磷酸果糖和1,6-二磷酸果糖是FruR的效应子,它们与FruR结合后使其失活[17-18],减少了FruR的阻遏作用,诱导果糖操纵子的表达。麦芽糖是 2个葡萄糖分子以 α-1,4 糖苷键连接起来的双糖,属于非PTS系统的糖类,它进入大肠杆菌细胞内是通过周质麦芽糖结合蛋白(MalE) 和需ATP提供能量的多亚基ABC运输系统(MalFGK2),这些蛋白的表达受到 MalT蛋白正调控[19]。在转录层面,MalT的转录受到 PTS系统的调控,Mlc阻遏MalT的转录,去磷酸化的Enzyme IICBGlu与 Mlc结合使得 Mlc的阻遏性能丧失,而cAMP-CRP结合体则对MalT的转录具有激活作用,这两个葡萄糖相关的调控机制存在矛盾性,具体相互协调的作用机理至今尚不确切。在蛋白活性层面,麦芽糖和ATP对MalT蛋白具有激活作用[20]。我们考察果糖和麦芽糖作为有氧碳源对 NZN111厌氧代谢葡萄糖生产琥珀酸的影响,发现果糖和麦芽糖代谢调控效果虽然不如糖异生碳源,但可以较好恢复NZN111厌氧代谢葡萄糖性能,主要代谢产物是琥珀酸和丙酮酸。
大肠杆菌通过多种调节因子调控胞内各种分解代谢和合成代谢途径来适应不同碳源上的生长。基于目前对分解代谢调控研究的成果,分解代谢调控主要分为两类:cAMP依赖型 (cAMP-CRP) 和cAMP非依赖型 (FruR),见图 3。Perrenoud 等[22]对fruR、crp和cya敲除进行了研究,发现缺失fruR对细胞在葡萄糖上生长没有影响,而crp和cya的敲除则大大降低了葡萄糖的利用速度,减缓了细胞的生长。cAMP依赖的分解代谢阻遏调控作用对细胞代谢的影响要远大于fruR的调控作用。从cAMP依赖的分解代谢阻遏模型来看,培养基中不存在葡萄糖时,胞内磷酸化的Enzyme IIAGlu浓度较高,腺苷环化酶被激活,胞内cAMP水平增加,cAMP与受体蛋白CRP结合后高效结合到DNA上激活胞内超过100个启动子的转录[23],其中包括糖异生途径基因 (pck)、乙醛酸支路基因 (aceAB) 和TCA途径基因 (mdh、sdhABCD、fumA、gltA和 acnAB等)[22,24]。Nam 等[25]测定了以果糖和麦芽糖为碳源时胞内磷酸化的Enzyme IIAGlu和cAMP的浓度,两者浓度明显高于以葡萄糖为碳源的情况,此时糖异生途径、乙醛酸支路以及TCA途径基因转录被激活。同样,Bettenbrock等[26]对在不同碳源上生长的大肠杆菌胞内磷酸化的Enzyme IIAGlu和cAMP的浓度以及PEP和丙酮酸的比值进行测定,发现糖异生碳源(包括乙酸、琥珀酸)、果糖、麦芽糖以及甘油为碳源培养得到的细胞,三者明显高于葡萄糖培养的细胞。细胞内部这些信号物质的积累有利于cAMP-CRP的形成,引起糖异生途径基因 (pck)、乙醛酸支路基因(aceAB) 和TCA途径基因 (mdh、sdhABCD、fumA、gltA和acnAB等) 转录的激活。代谢调控非常复杂,不同的调控子之间还有影响,在 fur (Ferric uptake regulator) 缺失的大肠杆菌菌株中乙醛酸支路受 crp负调控[27]。

图3 大肠杆菌依赖和非依赖cAMP的分解代谢调控[20]Fig. 3 The cAMP-dependent or independent catabolic regulation of the central carbon metabolism in Escherichia coli[20]. Filled green ellipses represent transcriptional regulators assigned to catabolite control. Non-filled ellipses correspond to proteins (and ribosome) involved in signal transduction. Red coloured ellipses represent intracellular signalling molecules. Shortdashed lines: transcriptional regulation; long dashed lines: regulation of enzyme activity. +: positive regulation; −: negative regulation; +/−: positive and negative regulation.
FruR (Cra) 为不依赖cAMP的分解代谢阻遏和激活全局调控因子,通过对中心代谢途径中碳代谢和能量代谢相关酶基因表达的调控来调节中心代谢途径的碳流[17,28]。FruR 对糖酵解途径的基因 (如pfkA、pykA、gapA、pgk以及eno等)、ED途径基因(如 edd和 eda) 以及非葡萄糖的代谢基因 (如果糖操纵子 fruBKA、甘露醇操纵子 mtlADR) 有阻遏作用,但对糖异生途径基因 (fbp、pckA和 ppsA)、乙醛酸支路基因 (aceBA) 以及 TCA途径基因有激活作用。FruR缺失的菌株不能在以乙酸、丙酮酸或TCA中间代谢产物为唯一碳源的基本培养基中生长[29],主要原因是大肠杆菌在糖异生碳源上的生长受到pps和pck的控制[30],ppsA上游区域只有FruR结合位点,不存在其他调节子结合位点,糖异生关键酶 PPS的表达对 FruR有较大的依赖性[18]。大肠杆菌中过量表达不包括 fruR的果糖操纵子(fruBKA) 对糖异生途径、TCA循环以及乙醛酸途径酶的表达也有类似的阻遏作用[31],过量表达果糖操纵子为 1-磷酸果糖和 1,6-二磷酸果糖的合成提供了大量的酶源,生成的 1-磷酸果糖和 1,6-二磷酸果糖抑制了FruR的活性。果糖经过PTS系统进入细胞,被Enzyme IIAfru磷酸化生成1-磷酸果糖,1-磷酸果糖由 1-磷酸果糖激酶磷酸化生成 1,6-二磷酸果糖,1-磷酸果糖和1,6-二磷酸果糖与部分FruR结合抑制了它们的活性,减小了FruR对糖异生途径基因、乙醛酸支路基因以及TCA途径基因的激活作用。
综上所述,结合 NZN111厌氧代谢的结果来看,果糖和麦芽糖对糖异生途径基因、乙醛酸支路基因以及 TCA途径基因的调控效果优于以葡萄糖为有氧碳源的代谢调控,更有利于NZN111厌氧条件下胞内的氧化还原平衡,改善了其厌氧条件下的葡萄糖代谢能力。
REFERENCES
[1] Bunch PK, Mat-Jan F, Lee N, et al. The ldhA gene encoding the fermentative lactate dehydrogenase of Escherichia coli. Microbiology, 1997, 143: 187−195.
[2] Vemuri GN, Eiteman MA, Altman E. Effects of growth mode and pyruvate carboxylase on succinic acid production by metabolically engineered strains of Escherichia coli. Appl Environ Microbiol, 2002, 68(4): 1715−1727.
[3] Singh A, Lynch MD, Gill RT. Genes restoring redox balance in fermentation-deficient E. coli NZN111. Metab Eng, 2009, 11(6): 347−354.
[4] Kolb A, Busby S, Buc H, et al. Transcriptional regulation by cAMP and its receptor protein. Annu Rev Biochem, 1993, 62: 749−795.
[5] Saier MH Jr, Feucht BU. Coordinate regulation of adenylate cyclase and carbohydrate permeases by the phosphoenolpyruvate: sugar phosphotransferase system in Salmonella typhimurium. J Biol Chem, 1975, 250(17): 7078−7080.
[6] Ishizuka H, Hanamura A, Inada T, et al. Mechanism of the down-regulation of cAMP receptor protein by glucose in Escherichia coli: role of autoregulation of the crp gene. EMBO J, 1994, 13(13): 3077−3082.
[7] Park SJ, Cotter PA, Gunsalus RP. Regulation of malate dehydrogenase (mdh) gene expression in Escherichia coli in response to oxygen, carbon, and heme availability. J Bacteriol, 1995, 177(22): 6652−6656.
[8] Goldie AH, Sanwal BD. Genetic and physiological characterization of Escherichia coli mutants deficient in phosphoenolpyruvate carboxykinase activity. J Bacteriol, 1980, 141(3): 1115−1121.
[9] Goldie AH. Regulation of transcription of the Escherichia coli phosphoenolpyruvate carboxykinase locus: studies with pck-lacZ operon fusions. J Bacteriol, 1984, 159(3): 832−836.
[10] Cronan JE Jr, LaPorte D. Tricarboxylic acid cycle and glyoxylate bypass//Neidhardt FC, Curtiss R, Ingraham HL, et al. Escherichia coli and Salmonella: Cellular and Molecular Biology. 2nd ed. Washington DC: ASM Press, 1999: 343−357.
[11] Peng L, Shimizu K. Global metabolic regulation analysis for Escherichia coli K12 based on protein expression by 2-dimensional electrophoresis and enzyme activity measurement. Appl Microbiol Biotechnol, 2003, 61(2): 163−178.
[12] Park SJ, Gunsalus RP. Oxygen, iron, carbon, and superoxide control of the fumarase fumA and fumC genes of Escherichia coli: role of the arcA, fnr, and soxR gene products. J Bacteriol, 1995, 177(21): 6255−6262.
[13] Wu H, Li ZM, Zhou L, et al. Improved succinic acid production in the anaerobic culture of an Escherichia coli pflB ldhA double mutant as a result of enhanced anaplerotic activities in the preceding aerobic culture. Appl Environ Microbiol, 2007, 73(24): 7837−7843.
[14] Wu H, Li ZM, Zhou L, et al. Enhanced anaerobic succinic acid production by Escherichia coli NZN111 aerobically grown on gluconeogenic carbon sources. Enzyme Microb Tech, 2009, 44(3): 165−169.
[15] Deutscher J, Francke C, Postma PW. How phosphotransferase system-related protein phosphorylation regulates carbohydrate metabolism in bacteria. Microbiol Mol Biol Rev, 2006, 70(4): 939−1031.
[16] Ullmann A. Catabolite repression: a story without end. Res Microbiol, 1996, 147(6/7): 455−458.
[17] Ramseier TW, Bledig S, Michotey V, et al. The global regulatory protein FruR modulates the direction of carbon flow in Escherichia coli. Mol Microbiol, 1995, 16(6): 1157−1169.
[18] Saier MH Jr, Ramseier TM. The catabolite repressor/ activator (Cra) protein of enteric bacteria. J Bacteriol, 1996, 178(12): 3411−3417.
[19] Dippel R, Boos W. The maltodextrin system of Escherichia coli: metabolism and transport. J Bacteriol, 2005, 187(24): 8322−8331.
[20] Schlegel A, Böhm A, Lee SJ, et al. Network regulation of the Escherichia coli maltose system. J Mol Microbiol Biotechnol, 2002, 4(3): 301−307.
[21] Hardiman T, Lemuth K, Keller MA, et al. Topology of the global regulatory network of carbon limitation in Escherichia coli. J Biotechnol, 2007, 132(4): 359−374.
[22] Perrenoud A, Sauer U. Impact of global transcriptional regulation by ArcA, ArcB, Cra, Crp, Cya, Fnr, and Mlc on glucose catabolism in Escherichia coli. J Bacteriol, 2005, 187(9): 3171−3179.
[23] Brückner R, Titgemeyer F. Carbon catabolite repression in bacteria: choice of the carbon source and autoregulatory limitation of sugar utilization. FEMS Microbiol Lett, 2002, 209(2): 141−148.
[24] Nanchen A, Schicker A, Revelles O, et al. Cyclic AMP-dependent catabolite repression is the dominant control mechanism of metabolic fluxes under glucose limitation in Escherichia coli. J Bacteriol, 2008, 190(7): 2323−2330.
[25] Nam TW, Park YH, Jeong HJ, et al. Glucose repression of the Escherichia coli sdhCDAB operon, revisited: regulation by the CRP·cAMP complex. Nucleic Acids Res, 2005, 33(21): 6712−6722.
[26] Bettenbrock K, Sauter T, Jahreis K, et al. Correlation between growth rates, EIIACrrphosphorylation, and intracellular cyclic AMP levels in Escherichia coli K-12. J Bacteriol, 2007, 189(19): 6891−6900.
[27] Zhang ZG, Gosset G, Barabote R, et al. Functional interactions between the carbon and iron utilization regulators, Crp and Fur, in Escherichia coli. J Bacteriol, 2005, 187(3): 980−990.
[28] Ramseier TM. Cra and the control of carbon flux via metabolic pathways. Res Microbiol, 1996, 147(6/7): 489−493.
[29] Chin AM, Feucht BU, Saier MH Jr. Evidence for regulation of gluconeogenesis by the fructose phosphotransferase system in Salmonella typhimurium. J Bacteriol, 1987, 169(2): 897−899.
[30] Chao YP, Patnaik R, Roof WD, et al. Control of gluconeogenic growth by pps and pck in Escherichia coli. J Bacteriol, 1993, 175(21): 6939−6944.
[31] Chin AM, Feldheim DA, Saier MH Jr. Altered transcriptional patterns affecting several metabolic pathways in strains of Salmonella typhimurium which overexpress the fructose regulon. J Bacteriol, 1989, 171(5): 2424−2434.
