发酵性丝孢酵母HWZ004利用水稻秸秆水解液发酵产油脂
2011-02-09李园园吴虹黄超宗敏华
李园园,吴虹,黄超,宗敏华
1 华南理工大学生物科学与工程学院,广州 510640
2 华南理工大学轻工与食品学院 应用生物催化实验室,广州 510640
3 华南理工大学轻工与食品学院 制浆造纸工程国家重点实验室,广州 510640
近年来,随着化石资源日益枯竭,石油价格不断上涨,生物柴油等可再生能源的研究与开发受到了人们的广泛关注。目前生物柴油的制备方法一般以动植物油脂为原料,导致生产成本过高,且原料与食用油竞争,难以持续大量供应。微生物油脂,又称单细胞油脂,是微生物生命活动中的一种代谢产物。某些微生物如酵母、霉菌、微藻、细菌在一定条件下,能够利用碳水化合物、碳氢化合物作为碳源在体内积累大量油脂,有的菌体中油脂含量甚至高达干菌丝体的 70%以上[1]。大部分微生物油脂的脂肪酸组成和一般植物油相近,以C16和C18系脂肪酸,如棕榈酸、油酸、亚油酸和硬脂酸为主,因此是一种极具潜力的生物柴油生产原料[2]。
木质纤维素是地球上最丰富的可再生资源,如我国仅农作物秸秆每年产量就达10亿t。木质纤维素主要由纤维素、半纤维素与木质素组成,其完全水解后可得到大量可溶性单糖,主要有葡萄糖和木糖,其比例大约为1.5∶1~3∶1。而木糖一般很难被微生物所利用。此外,在木质纤维素水解预处理过程中,一般会产生乙酸、糠醛和 5-羟甲基糠醛等抑制微生物生长和产物形成的副产物。因此,目前关于利用木质纤维素原料产微生物油脂的报道很少。潘丽霞等[3]通过木糖摇瓶发酵,从已分离到的产油酵母中筛选到能够较好利用木糖产油脂的小红酵母Rhodotorula minuta和粘红酵母Rhodotorula glutinis各一株,其以脱毒预处理的蔗渣半纤维素水解液为培养基时的油脂得率系数分别为 13.49和 10.28。Chen等[4]采用葡萄糖和木糖比例为 3∶2的限氮混合培养基,从10种油脂酵母中筛选到6株能够利用木糖产油脂的菌株,其中 Trichosporon cutaneum 2.1374对木质纤维素水解液中的抑制剂有较好的耐受性。但其在添加20%玉米秸秆完全水解液培养基中培养时菌体细胞中的油脂含量却不理想 (<8%)。最近,本课题组研究发现,T. fermentans CICC 1368虽然能够高效利用木糖产油脂[5],但其在未脱毒的水稻秸秆半纤维素水解液中培养时细胞生长和油脂积累受到严重抑制,而以脱毒预处理的水解液为培养基时却能够较好地生长,发酵 8 d后的生物量、油脂含量与油脂产量可分别达到 28.6 g/L、40.1%与11.5 g/L[6]。
为了更有效地利用木质纤维素水解液,降低水解液中抑制剂对微生物的毒性,前人在相关研究中往往同时采用 overliming法、浓缩、活性炭或树脂吸附等方法对其进行脱毒处理,这不但过程繁琐,而且糖损失较严重。为简化脱毒处理,我们分别采用不同浓度的木质纤维素水解液对 T. fermentans CICC 1368进行驯化,获得一株对木质纤维素水解液中抑制剂耐受能力较强的菌株 T. fermentans HWZ004 (其在中国典型培养物保藏中心 CCTCC的保藏号为M 209060)。在此基础上,本文采用酸预处理和酶水解两步法水解水稻秸秆的半纤维素和纤维素,以降低水解产物中抑制剂含量,简化其后的脱毒过程;考察T. fermentans HWZ004利用该水解液发酵产油脂时细胞生长和油脂积累特性,并进一步优化培养基组成和培养条件,提高油脂产量。
1 材料与方法
1.1 菌种和试剂
发酵性丝孢酵母 Trichosporon fermentans HWZ004,由本实验室保藏。来源于 Trichoderma reesei ATCC 26921的纤维素酶 (3.5 FPU/mg) 和Novozyme 188 (720 IU/mL) 购自Sigma公司,糠醛和5-羟甲基糠醛 (HMF) 购自Alfa Aesar公司 (纯度>98%),其他试剂为市售分析纯。
1.2 培养基
斜面保藏培养基:麦芽汁琼脂培养基。
种子培养基:YEPD培养基 (g/L,葡萄糖20,蛋白胨10,酵母提取物10);pH 6.0。
初始发酵培养基 (g/L):水稻秸秆水解液,蛋白胨1.4,酵母提取物 0.5,KH2PO42.0,MgSO4·7H2O 0.4,MnSO4·H2O 3.0×10−3,CuSO4·5H2O 0.1×10−3;pH 6.5。
1.3 培养方法
斜面培养:将保藏菌种接种到麦芽汁琼脂培养基斜面培养2~3 d后,置于4 ℃冰箱中保存待用。
液体种子培养:将实验菌种接2~3环到装有50 mL的YEPD培养基的250 mL锥形瓶中,在28 ℃,160 r/min下培养24 h。
摇瓶产脂培养:将适量种子液接种于装有50 mL发酵培养基的250 mL锥形瓶中,于一定温度、160 r/min下培养1~10 d。
所有数据均为2个平行样的均值。
1.4 水稻秸秆水解液制备
将水稻秸秆粉碎过40目筛,按1∶10的固液比与2.0 wt%的稀硫酸混合,121 ℃下反应1 h后过滤,对滤液进行 overliming法处理,具体操作如下:加入Ca(OH)2,调节溶液pH至10.0,沉降1 h后过滤取上清液;接着用5 mol/L H2SO4溶液调节溶液pH至5.5;然后按0.1 g/L的量加入无水亚硫酸钠,煮沸15 min后冷却过滤,滤液置于4 ℃冰箱待用。固体残渣经水洗至中性后,按1∶6的固液比加入2.0 wt%的NaOH溶液中,于50 ℃、200 r/min下振荡 12 h,过滤、水洗至中性后干燥。所得固体按12∶100的固液比加入到overliming后的酸预处理水解液中,然后按每克固体加入25 FPU T. reesei纤维素酶和60 IU Novozyme 188,于50 ℃、180 r/min下酶解3 d得水稻秸秆水解液。
1.5 分析方法
1.5.1 生物量测定和油脂提取
采用干重法测定生物量[6]。定期从摇瓶中取出一定量发酵液,8 000 r/min离心10 min,弃上清液,所得菌体用50 mL蒸馏水洗涤2次后冷冻干燥12 h,称重。以g干菌体/L发酵液表示菌体生物量。
采用酸热法抽提干菌体内的油脂[6]。以 g油/L发酵液表示油脂产量,油脂含量为油脂量占生物量的质量百分数。
1.5.2 糖和抑制剂成分分析
采用高效液相色谱 (Waters 515 pump,Waters Corp.,USA) 分析水稻秸秆水解液成分。其中,葡萄糖、木糖、阿拉伯糖和乙酸的检测采用RI检测器 (Waters 2410) 和 Aminex HPX-87H 色谱柱(300 mm×7.8 mm,Bio Rad Corp.,USA),流动相为0.005 mol/L H2SO4,流速0.5 mL/min,柱温箱和检测池温度分别维持在65 ℃和50 ℃。在此条件下,上述成分的保留时间分别为 11.890、12.752、13.902、20.002 min。糠醛和 5-羟甲基糠醛的检测采用PDA检测器 (Waters 996) 和Zorbax SB-C18色谱柱 (250 mm×4.6 mm,Agilent Technologies Co. Ltd.,USA),流动相为水∶甲醇 (80∶20,V/V),流速1.0 mL/min,检测波长为285 nm,保留时间分别为6.045 min和4.538 min。
1.5.3 油脂脂肪酸组成分析
参照文献方法制备微生物油脂的脂肪酸甲酯[7]。采用 GC-2010气相色谱仪 (日本岛津公司)
分析甲酯化产物,色谱条件为:FID检测器;毛细管色谱柱:DB-1 (30.0 m×0.25 mm,美国Agilent公司);分析条件:气化室温度250 ℃,检测室温度280 ℃,柱温170 ℃,以3 ℃/min的速度升温至 220 ℃,维持 2 min;载气为氮气,流速为28.5 mL/min;分流比为50∶1 (V/V);进样量1 μL。棕榈酸、硬脂酸、油酸和亚油酸的保留时间分别为11.004、15.802、15.087、14.871 min。
2 结果与分析
2.1 两步法水解水稻秸秆
木质纤维素的预处理方法对水解液的组成影响显著。在稀酸预处理过程中,乙酸、糠醛和HMF是最常见的抑制剂,而糠醛和HMF通常被认为是抑制微生物细胞生长和产物形成的主要物质[8]。为了降低水解液中抑制剂的种类和浓度,本文选择了较温和的稀酸预处理方法,反应时间仅为1 h。由表1可见,与反应2 h的结果相比[6],乙酸和糠醛的浓度均大大降低 (0.6 g/L vs 1.4 g/L;0.22 g/L vs 0.5 g/L)。虽然HMF的浓度有所升高 (0.25 g/L vs 0.08 g/L),但经简单的overliming法脱毒处理后其降至 0.06 g/L;糠醛的浓度亦从 0.22 g/L降至0.11 g/L。稀酸预处理的水稻秸秆经进一步酶水解后水解液中的糖浓度达到80.8 g/L,可不需浓缩直接用于发酵。虽然该糖浓度较Chen等[4]报道的两步法低,但他们采用的预处理方法条件更为苛刻(先硫酸浸泡后高温高压蒸汽爆破),会产生大量的抑制剂,如乙酸、糠醛和 HMF的浓度分别高达11.58 g/L、0.32 g/L和1.01 g/L。
2.2 T. fermentans HWZ004利用水稻秸秆水解液发酵产油脂
图1描述了T. fermentans HWZ004利用上述水解液发酵产油脂的过程曲线及糖消耗情况。由图1A可见,细胞生长在该水解液中未受到明显抑制,发酵第1天的生物量为4.6 g/L,而驯化前的出发菌株T. fermentans CICC 1368甚至在脱毒后的水稻秸秆半纤维素水解液中仍可观察到显著的抑制作用[6]。在 1~8 d内,生物量随时间增加而增大,第 8~9天变化甚微,随后生物量开始下降。油脂含量在第 1~2天内变化不大,且含量较低,其原因可能是:一方面,油脂一般在氮源消耗殆尽,碳源充足的情况下大量积累,而发酵初期培养基中的氮源浓度相对较高,因此油脂合成的量很少;另一方面,水解液中少量抑制剂的存在抑制了细胞体内油脂合成酶的活性,细胞需要一定时间来适应环境。第 2天后,油脂含量随时间增加而显著上升,第 7天达到最大值。此后,随着发酵时间继续增加而降低。图1B的糖利用情况有助于我们更好地认识上述细胞生长和油脂积累现象。发酵前 7天,培养基中有足够的碳源供给细胞生长及油脂合成,第7天,总糖浓度下降至1.9 g/L,此时,细胞开始利用体内积累的油脂进行代谢活动。因此,油脂含量下降而生物量略有上升。在解脂耶氏酵母Yarrowia lipolytica、T. fermentans CICC 1368和头状丝孢酵母Trichosporon capitatum发酵产油脂过程中亦观察到类似现象[5,9-10]。此外,图 1B表明糖代谢中的葡萄糖效应明显,只有当葡萄糖耗尽时,T. fermentans HWZ004才开始利用木糖和阿拉伯糖。而有趣的是,在上述几种糖的模拟培养基中却没有观察到类似现象。这可能是因为水解液中的抑制剂影响了细胞糖代谢过程中一些关键酶的活性。我们在检测发酵过程中木糖还原酶的活性时发现,发酵前5天,水稻秸秆水解液中木糖还原酶的比活约为模拟培养基中的1/4。另一方面,水解液中抑制剂,如乙酸等的存在对木糖和阿拉伯糖代谢的抑制作用比对葡萄糖的更强烈[11]。
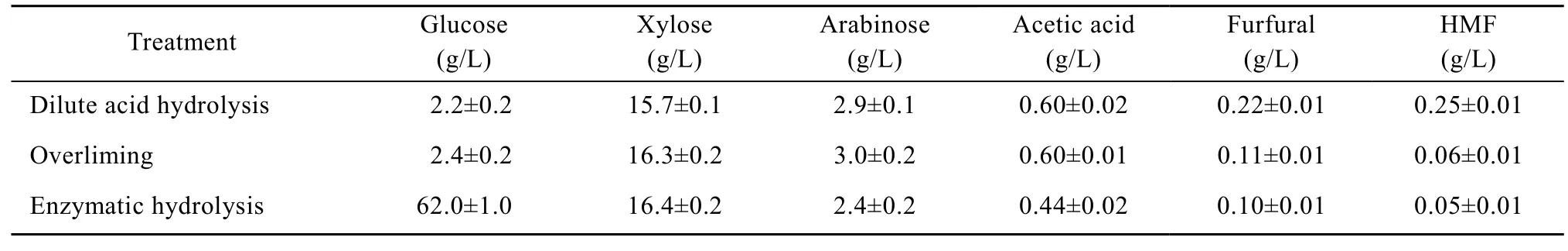
表1 水稻秸秆水解液组成Table 1 Composition of rice straw hydrolysate after each step of treatment
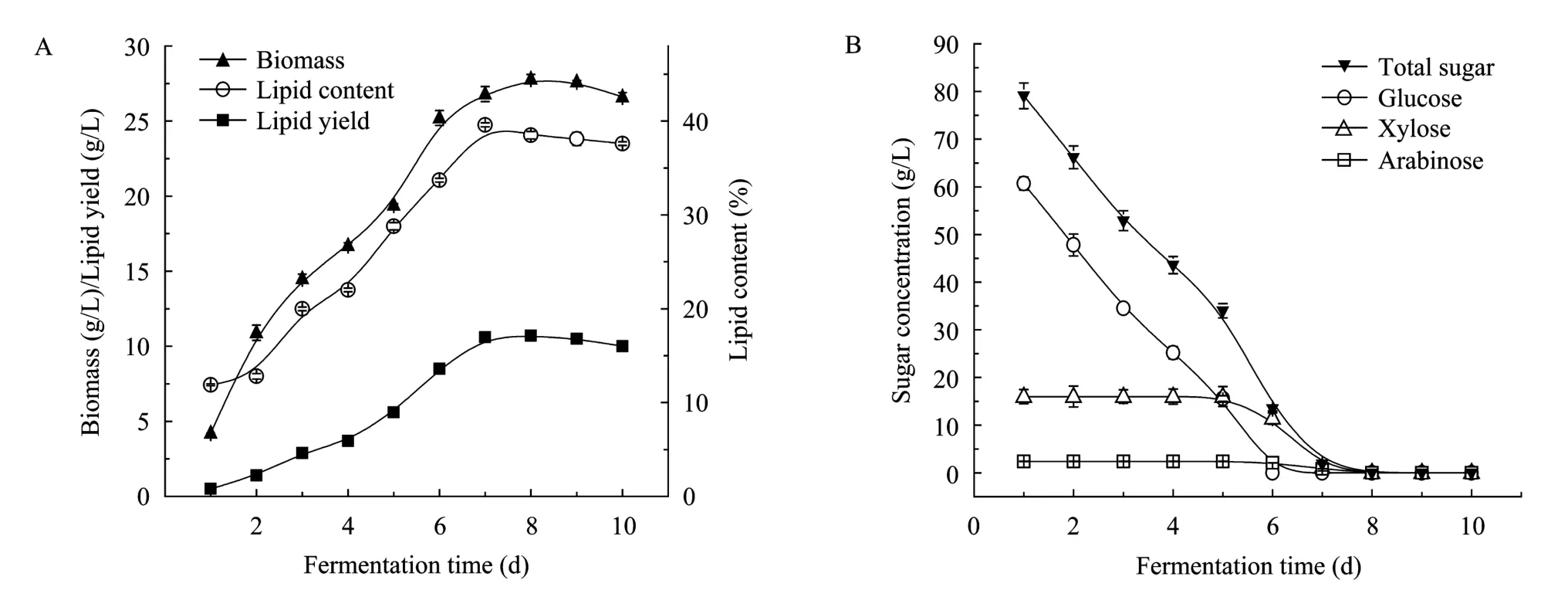
图1 T. fermentans HWZ004利用水稻秸秆水解液发酵产油脂Fig. 1 Production of microbial oil on rice straw hydrolysate by T. fermentans HWZ004. (A) Time course of cell growth and lipid accumulation. (B) Time course of sugar utilization. Culture was performed at 25 °C, pH 6.5 and 160 r/min, inoculum size 10%.
2.3 培养基组成及培养条件对 T. fermentans HWZ004产油脂的影响
培养基组成对微生物细胞生长和油脂积累有显著影响。如氮源的种类和C/N比直接影响菌体的生长速度以及油脂的积累情况[5,10];二价金属离子则可能与油脂合成途径中关键酶苹果酸酶结合,通过影响酶结构的完整性从而影响油脂的合成[12-13]。为了更高效地利用水稻秸秆水解液,了解驯化菌株T. fermentans HWZ004与出发菌株 T. fermentans CICC 1368对各种营养成分需求的差异,我们研究了氮源及微量元素对T. fermentans HWZ004产油脂的影响。结果表明,当蛋白胨浓度低于0.8 g/L时,生物量和油脂含量均随氮源浓度的增加而增大;当蛋白胨浓度为0.8 g/L时,生物量和油脂含量达到最大值,分别为27.8 g/L和41.4%。其后,随着蛋白胨浓度继续升高,生物量和油脂含量开始下降,而油脂含量的变化较生物量明显,可能是培养基中的碳氮比超过了其最适范围,氮源过多导致油脂合成减少。与出发菌株T. fermentans CICC 1368相比,T. fermentans HWZ004对外加氮源的需求减少[5],其原因是水解液中残留的酶蛋白补充了一部分所需的氮源。对T. fermentans CICC 1368的研究发现,只有添加一定量的K+、Mg2+、Mn2+和 Cu2+于合成培养基中,方能获得高油脂产量。但对于 T. fermentans HWZ004, 除 了 添 加 极 少 量 的CuSO4·5H2O (0.1×10−3g/L) 可以促进菌体的生长和油脂积累外,其他金属离子的添加非但不能促进油脂的合成,还对其合成有抑制作用。这是因为,其一,K、P、Mg等是植物细胞中的大量元素,在秸秆的酸预处理过程中以无机盐的形式进入水解液,因此细胞在生长和油脂积累过程中无需外加这 3种元素;其二,经过Ca(OH)2overliming法处理后,水解液中离子强度较高。
表2是培养条件对T. fermentans HWZ004产油脂的影响。由表可见,适宜的接种量为5.0%,过高接种量 (>5.0%) 虽然可进一步提高生物量,但油脂含量却显著下降。其原因可能是高接种量导致细胞过快增殖,减少了产物的合成。此外,过高接种量可能导致培养基中氮源浓度增加 (种子培养基中的氮源浓度较高),碳氮比下降,不利于油脂积累。与出发菌株T. fermentans CICC 1368相似[5],在20 ℃和25 ℃范围内,T. fermentans HWZ004的生物量和油脂含量随着温度的升高而增加。25 ℃时,生物量和油脂含量达到最大值,分别为25.9 g/L和52.1%。而当温度高于25 ℃时,生物量和油脂含量随着温度的继续升高而下降。pH不仅可通过改变细胞膜电荷和营养物离子化程度来影响微生物对营养的吸收,而且还影响细胞内多种酶的活性。表 2的结果表明,当培养基初始pH小于7.0时,生物量和油脂含量随着pH的增加而增大;当pH>7时,生物量和油脂含量随着pH的继续增大而缓慢下降;最适pH为7.0。
2.4 油脂脂肪酸组成分析
经过上述优化后,T. fermentans HWZ004在5%接种量、25 ℃、160 r/min条件下培养7 d (培养基组成:水稻秸秆水解液,0.8 g/L蛋白胨、0.1×10−3g/L CuSO4·5H2O,初始pH 7.0) 的生物量、油脂含量和油脂产量分别是26.4 g/L、52.2%和13.8 g/L。此时,油脂得率系数为 17.0,大大高于其驯化前以脱毒的水稻秸秆半纤维素水解液为碳源时的对应值(11.9)[6]。表3归纳了不同微生物菌株以不同工农业废弃物为原料生产微生物油脂的情况。由该表可知,本研究采用两步法水解并经简单 overliming法脱毒处理得到的水稻秸秆水解液是一种很好的碳源,T. fermentans HWZ004以其为培养基发酵所得的油脂产量最高。
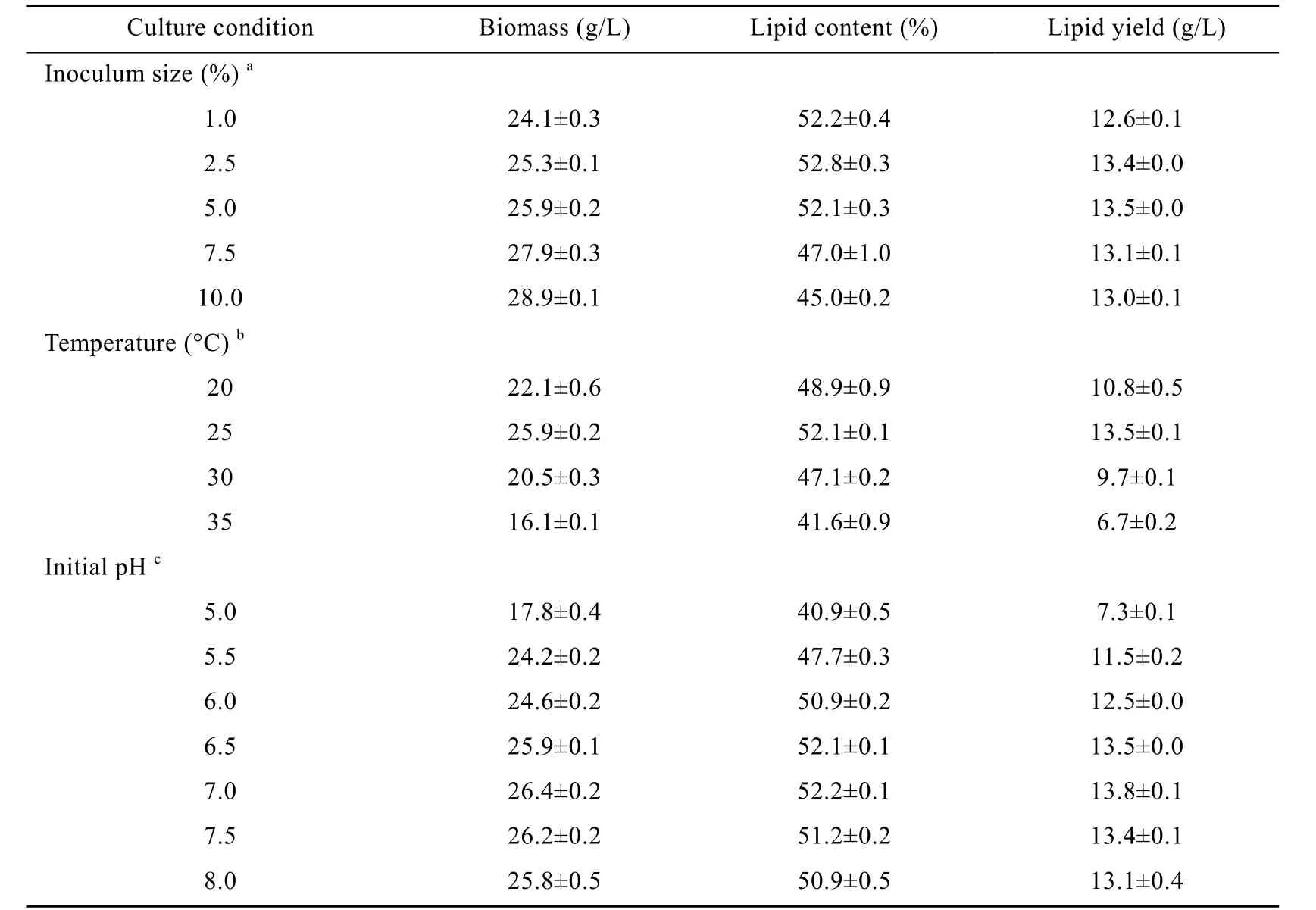
表2 接种量、温度和培养基初始pH对T. fermentans HWZ004发酵产油脂的影响Table 2 Effect of inoculum size, temperature and initial pH on cell growth and lipid accumulation of T. fermentans HWZ004
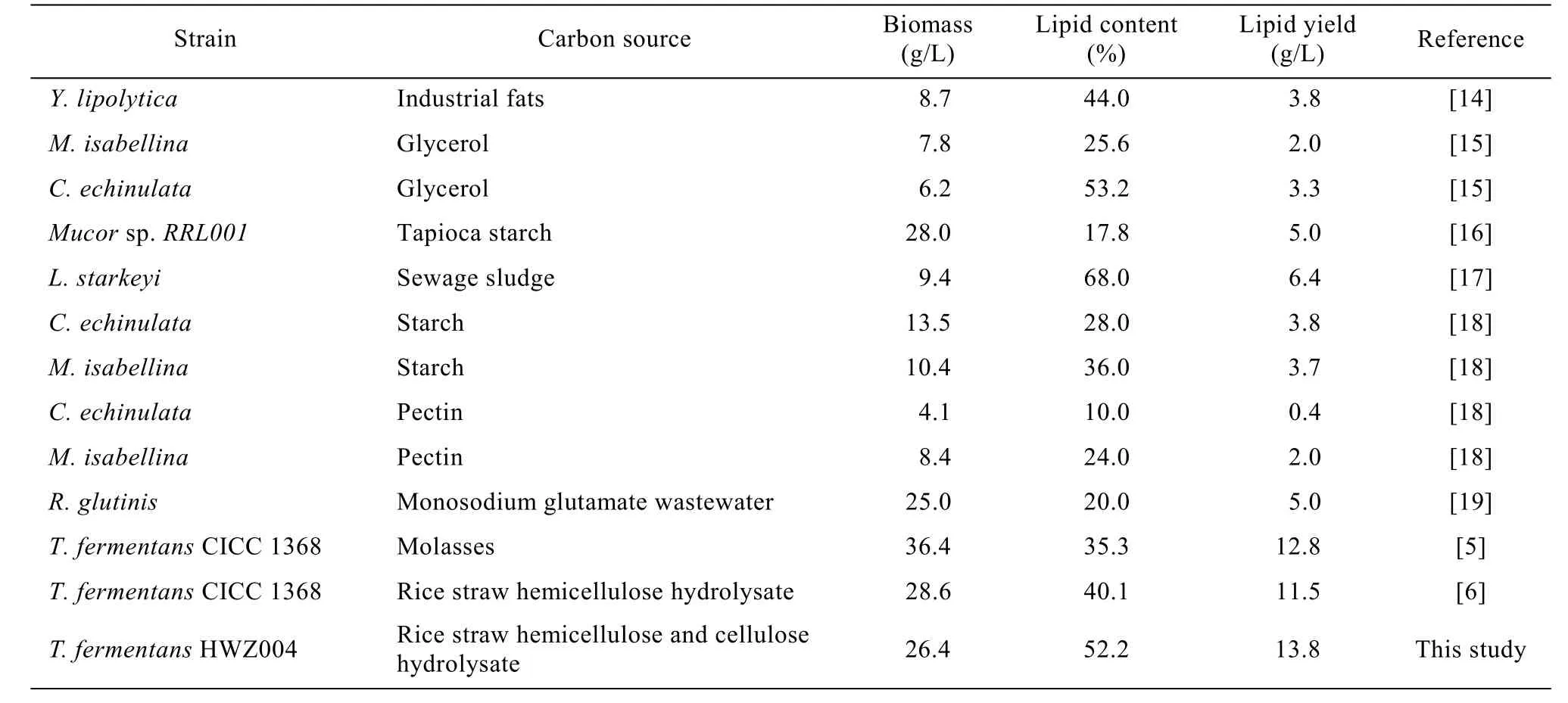
表3 不同微生物利用不同来源的碳源生产微生物油脂Table 3 Microbial oil production on different carbon sources by various microorganisms
气相色谱分析结果表明,T. fermentans HWZ004所产油脂的脂肪酸组成与出发菌株 T. fermentans CICC 1368相似[5-6],主要为棕榈酸、硬脂酸、油酸和亚油酸,含量分别为 20.9%、8.7%、65.1%和 5.3%,不饱和脂肪酸含量占 70%以上。该油脂组成与植物油相似,因此可用于生物柴油的生产。
3 结论
采用温和的稀酸预处理及酶水解两步法可以降低水稻秸秆水解产物中的抑制剂浓度,简化脱毒步骤。水解液只需经简单的 overliming法处理、外加少量氮源和微量CuSO4·5H2O即可满足T. fermentans HWZ004细胞生长和油脂积累的营养要求。T. fermentans HWZ004利用水稻秸秆水解液发酵产油脂的油脂得率系数达 17.0,且所得油脂的脂肪酸组成与植物油相似,可用于生物柴油的生产。
REFERENCES
[1] Ratledge C. Fatty acid biosynthesis in microorganisms being used for Single Cell Oil production. Biochimie, 2004, 86(11): 807−815.
[2] Zhao ZB, Hua YY, Liu B. How to secure triacylglycerol supply for Chinese biodiesel industry. China Biotechnol, 2005, 25(11): 1−6.赵宗保, 华艳艳, 刘波. 中国如何突破生物柴油产业的瓶颈. 中国生物工程杂志, 2005, 25(11): 1−6.
[3] Pan LX, Yang DF, Shao L, et al. Screening, identification and fermention characters of oleaginous yeasts by utilizing sugar cane bagasse hemicellulose hydrolysates. Microbiology, 2008, 35(8): 1176−1181.潘丽霞, 杨登峰, 邵利, 等. 利用蔗渣半纤维素水解液产油酵母的筛选、鉴定及发酵实验. 微生物学通报, 2008, 35(8): 1176−1181.
[4] Chen X, Li ZH, Zhang XX, et al. Screening of oleaginous yeast strains tolerant to lignocellulose degradation compounds. Appl Biochem Biotechnol, 2009, 159(3): 591−604.
[5] Zhu LY, Zong MH, Wu H. Efficient lipid production with Trichosporon fermentans and its use for biodiesel preparation. Bioresour Technol, 2008, 99(16): 7881−7885.
[6] Huang C, Zong MH, Wu H, et al. Microbial oil production from rice straw hydrolysate by Trichosporon fermentans. Bioresour Technol, 2009, 100(19): 4535−4538.
[7] Lin JT, Shen HW, Zhang ZH, et al. Microbial lipid production by Rhodosporidium toruloides in a two-stage culture mode. Chin J Biotech, 2010, 26(7): 997−1002.林金涛, 沈宏伟, 张泽会, 等. 圆红冬孢酵母两阶段培养法生产微生物油脂. 生物工程学报, 2010, 26(7): 997−1002.
[8] Palmqvist E, Hahn-Hägerdal B. Fermentation of lignocellulosic hydrolysates. II: inhibitors and mechanisms of inhibition. Bioresour Technol, 2000, 74(1): 25−33.
[9] Papanikolaou S, Aggelis G. Modeling lipid accumulation and degradation in Yarrowia lipolytica cultivated on industrial fats. Curr Microbiol, 2003, 46(6): 398−402.
[10] Wu H, Li YY, Chen L, et al. Production of microbial oil with high oleic acid content by Trichosporon capitatum. Appl Energ, 2011, 88(1): 138−142.
[11] Casey E, Sedlak M, Ho NWY, et al. Effect of acetic acid and pH on the cofermentation of glucose and xylose to ethanol by a genetically engineered strain of Saccharomyces cerevisiae. FEMS Yeast Res, 2010, 10(4): 385−393.
[12] Jerneic K, Legiša M. The influence of metal ions on malic enzyme activity and lipid synthesis in Aspergillus niger. FEMS Microbiol Lett, 2002, 217(2): 185−190.
[13] Zhang YJ, Wang ZL, Sprous D, et al. In silico design and synthesis of piperazine-1-pyrrolidine-2,5-dione scaffoldbased novel malic enzyme inhitors. Bioorg Med Chem Lett, 2006, 16(3): 525−528.
[14] Papanikolaou S, Chevalot I, Komaitis M, et al. Kinetic profile of the cellular lipid composition in an oleaginous Yarrowia lipolytica capable of producing a cocoa-butter substitute from industrial fats. Antonie Van Leeuwenhoek, 2001, 80(3/4): 215−224.
[15] Fakas S, Papanikolaou S, Batsos A, et al. Evaluating renewable carbon sources as substrates for single cell oil production by Cunninghamella echinulata and Mortierella isabellina. Biomass Bioenerg, 2009, 33(4): 573−580.
[16] Ahmed SU, Singh SK, Pandey A, et al. Effects of various process parameters on the production of γ-linolenic acid in submerged fermentation. Food Technol Biotech, 2006, 44(2): 283−287.
[17] Angerbauer C, Siebenhofer M, Mittelbach M, et al. Conversion of sewage sludge into lipids by Lipomyces starkeyi for biodiesel production. Bioresour Technol, 2008, 99(8): 3051−3056.
[18] Papanikolaou S, Galiotou-Panayotou M, Fakas S, et al. Lipid production by oleaginous Mucorales cultivated on renewable carbon sources. Eur J Lipid Sci Technol, 2007, 109(11): 1060−1070.
[19] Xue FY, Miao JX, Zhang X, et al. Studies on lipid production by Rhodotorula glutinis fermentation using monosodium glutamate wastewater as culture medium. Bioresour Technol, 2008, 99(13): 5923−5927.
