具有细菌群体感应抑制活性海洋来源真菌的筛选鉴定
2011-02-09尹守亮常亚婧邓苏萍王清池于文功宫倩红
尹守亮,常亚婧,邓苏萍,王清池,于文功,宫倩红
中国海洋大学医药学院 海洋药物教育部重点实验室,青岛 266003
群体感应 (Quorum sensing,QS) 是由Fuqua等1994年首先提出,是细菌根据自身细胞密度变化进行自我协调的一种群体行为[1]。细菌利用自身产生的小分子化合物,称为信号分子或自诱导物(Autoinducers,AI) 作为群体间相互交流的“语言”。细菌在生长繁殖过程中不断将信号分子释放到胞外,随着菌体密度增加,信号分子浓度随之积累,当达到一定阈值时,信号分子与胞浆或细胞膜上的信号分子受体蛋白结合进而激活或抑制相关基因的表达[2]。QS系统控制着包括生物被膜形成、有害毒素产生、致病因子释放、胞外多糖产生等一系列的细菌毒力行为和表型,这对病原菌的致病过程起了关键性的作用[3-8]。大量文献证实缺失了QS系统的菌株其致病能力大大降低,因此,通过干扰致病菌的 QS系统来控制病原菌感染是一个非常有效的策
略[9-10]。
构建药物筛选模型是现代药物开发流程中检验和获取具有特定生理活性化合物的一个关键步骤,近年来,随着细菌QS调控机制的逐步阐明,国内外许多实验室致力于 QS抑制因子的筛选与研究[11-12]。QSIS2筛选模型 (pUCP22NotI-PlaclasR-PlasB-sacB)是利用受铜绿假单胞菌Pseudomonas aeruginosa QS系统调节的基因 lasB的启动子,和蔗糖致死基因sacB为报告基因构建而成;信号分子3-氧十二烷酰高丝氨酸内酯 (N-(3-Oxododecanoyl)- L-homoserine lactone,3-oxo-C12-HSL) 和受体蛋白 LasR结合后形成复合物,结合到lasB启动子上,启动下游sacB的表达,在有蔗糖底物存在的情况下,sacB编码的蔗糖果聚糖酶将会合成对细胞有毒性的高分子量的果聚糖,造成细胞死亡,若存在 QS抑制因子如阳性对照物C30 (Furanone),致死作用则会得到补救[11]。TTC (2,3,5-氯化三苯基四氮唑) 可以作为呼吸链中吡啶-核苷结构酶系统的质子受体,能够与活细菌体内的琥珀酸脱氢酶反应,生成红色的甲瓒,而死细菌中无呼吸作用不显红色[13]。通过向培养基中加入TTC活菌染色剂,可以直观地进行筛选和观察,提高了模型灵敏度[11]。紫色杆菌 Chromobacterium violaceum是一种革兰氏阴性细菌,当自身细胞密度达到一定临界浓度时,向环境中释放的信号分子(C6-HSL) 与胞内转录调节蛋白CviR结合,启动紫色菌素基因的表达[14];若有 QS抑制因子存在,则能抑制紫色色素的产生,所以紫色杆菌常被作为一种简便、直观的筛选QS抑制因子的指示菌株[15]。
最早发现的 QS抑制因子来源于海洋红藻Delisea pulchra,该红藻分泌产生的呋喃酮化合物能够阻止细菌粘附在自身表面[16],研究者在天然呋喃酮的基础上进行化学修饰和改造,其中衍生物呋喃酮C30能够显著降低铜绿假单胞菌中受QS调控的毒性基因的表达[17]。德克萨斯大学通过对有机小分子化合物库进行随机筛选[18],发现4-[(苯胺基) 硫代甲基]氨基-N-苯基苯磺酰胺 (LED209) 能够有效地干扰大肠杆菌 Escherichia coli、沙门氏菌Salmonella、弗朗西斯氏菌Francisella的QSeC群体感应调控系统[19]。海洋微生物是生物活性物质的巨大宝库。特殊的海洋环境赋予海洋微生物以新的活性,高盐度、高压力、低温及特殊的光照等复杂海洋生态环境可能使海洋微生物在物种、基因组成和生态功能上具有更大的多样性,产生不同于陆地来源的特殊代谢产物。文中从海洋软体动物体内分离真菌69株,利用QSIS2筛选模型和紫色杆菌CV026得到一株具有细菌QS抑制活性的青霉菌QY013,初步研究表明QY013发酵液粗提物能够抑制铜绿假单胞菌 QS调控的绿脓菌素的产量和紫色杆菌紫色菌素的产量。
1 材料与方法
1.1 材料
1.1.1 样品
2010年1月从青岛胶州湾附近地区采集野生海洋软体动物海虹、蛤蜊、海蛎子,存放于无菌瓶中。
1.1.2 试剂和仪器
实验中所用限制性内切酶、Taq DNA聚合酶、dNTPs、pMD18-T载体等均购买自大连宝生物(TaKaRa) 公司;庆大霉素、卡那霉素购自Amresco公司;2,3,5-氯化三苯基四氮唑 (TTC) 购自上海化学试剂总厂;苯胺蓝染色剂购自中国上海标本模型厂;信号分子 N-hexanoyl-HSL (C6-HSL) 购于Cayman Chemical公 司 , N-(3-Oxododecanoyl)-L-homoserine lactone (3-oxo-C12-HSL) 和 furanone C30 (C5H2O2Br2) 由青岛百德生物化学品有限公司合成,所用其他生化试剂均为分析纯。VC750超声破碎仪 (美国Sonics公司),旋转蒸发仪 (郑州长城科工贸有限公司),DU640紫外分光光度计 (美国Beckman公司),9700 PCR 仪 (美国 Applied Biosystem公司),荧光倒置相差显微镜 IX70 (日本Olympus公司)。
1.1.3 培养基
分离和斜面保存培养基(PDA)[20]:马铃薯200 g;蔗糖20 g;琼脂20 g;马铃薯去皮后切成块,煮沸30 min,4层纱布过滤后取滤液,最后用陈海水定容1 000 mL。121 ℃、1.01×105Pa灭菌20 min,临用前分别加入青霉素、链霉素至终浓度各为30 µg/mL。
真菌发酵培养基:山梨醇20 g;麦芽糖20 g;谷氨酰胺10 g;KH2PO40.5 g;MgS04·7H2O 0.3 g;色氨酸 0.5 g;酵母粗提物 3 g;用陈海水定容为1 000 mL,调pH为6.5,121 ℃、1.01×105Pa灭菌20 min。
LB培养基:蛋白胨10 g;酵母粗提物5 g;NaCl 10 g;蒸馏水1 000 mL;pH 7.0,固体LB培养基加入15 g琼脂,121 ℃、1.01×105Pa灭菌20 min备用。
1.2 方法
1.2.1 海洋真菌的分离
用无菌海水浸泡样品,75%酒精表面消毒,去掉贝壳取软体,再次用75%酒精表面消毒,无菌海水冲洗 3次,用无菌的玻璃研磨器粉碎研磨,无菌海水梯度稀释,涂布到分离培养基平板上,28 ℃培养6~10 d,将长出的菌落挑出划线分离纯化,观察和排重。
1.2.2 真菌粗提物的制备
将上述分离纯化好的真菌分别接种到含有15 mL发酵培养基的 50 mL 螺口管中,28 ℃、240 r/min振荡培养6~10 d。将菌体及上清发酵液超声破碎,加入15 mL乙酸乙酯萃取,充分振荡后,静置萃取过夜,6 000 r/min离心,取上层有机相,用旋转蒸发仪低温浓缩至干,干燥物用甲醇溶解至100 g/L,备用。
1.2.3 群体感应抑制活性筛选
QSIS2模型筛选方法:13.5 mL融化的固体LB 培养基冷却至约40 ℃,加入 1.5 mL 60%的蔗糖、150 µL过夜培养的 QSIS2菌液、15 µL 200 µmol/L 3-oxo-C12-HSL、150 µL 5% (W/V) 的TTC和 24 µL 50 g/L 的庆大霉素,混匀后倒平板[11]。待平板凝固后,用打孔器打孔,每个孔内分别加3 µL上述制备好的真菌发酵粗提物,37 ℃培养箱恒温培养16 h,观察结果。紫色杆菌CV026筛选方法[14]:15 mL融化的固体LB培养基中加入150 µL过夜培养的紫色杆菌CV026菌液、3 µL 5 µmol/L的C6-HSL和15 µL 50 g/L的卡那霉素,混匀后倒平板。待平板凝固后,用打孔器打孔,每个孔内加入3 µL粗提物,于30 ℃培养箱培养16 h,观察结果。
1.2.4 QY013粗提物对细菌生长的影响
将生长至对数期的 QSIS2菌液用新鲜液体 LB稀释至OD600≈0.05,分装4组,每组3个平行;每组分别加入终浓度粗提物为0、200、400、600 mg/L,空白用甲醇补足,37 ℃、240 r/min摇床培养;每隔2 h分别测定各管OD600吸光值,直至对数后期;以培养时间为横坐标,600 nm处的吸光值 (OD600)为纵坐标,绘制在粗提物 QY013作用下的 QSIS2的生长曲线。紫色杆菌生长曲线测定:用新鲜 LB将培养至对数期的CV026菌液稀释至OD600≈0.05,分装5组,每组3个平行;每组试管中加入粗提物至终浓度0、50、100、200、300 mg/L,每隔2 h测定OD600吸光值,检测粗提物QY013对于紫色杆菌CV026生长的影响。
1.2.5 QY013粗提物对于野生型铜绿假单胞菌PAOI绿脓菌素产量的影响
挑取PAOI单克隆接种于新鲜LB培养基中,37 ℃、240 r/min生长至对数期;用新鲜LB将菌液稀释至OD600≈0.05,分装4组,每组3个平行;每组分别加入终浓度0、200、400、600 mg/L的真菌粗提物;相同条件下振荡培养16 h。阴性对照为PAO MWI,PAO MWI为lasI rhlI信号分子缺失菌株不产绿脓菌素。绿脓菌素定量方法[21]:将菌液10 000 r/min离心除去菌体后,向5 mL离心上清液中加入3 mL氯仿进行抽提;抽提后,将氯仿层转入新的离心管中,并加入1 mL 0.2 mol/L的盐酸混合;充分混合萃取后,离心并收集粉红色的上层水相,
紫外分光光度计在520 nm处测定其吸光值。
1.2.6 QY013粗提物对于紫色杆菌CV026紫色菌素产量的影响
将过夜培养的紫色杆菌CV026用新鲜的LB培养基稀释到OD600≈0.05,加入C6-HSL至终浓度为1 µmol/L,分别分装到5组试管中,每管2 mL,每组3个平行,每组分别加入终浓度0、50、100、200、300 mg/L的QY013粗提物,空白对照组:0 µmol/L的C6-HSL,0 mg/L QY013粗提物。30 ℃、240 r/min振荡培养16 h。紫色菌素提取方法[22]:吸取1 mL上述培养好的菌液于1.5 mL Eppendorf管中,14 000 r/min 离心10 min,使紫色菌素和菌体充分沉淀。去掉上清液,加1 mL二甲亚砜 (DMSO) 于Eppendorf管中,涡旋,充分振荡使紫色菌素溶解于
DMSO中。14 000 r/min再次离心10 min,沉淀菌体及碎屑。测定上清585 nm处的光吸收值。
1.2.7 菌株形态观察
将纯化的菌株接种于PDA培养基平皿上,28 ℃培养4~7 d,观察菌株的形状、颜色、尺寸等形态特征;用接种环挑取少量菌丝体于无菌载玻片上,滴加1滴乳酸酚-苯胺蓝染色剂进行染色固定,盖上盖玻片,置于显微镜下观察菌丝体和孢子的形态特征。
1.2.8 菌株种属鉴定
提取真菌QY013基因组DNA作为PCR模板,18S rDNA基因克隆的PCR引物为NS1 (5′-GTAGT CATATGCTTGTCTC-3′) 和NS8 (5′-TCCGCAGGTT CACCTACGGA-3′)。PCR扩增条件:94 ℃预变性 5 min;94 ℃变性1 min,55 ℃退火30 s,72 ℃延伸2 min,35个循环;最后72 ℃延伸15 min。得到的PCR产物与载体pMD18-T连接,转化于大肠杆菌E. coli DH5α感受态细胞中,经蓝白斑筛选、菌液PCR及限制性内切酶酶切鉴定后,随机挑选3个阳性克隆由上海生工生物工程公司对其进行测序。将所测得的18S rDNA序列与GenBank数据库中的已有序列进行Blastn分析。
2 结果与分析
2.1 海洋真菌的分离及粗提物制备
从海洋软体动物海虹、蛤蜊、海蛎子中共分离到真菌69株,发酵液经乙酸乙酯萃取,低温旋蒸干燥,制得真菌发酵粗提物69份。
2.2 真菌发酵粗提物抑制群体感应活性的筛选
将69份真菌粗提物按照步骤1.2.3进行QS抑制活性筛选,发现编号QY010和QY013粗提物具有铜绿假单胞菌和紫色杆菌 QS抑制活性,其中QY013活性最强。QY013筛选结果:在信号分子和蔗糖底物存在的情况下,编号QY013粗提物能够明显地抑制QSIS2筛选模型中报告基因sacB的表达,与呋喃酮 C30相对照,QY013粗提物具有显著的QS抑制活性,结果如图1A所示,在平皿加样孔的周围呈现出红色的活菌圈,并且菌圈直径大小与加入粗提物样品的浓度成正比,呈现浓度依赖性。紫色菌素在紫色杆菌中是受 QS严格调控的,紫色杆菌CV026为信号分子基因缺失突变株,外源加入信号分子C6-HSL后,能够启动QS调控的紫色菌素的产生,若有 QS抑制因子的存在,则能抑制紫色菌素的生成,在琼脂板加样孔周围表现出浑浊但不透明的圆圈 (阳性对照 C30)。如图 1B所示,QY013粗提物能够显著抑制紫色杆菌紫色菌素的生成。
2.3 QY013粗提物对筛选模型生长的影响
近 20年来,已经发现的许多天然的和合成的QS抑制因子主要有非肽类有机小分子、多肽以及酶 (含抗体),这些都能干扰细菌 QS系统及其 QS调控的各种细菌表型,但对细菌的生长不产生抑制作用[23]。测定不同浓度的 QY013粗提物对 QSIS2和紫色杆菌CV026生长的影响,结果如图2所示,QY013粗提物在 0~600 mg/L范围内对QSIS2的生长不产生抑制作用,紫色杆菌CV026生长曲线表明粗提物在0~300 mg/L浓度时对于紫色杆菌CV026的生长不产生影响。
2.4 QY013粗提物对细菌QS调控的表型影响
绿脓菌素是铜绿假单胞菌分泌的一种重要的吩嗪类毒性产物。绿脓菌素进入细胞内可作为电子载体,增加受感染细胞的氧化压力,使感染细胞中毒死亡,因此,绿脓菌素常与囊肿性纤维化病人的肺部感染有关[24]。而绿脓菌素的产量是受铜绿假单胞菌 QS系统严格调控的,我们在不抑制铜绿假单胞菌生长的浓度范围内,检测了QY013粗提物对于绿脓菌素产量的影响。图3A结果显示,QY013粗提物能有效降低铜绿假单胞菌绿脓菌素的产量,并且呈浓度依赖性。同时,我们检测了粗提物对于紫色杆菌QS调控的表型的影响,在终浓度1 µmol/L信号分子 (C6-HSL) 存在的情况下,QY013粗提物明显抑制了紫色菌素的生成 (图 3B)。由生长曲线可知,在有效降低细菌表型的浓度范围内,粗提物并不影响铜绿假单胞菌和紫色杆菌的生长,这表明粗提物对于细菌表型的抑制作用并不是影响了细菌的生长,而是干扰了细菌的 QS系统,与模型的筛选结果一致。

图1 群体感应抑制活性筛选Fig. 1 Screening for quorum sensing inhibitors. (A) Effect of different concentrations of QY013 extract on the model of QSIS2. 1: 3 µL methanol as negative control; 2: 0.15 mg extract; 3: 0.3 mg extract; 4: 0.45 mg extract; 5: 3.18 µg C30 as positive control. (B) Effect of different concentrations of QY013 extract on the model of CV026. 1: 3 µL methanol as negative control; 2: 0.05 mg extract; 3: 0.1 mg extract ; 4: 0.15 mg extract; 5: 1.91 µg.

图2 QY013粗提物对细菌生长影响Fig. 2 Effect of QY013 extract on bacterial growth. (A) Growth curves of QSIS2 after treatment with different concentrations of QY013 extract. (B) Growth curves of CV026 after treatment with different concentrations of QY013 extract.
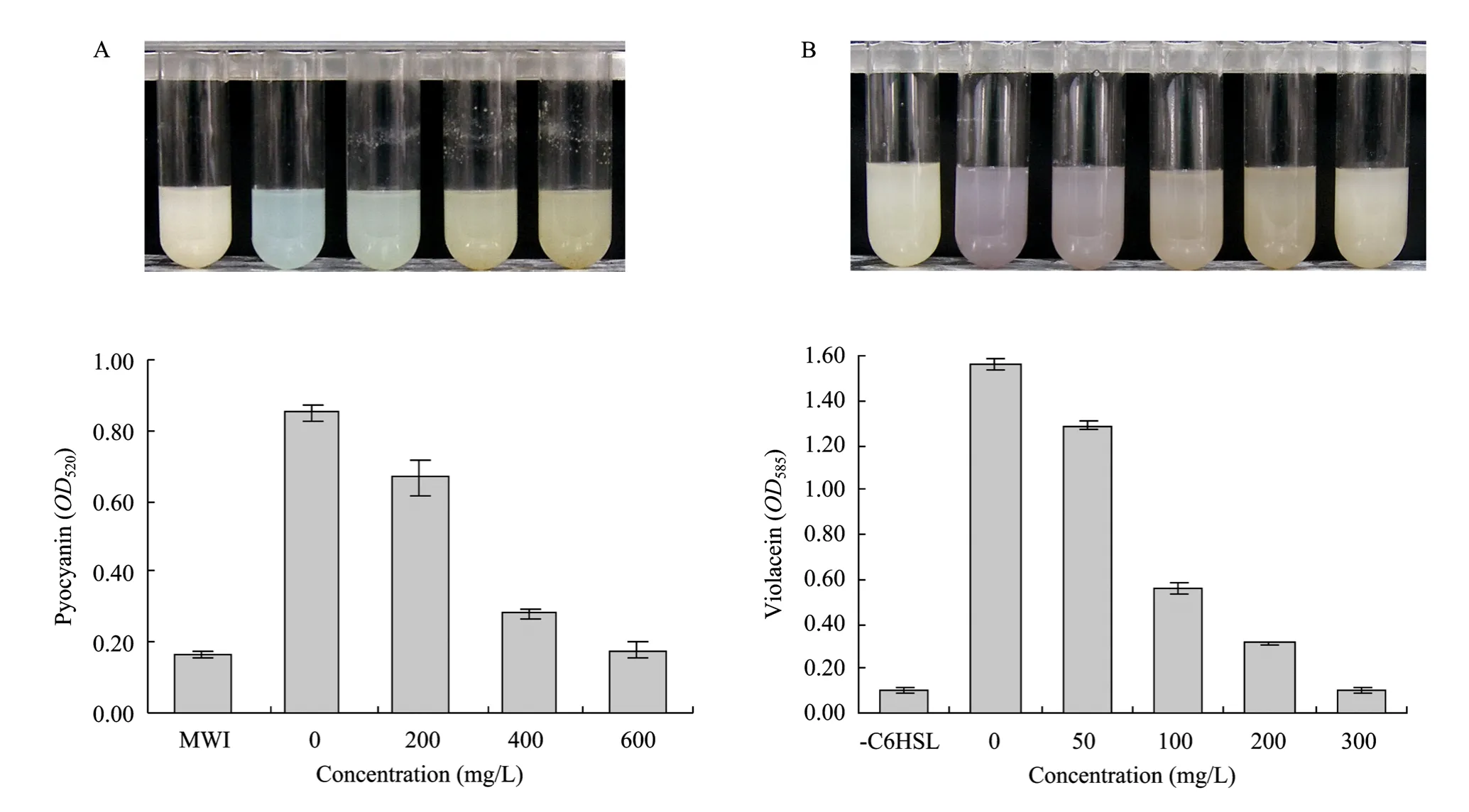
图3 不同浓度QY013粗提物对细菌表型的影响Fig. 3 Effects of QY013 extract on bacterial phenotypes. (A) Inhibition of pyocyanin production by different concentrations of QY013 extract. (B) Inhibition of violacein production by different concentrations of QY013 extract.
2.5 菌种鉴定
菌株QY013在PDA培养平皿上28 ℃生长4~7 d后,菌落直径达20~28 mm,菌落平坦,表面为暗灰绿色,中心气生菌丝为白色,呈绒絮状,向四周有放射性沟纹,大量粉状孢子极易脱落,菌落外圈呈白色;菌落背面中心呈浅黄色,少量放射性沟纹,四周呈现棕色,外圈呈白色 (图4);镜检特征如图5:菌丝体呈帚状,为典型青霉菌菌丝体特征,帚状枝由2~4个轮生的略分散的梗基组成,每个梗基上簇生2~4个密集平行的小梗,小梗上分生孢子成串状或链珠状,散落的单个孢子为球状或近似球状,非常光滑。
菌株QY013的18S rDNA测序后得到1 770 bp核酸序列,将菌株QY013的18S rDNA序列全部转换为FASTA格式,用Clustal X (version 1.83) 软件中的Alignment程序对所测得的18S rDNA序列和从GenBank中通过 Blastn检索获得的参考序列进行多重对位排列 (Multiple alignments),用MEGA (version 4.0) 软件包进行系统发育分析和进化树的构建,进化距离分析采用邻位相连法 (Neighbor-joining,NJ)。系统树的每个分支的统计学显著性分析以自展法(Bootstrap) 进行检验,重复次数为1 000次,结果显示,菌株 QY013与已经报道的青霉菌属亲缘关系接近,其中与菌株Penicillium sp. SA29 (AB304918.1)最近,其次与Penicillium decumbens L-06 (EU273880.1)亲缘关系较近 (图6)。因此,依照文献资料[25]和[26],结合形态学和 18S rDNA序列分析结果,初步鉴定QY013菌株属于青霉菌属Penicillium。

图4 QY013菌落形态特征Fig. 4 Colony morphology of strain QY013. (A) Obverse. (B) Reverse.
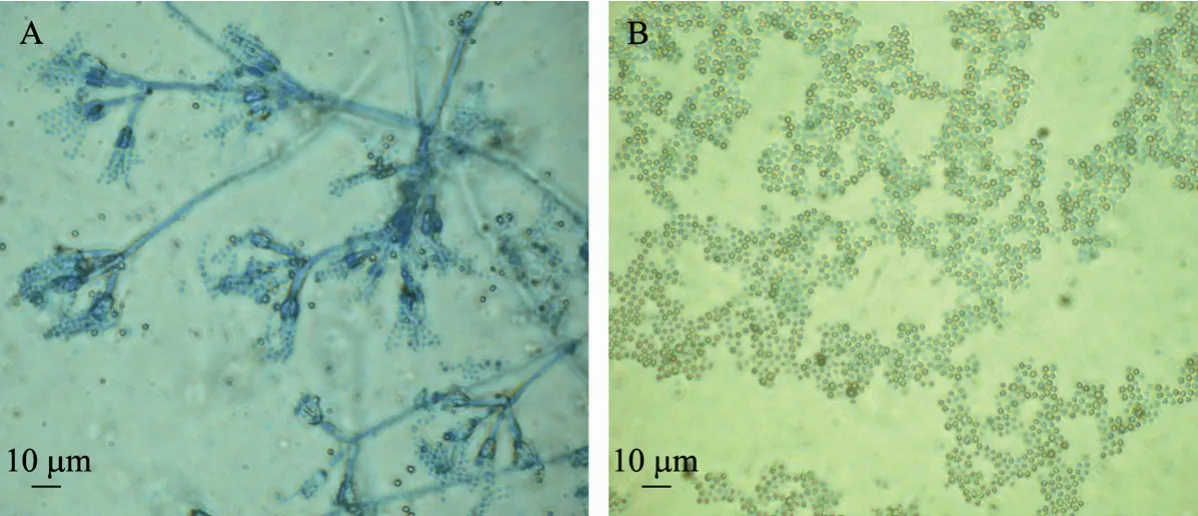
图5 QY013菌丝体和孢子形态特征Fig. 5 Morphological characteristics of mycelia and spores. (A) Mycelium. (B) Spores.

图6 QY013及近缘属种以18S rDNA序列为基础构建的系统发育树状关系图Fig. 6 Neighbor-Joining tree constructed showing the phylogenetic relaionships among QY013 and other related strains based on 18S rDNA sequence.
3 讨论
目前,临床上使用的抗菌药物大多是通过直接杀死或者抑制病原微生物的生长来达到抗感染的目的,但是在这种生存压力的选择下,极其容易使病原菌产生耐药性或菌群失调等负面作用。病原菌耐药性的出现和蔓延,已对人类健康构成了巨大威胁。例如,2010年南亚发现的携带NDM-1基因的“超级细菌”与传统的“多重耐药性菌株”(如耐甲氧金黄葡萄球菌) 相比,其耐药程度已经不再是仅仅针对几种抗生素,而是对绝大多数抗生素均不敏感,称为“泛耐药性”(Pan-drug resistance,PDR)[27-28]。QS系统是大多数病原细菌产生致病性的重要机理之一,许多致病因子的产生都受到其直接或间接的调控。而针对细菌 QS系统开发的新型抗菌药物与传统的抗菌药物的作用机制完全不同,只抑制细菌QS调控的致病行为,不影响细菌的生长,理论上不会导致细菌耐药性产生。因此,细菌 QS系统的研究为确认特异性的细菌毒力因子控制位点,以及合理设计抗毒力药物提供了靶点。同时 QS抑制因子和低剂量的抗生素联合给药相对于抗生素单独用药来说,也可能会起到更好的治疗细菌感染的效果[14]。因此,对病原菌 QS系统的研究已经成为当今研究的重点和热点。毋庸置疑,信号分子在病原菌凭借群体感应系统发挥致病作用的过程中起了关键性作用,因此,阻断细菌 QS主要有3条途径:抑制信号分子的产生;降解信号分子;阻断信号分子和受体蛋白的结合,而近年来大多数文献报道的主要是阻断信号分子和受体蛋白的结合,今后研究的重点应该更注重阻断QS的另外两条途径。
随着海洋活性物质研究的不断深入,近年来,已从海洋微生物的发酵产物中发现了大量具有新颖化学结构和特异生理功能的化合物,其中许多具有良好的抗菌、抗病毒、抗肿瘤活性。海洋微生物通常人工条件易发酵培养,并能够提供稳定的化合物来源,而且大多数正在使用的抗菌药物都是通过对天然活性化合物的改造修饰而来。自然环境中,多种微生物为了争夺营养物质和生存空间彼此之间存在着激烈竞争,在竞争过程中某些微生物可能会释放一些次级代谢产物来抑制或干扰其它微生物的正常代谢活动。Rasmussens等[29]利用基因芯片技术发现由青霉菌 (P. radicicola和P. coprobium) 产生的青霉酸和棒曲霉素能够抑制铜绿假单胞菌 QS调控的毒力基因的表达,但是这 2种化合物均证明对人体有细胞毒性。
本文在 QSIS2筛选模型的筛选方法上加以改进,在培养基中加入活菌染色剂TTC,使筛选结果易于检测和观察,从海洋软体动物体内分离69株海洋来源真菌,制备发酵液粗提物,利用改进的QSIS2筛选模型和紫色杆菌CV026指示菌株对真菌粗提物进行QS抑制活性的筛选发现1株青霉菌QY013具有细菌群体感应抑制活性;进一步实验检测QY013的发酵粗提物在不影响细菌生长的浓度范围内有效降低 QS调控的细菌毒力因子的产生。其中,该发酵粗提物中存在的抑制细菌 QS的有效化学成分正在进一步提取和分离中。
致谢:感谢Technical University of Denmark Michael Givskov教授提供的 QSIS2筛选模型,美国 Texas State University R.J.C.McLean教授提供菌株紫色杆菌CV026。
REFERENCES
[1] Fuqua WC, Winans SC, Greenberg EP. Quorum sensing in bacteria: the LuxR-LuxI family of cell density-responsive transcriptional regulators. J Bacteriol, 1994, 176(2): 269−275.
[2] Waters CM, Bassler BL. Quorum sensing: cell-to-cell communication in bacteria. Annu Rev Cell Dev Biol, 2005, 21(1): 319−346.
[3] An DD, Danhorn T, Fuqua C, et al. Quorum sensing and motility mediate interactions between Pseudomonas aeruginosa and Agrobacterium tumefaciens in biofilm cocultures. Proc Natl Acad Sci USA, 2006, 103(10): 3828−3833.
[4] Chatterjee A, Cui Y, Chatterjee AK. RsmA and the quorum-sensing signal, N-[3-oxohexanoyl]-L-homoserine lactone, control the levels of rsmB RNA in Erwinia carotovora subsp. carotovora by affecting its stability. J Bacteriol, 2002, 184(15): 4089−4095.
[5] Hammer BK, Bassler BL. Quorum sensing controls biofilm formation in Vibrio cholerae. Mol Microbiol, 2003, 50(1): 101−104.
[6] Hussain MBBM, Zhang HB, Xu JL, et al. The acyl-homoserine lactone-type quorum-sensing system modulates cell motility and virulence of Erwinia chrysanthemi pv. zeae. J Bacteriol, 2008, 190(3): 1045−1053.
[7] Kolodkin-Gal I, Hazan R, Gaathon A, et al. A linear pentapeptide is a quorum-sensing factor required for mazEF-mediated cell death in Escherichia coli. Science, 2007, 318(5850): 652−655.
[8] von Bodman SB, Majerczak DR, Coplin DL. A negative regulator mediates quorum-sensing control of exopolysaccharide production in Pantoea stewartii subsp. stewartii. Proc Natl Acad Sci USA, 1998, 95(13): 7687−7692.
[9] González JE, Keshavan ND. Messing with bacterial quorum sensing. Microbiol Mol Biol Rev, 2006, 70(4): 859−875.
[10] Williams P. Quorum sensing: an emerging target for antibacterial chemotherapy? Expert Opin Ther Targets, 2002, 6(3): 257−274.
[11] Rasmussen TB, Bjarnsholt T, Skindersoe ME, et al. Screening for quorum-sensing inhibitors (QSI) by use of a novel genetic system, the QSI selector. J Bacteriol, 2005, 187(5): 1799−1814.
[12] Sun WJ, Wang Y, Shen LX, et al. A novel screening system for Pseudomonas aeruginosa quorum sensing inhibitors. Chin J Biotech, 2009, 25(8): 1173−1179.孙玮洁, 王媛, 沈立新, 等. 铜绿假单胞菌群体感应抑制物筛选系统的构建及其应用. 生物工程学报, 2009, 25(8): 1173−1179.
[13] Schubert RH, Esanu JG, Esanu F. The methyleneblue-reduction-test (MR-test) and the micro-TTC-test for the determination of substances as sole source of carbon in the taxonomy of Pseudomonas species (author's transl). Zentralbl Bakteriol Orig B, 1975, 160(1): 50−59.
[14] McClean KH, Winson MK, Fish L, et al. Quorum sensing and Chromobacterium violaceum: exploitation of violacein production and inhibition for the detection of N-acylhomoserine lactones. Microbiology, 1997, 143(12): 3703−3711.
[15] Martinelli D, Grossmann G, Séquin U, et al. Effects of natural and chemically synthesized furanones on quorum sensing in Chromobacterium violaceum. BMC Microbiol, 2004, 4: 25.
[16] Rasmussen TB, Manefield M, Andersen JB, et al. How Delisea pulchra furanones affect quorum sensing and swarming motility in Serratia liquefaciens MG1. Microbiology, 2000, 146(12): 3237−3244.
[17] Hentzer M, Riedel K, Rasmussen TB, et al. Inhibition of quorum sensing in Pseudomonas aeruginosa biofilm bacteria by a halogenated furanone compound. Microbiology, 2002, 148(1): 87−102.
[18] Rasko DA, Moreira CG, Li DR, et al. Targeting QseC signaling and virulence for antibiotic development. Science, 2008, 321(5892): 1078−1080.
[19] Clarke MB, Hughes DT, Zhu CR, et al. The QseC sensor kinase: a bacterial adrenergic receptor. Proc Natl Acad Sci USA, 2006, 103(27): 10420−10425.
[20] Dao TH, Hoang KQ. Dephosphorylation and quantification of organic phosphorus in poultry litter by purified phytic-acid high affinity Aspergillus phosphohydrolases. Chemosphere, 2008, 72(11): 1782−1787.
[21] Essar DW, Eberly L, Hadero A, et al. Identification and characterization of genes for a second anthranilate synthase in Pseudomonas aeruginosa: interchangeability of the two anthranilate synthases and evolutionary implications. J Bacteriol, 1990, 172(2): 884−900.
[22] Choo JH, Rukayadi Y, Hwang JK. Inhibition of bacterial quorum sensing by vanilla extract. Lett Appl Microbiol, 2006, 42(6): 637−641.
[23] Pan JC, Ren DC. Quorum sensing inhibitors: a patent overview. Expert Opin Ther Pat, 2009, 19(11): 1581−1601.
[24] Reimer A, Edvaller B, Johansson B. Concentrations of the Pseudomonas aeruginosa toxin pyocyanin in human ear secretions. Acta Otolaryngol Suppl, 2000, 543: 86−88.
[25] Zhu JL, Qiu YP, Chen XY, et al. Identification of one cellulolytic fungus and study on its cellulase characteristics. J Anhui Agric Sci, 2008, 36(21): 9044−9046.朱建良, 邱晔平, 陈晓晔, 等. 1 株产纤维素酶真菌的鉴定及其酶学性质初探. 安徽农业科学, 2008, 36(21): 9044−9046.
[26] Liu YT, Xuan SX, Long CN, et al. Screening, identifying of cellulose-decomposing strain L-06 and its enzymeproducing conditions. Chin J Biotech, 2008, 24(6): 1112−1116.刘韫滔, 禤淑霞, 龙传南, 等. 纤维素降解菌L-06的筛选、鉴定及其产酶条件的分析. 生物工程学报, 2008, 24(6): 1112−1116.
[27] Kumarasamy KK, Toleman MA, Walsh TR, et al. Emergence of a new antibiotic resistance mechanism in India, Pakistan, and the UK: a molecular, biological, and epidemiological study. Lancet Infect Dis, 2010, 10(9): 597−602.
[28] Ippolito G, Leone S, Lauria FN, et al. Methicillin-resistant Staphylococcus aureus: the superbug. Int J Infect Dis, 2010, 14(S4): S7−S11.
[29] Rasmussen TB, Skindersoe ME, Bjarnsholt T, et al. Identity and effects of quorum-sensing inhibitors produced by Penicillium species. Microbiology, 2005, 151(5): 1325−1340.
