快速检测NDM-1基因的环介导恒温扩增技术的建立与评价
2011-02-09张苑怡武娜朱宝利陈蕾朱玉琢
张苑怡,武娜,朱宝利,陈蕾,朱玉琢
1 吉林大学 遗传学教研室,长春 130021
2 中国科学院微生物研究所 中国科学院病原微生物与免疫学重点实验室,北京 100101
3 北京蓝谱生物科技有限公司,北京 100101
抗生素是由微生物 (包括细菌、真菌、放线菌属) 或高等动植物在生活过程中所产生的具有抗病原体或其他活性的一类次级代谢产物,能干扰其他生物细胞发育功能的化学物质。抗生素可以通过抑制细菌细胞壁的合成、抑制细菌蛋白质的合成、抑制核酸的复制和转录以及干扰细菌代谢通路等多种药理途径杀灭细菌。由于一种抗生素只能针对一种或几种细菌产生抑制作用,因此医务人员在使用抗生素时,往往在用药剂量及抗生素类型方面具有多种选择,为临床抗生素污染埋下隐患[1-2]。近年来由于抗生素的不合理使用等多种原因,细菌耐药现象日益严重,大量耐药菌的出现使人们的生命健康又一次面临巨大挑战[3]。
据 2010年 8月 11日出版的英国 The Lancet Infectious Diseases期刊报道,目前有一种新的耐药基因在一些国家流行,一些西方医学家称其为NDM-1基因[4]。同时以blaNDM-1来命名编码NDM-1的基因。blaNDM-1已发现于肺炎克雷伯式氏菌的180 kb的质粒和大肠埃希氏菌的140 kb的质粒上,由NDM-1基因编码的酶全长269个氨基酸,与现有的其他金属-β-内酰胺酶 (Metallo-β-Lactamase) 比对,氨基酸序列的一致性不足33%,且在酶活性位点附近经常伴有独特的氨基酸残基及插入序列,并能与碳青霉烯类抗生素紧密结合[5]。在blaNDM-1基因上游的2个区域中还存在能够抵抗链霉素、红霉素、氯霉素、利福平等抗生素的基因以及消毒剂和磺胺药物的多种耐药基因[6-7]。由于含有 NDM-1基因的质粒既能在菌株之间穿梭传递,又可以在转移中发生重组,且通过携带NDM-1基因的质粒的传递,还可使对抗生素敏感的细菌获得多重耐药性,大大增加临床抗生素使用的困难[7]。目前含有blaNDM-1基因的细菌可以耐受除多粘菌素 (Colistin) 和氟喹诺酮(Fluoroquinolones) 以外的所有抗生素[8]。因此建立一种快速检测NDM-1基因的方法以及寻找NDM-1基因抗生素变得迫在眉睫。本实验的目的即是针对NDM-1基因,探索建立一种快速检测方法。
LAMP (Loop-Mediated Isothermal Amplification)法是2000年由Notomi等发明的一种新颖的恒温核酸扩增方法。该方法采用特异地识别靶序列上6个区域的4条引物 (2条外引物,2条内引物) 及具有链置换活性的Bst DNA聚合酶,在65 ℃左右进行核酸的指数级扩增,其扩增效率可达到 109~1010个拷贝数量级。整个反应仅需1 h,在扩增反应中副产物焦磷酸镁沉淀与钙黄绿素结合,产生黄绿色荧光,不需要借助其他仪器便可辨别实验结果。LAMP技术具有简便、快速、准确、廉价、易检测等特点[9-12]。目前,国内外尚未见LAMP方法检测NDM-1基因的报道,因此本文针对 NDM-1基因设计特异性引物,快速检测NDM-1基因。不仅可指导临床合理用药,以免延误病情和增加治疗费用,而且有利于控制其传播,防止爆发流行,这对提高治疗效果和控制医院内感染均有重要意义。
1 材料与方法
1.1 材料
1.1.1 样品来源
本研究使用的 4株试验菌株 (大肠埃希氏菌、金黄色葡萄球菌、肺炎克雷伯氏菌、肺炎链球菌) 由中国疾病预防控制中心菌种室提供。NDM-1基因模板由中国人民解放军军事医学科学院微生物流行病研究所杨瑞馥研究员提供,NDM-1基因序列全长873 bp。肠道菌群元基因组DNA、土壤菌群元基因组DNA为本实验室材料。
1.1.2 主要试剂和仪器
本研究所使用的LAMP法DNA反应试剂盒与荧光染料钙黄绿素均购自日本荣研化学株式会社;Loopamp浊度仪购自日本荣研化学株式会社;Loopamp反应管购自日本荣研化学株式会社;滤膜枪头购自Eppendorf公司及AXYGEN公司;电热恒温水浴锅 (DK-8D) 购自上海森信实验仪器有限公司。
1.2 方法
1.2.1 反应体系与反应条件
1) LAMP反应体系与反应条件:反应各组分终浓度为:内引物FIP和BIP各1.6 µmol/L,外引物FOP和BOP各0.2 µmol/L,环引物FLP和BLP各0.8 µmol/L,dNTPs 1.4 mmol/L,甜菜碱0.8 mol/L,Tris-HCl (pH 8.8) 20 mmol/L,KCl 10 mmol/L,(NH4)2SO410 mmol/L,MgSO48 mmol/L,Tween20 0.1%,Bst DNA聚合酶大片段8 U,模板2 µL,钙黄绿素1 µL,双蒸水定容至25 µL。LAMP反应条件:将25 µL的LAMP反应体系迅速置于65 ℃水浴锅,反应1 h后,置于 80 ℃ 5min,终止反应。
2) PCR反应体系与反应条件:反应各组分终浓度为:10 µmol/L上游引物 (5′-TGGACCGATGA CCAGACCG-3′) 和 10 µmol/L 下游引物 (5′-GAT CAGGCAGCCACCAAAA-3′) 各1 µL,2.5 mmol/L dNTPs 2 µL,5 U/µL Ex Taq酶 (TaKaRa) 0.125 µL,10×buffer 2.5 µL,模板2 µL,双蒸水定容至25 µL体系。PCR反应条件:预变性94 ℃ 5 min ;94 ℃1 min,60 ℃ 1 min ,72 ℃ 1 min 30 s,30个循环;72 ℃延伸10 min。
1.3 引物设计、合成与筛选
引物根据NDM-1基因序列 (GenBank Accession No. FN 396876.1),利用PrimerExplorer V4软件 (日本荣研株式会社)自行设计 4组引物 (编号分别为[1]、[28]、[43]、[75]),由上海英骏生物技术有限公司合成。将针对NDM-1基因设计的4组引物同时进行LAMP扩增,用Loopamp浊度仪同时检测4组引物扩增效率,以筛选最优的一组引物。
1.4 LAMP扩增产物判断方法
LAMP反应结束后,可以用3种方法鉴别是否发生了LAMP扩增:(A) 可以在反应前向体系中加入1 µL钙黄绿素,反应后观察溶液颜色变化。(B)可观察反应管中是否有白色焦磷酸镁沉淀。(C) 可直接通过Loopamp浊度仪观察。
1.5 灵敏度试验
Nanodrop测量NDM-1基因模板浓度A260为2.9 mg/L,用双蒸馏水进行10倍梯度稀释。
1.5.1 LAMP灵敏度试验
将NDM-1模板梯度稀释,选取2.9×10−6mg/L (6×103拷贝/反应) 到2.9×10−9mg/L (6拷贝/反应) 4个不同梯度为模板,并用水作空白对照,肺炎克雷伯氏菌和大肠埃希氏菌作阴性对照,进行LAMP扩增。并同时进行了3组平行试验,检测120 min。
1.5.2 PCR灵敏度试验
将NDM-1模板梯度稀释,选取2.9×10−1mg/L (6×108拷贝/反应) 到2.9×10−9mg/L (6拷贝/反应) 9个不同梯度为模板,并用水作空白对照,肺炎克雷伯氏菌作阴性对照,进行PCR扩增。
1.6 特异性试验
采用本研究中设计的LAMP引物和PCR引物,对 4株背景明确的菌株 (大肠埃希氏菌、金黄色葡萄球菌、肺炎克雷伯氏菌、肺炎链球菌) 以及肠道菌群元基因组DNA、土壤菌群元基因组DNA分别进行LAMP反应和PCR反应,以验证两种方法的特异性。
2 结果
2.1 LAMP引物筛选实验结果
将invitrogen公司合成的4对引物[1]、[28]、[43]、[75]以NDM-1为模板同时进行LAMP反应,4组引物均可以发生LAMP反应。观察反应曲线,其中[1]号引物扩增速率最快,出峰时间最早,因此选择[1]号产物组为NDM-1基因的LAMP扩增反应最优引物组。4组引物LAMP反应结果见图1。[1]号引物序列见表1。
2.2 LAMP实验结果的判别方法
以NDM-1基因模板作为阳性组,双蒸水作空白对照,肺炎克雷伯氏菌和大肠埃希氏菌作阴性对照,同时进行LAMP扩增。可以通过以下3种方法判断实验结果:1) 利用荧光显色法结果显示:阳性组出现了绿色荧光,空白对照组及阴性对照组仍为浅橙色荧光 (图 2A)。2) 可通过肉眼观察产物颜色变化来判定结果。结果显示:阳性组出现白色浑浊沉淀物,空白对照组及阴性对照组仍为无色透明状态(图 2B)。3) 通过 Loopamp浊度仪即可判定是否发生LAMP扩增。结果显示:阳性组由于出现了蓝色柱状扩增条带,而使模块由蓝色改变为红色。空白对照组及阴性对照组由于尚未出现蓝色柱状扩增条带,模块仍旧显示为蓝色。(图2C)。以上3种检测方法均可用琼脂糖凝胶电泳验证实验结果如下:阳性组出现LAMP扩增特异带型,空白对照组及阴性对照组未出现LAMP扩增条带。3种观察方法均证明发生了LAMP反应 (图2)。
2.3 灵敏度试验结果
将选取 (2.9×10−6mg/L到2.9×10−9mg/L) 4个不同梯度的NDM-1模板,进行LAMP扩增。并同时进行了 3组平行试验。用 LAMP浊度仪实时检测120 min,由于LAMP扩增反应目的条带呈梯状弥散条带,因此发生LAMP扩增反应时,其泳道呈现梯状目的条带,而未发生LAMP扩增反应,其泳道为空白。在3组LAMP灵敏度实验中,均发生了LAMP扩增反应,其中有两组最低检测灵敏度为2.9×10−9mg/L (6 拷贝/反应),与PCR方法检测灵敏度 2.9×10−6mg/L (6×103拷贝/反应) 相比提高了3个数量级 (图 3)。另外一组最低检测灵敏度为2.9×10−8mg/L (6×101拷贝/反应),与PCR方法检测灵敏度2.9×10−6mg/L (6×103拷贝/反应) 相比提高了2个数量级 (数据未显示)。
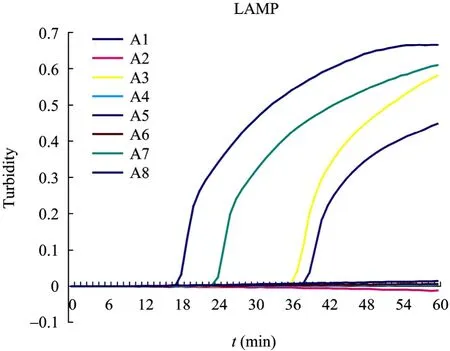
图1 LAMP扩增反应引物组筛选实验结果Fig. 1 Selection of four primer groups with LAMP method. The results of LAMP reaction: as for A1, A3, A5 and A7, LAMP carried out NDM-1 template DNA with primer [1], [75], [28] and [43], respectively; as for A2, A4, A6 and A8, LAMP carried out in the absence of template DNA with primer [1], [75], [28] and [43], respectively.
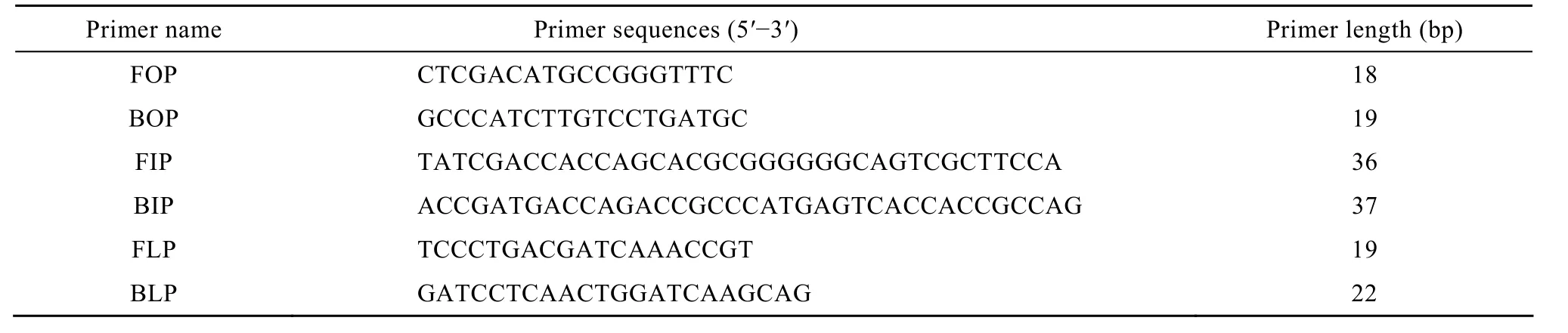
表1 [1]号组LAMP引物序列Table 1 Nucleotide sequences of the primers [1]
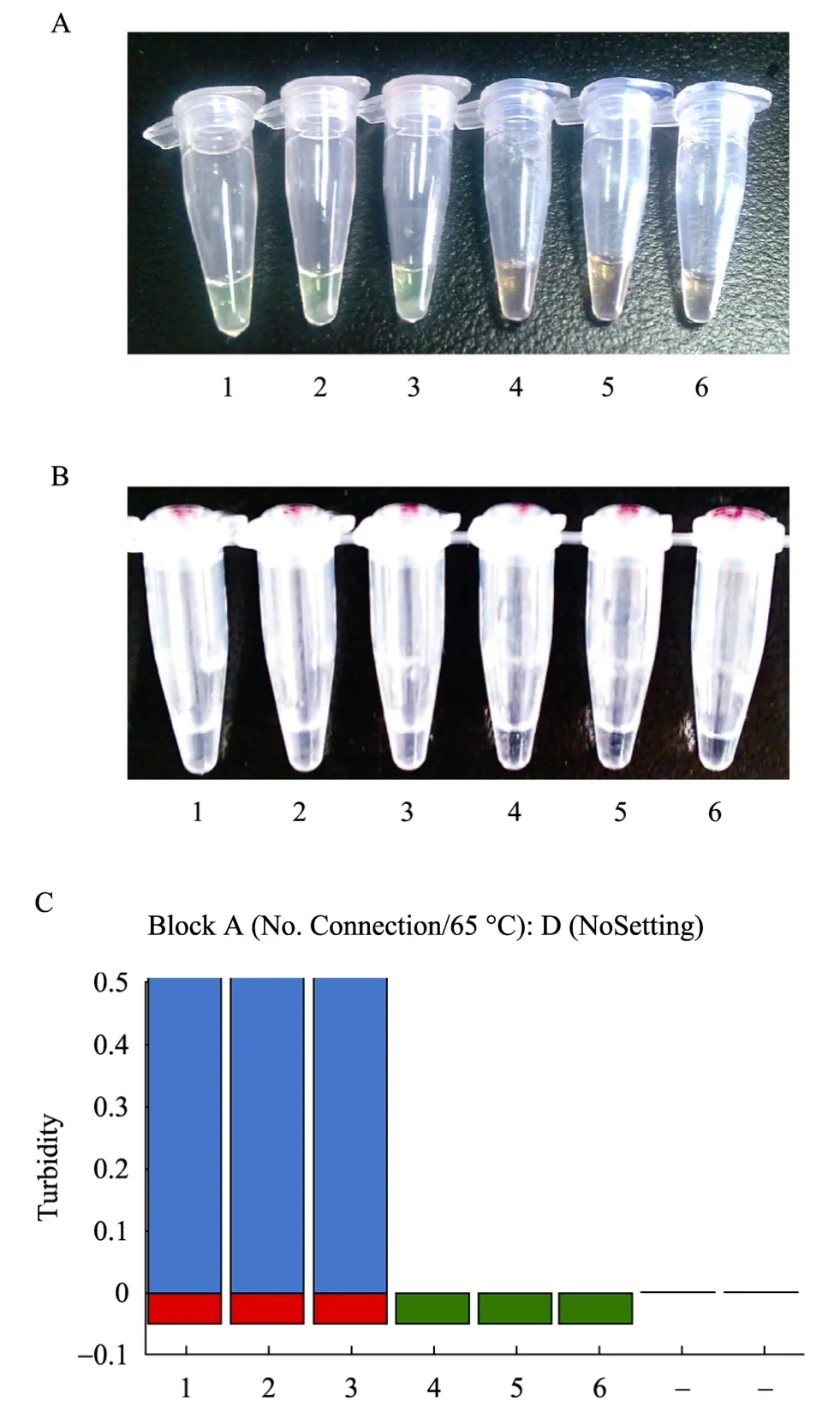
图2 LAMP扩增产物检测结果Fig. 2 Detection results of LAMP amplification. (A) Detection results of the LAMP reaction using inspection of the color change in calcein under visible light: tubes 1−3 showed the color change from original orange to bright-green. (B) Detection results of the LAMP reaction using the naked eye detection of the white tuebidity as a positive result: tubes 1−3 showed the white turbidity. (C) Detection results of the LAMP reaction using Loopamp turbidimeter: bar 1−3 showed the positive results.
2.4 NDM-1特异性试验结果
由于NDM-1基因是2008年发现的新基因,我们将此基因 (GenBank Accession No. FN 396876.1)在NCBI中经过BLAST比对分析后并未发现与其有同源性很高的序列,另据文献报道[5],NDM-1基因发现于肺炎克雷伯氏菌 Klebsiella pneumoniae 05-506的180 kb的质粒和大肠埃希氏菌的140 kb的质粒上。因此在特异性实验中,选择了4株背景明确的菌株 (大肠埃希氏菌、金黄色葡萄球菌、肺炎克雷伯氏菌、肺炎链球菌) 以及肠道菌群元基因组DNA、土壤菌群元基因组DNA分别进行LAMP反应和PCR反应,以验证两种方法的特异性。
采用本实验中设计的[1]号LAMP引物组和PCR引物,分别对4株背景明确的菌株及元基因组DNA进行扩增,结果显示均未发生阳性扩增 (图 4),说明[1]号LAMP引物组及PCR引物均能特异地检测NDM-1基因。根据LAMP引物设计原则,如模板序列中 6个区域中任何一个区域与引物不匹配均不能进行扩增反应。故LAMP方法特异性极高。
3 讨论
近年来由于抗生素滥用及抗生素累积的双重因素,使得细菌中的耐药基因不断积累,从而产生了多重抗药性[13]。目前,携带有NDM-1基因的超级细菌正在全球蔓延,印度、美国、英国、澳大利亚、加拿大、法国、荷兰等多个国家已经出现了疑似病例[4]。面对“超级细菌”的跨国传播趋势,寻找一种能够快速、安全的检测NDM-1基因的方法成为了人类与细菌这场竟备赛的亟待解决的首要问题。
本实验采用 LAMP技术针对肺炎克雷伯氏菌Klebsiella pneumoniae 05-506携带的NDM-1基因的序列设计了 4组特异性引物[5],LAMP扩增结果显示4组引物均可用于检测NDM-1耐药基因,通过进一步的试验筛选,最终确定了[1]号引物组为最优引物。引物的优化及筛选为快速、准确的检测NDM-1耐药基因打下坚实的基础。实验结果显示LAMP技术相对比传统的PCR扩增技术,在恒温条件下即可发生反应,摆脱了对于仪器的依赖。反应时间短,在l h内即可完成。LAMP技术的敏感性与特异性实验结果显示:对于NDM-1基因的检测,LAMP扩增敏感性比传统PCR扩增技术提高了3个数量级,最低检测限为6 拷贝/反应,且特异性良好。因反应产生了大量的焦磷酸镁沉淀,可直接目测结果、荧光显色分辨或用Loopamp浊度仪检测沉淀浊度。本实验方法弥补传统检测方法操作复杂、检测时间长、需要复杂仪器的检测弊端,建立了快速准确的NDM-1基因检测方法,表明该研究具有重要的应用价值。
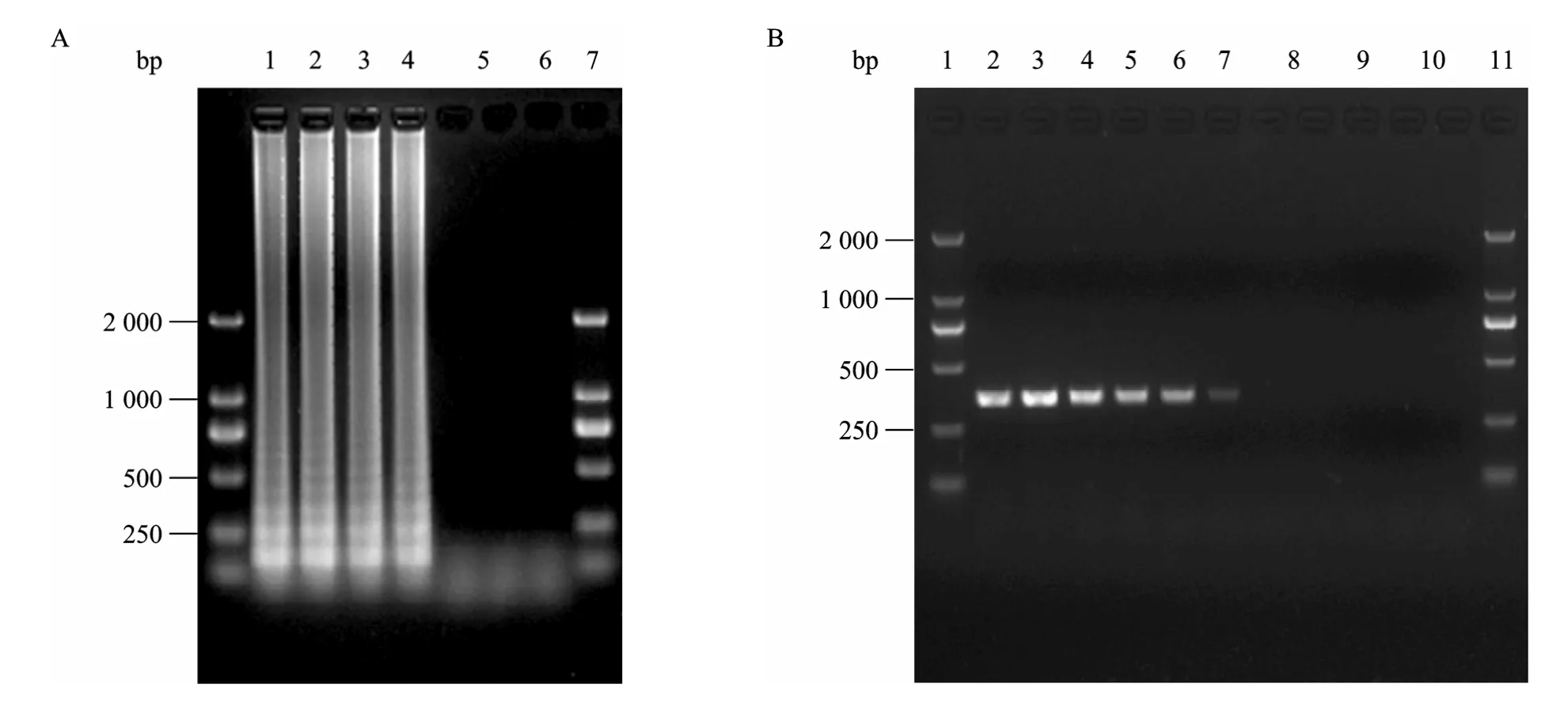
图3 LAMP及PCR灵敏度试验结果Fig. 3 The sensitivity of NDM-1 gene shown in LAMP and PCR methods. (A) The sensitivity of NDM-1 gene shown in LAMP. The first four lanes all have positive results. The other lanes all have negative results. 1: 2.9×10−6 mg/L; 2: 2.9×10−7 mg/L; 3: 2.9×10−8 mg/L; 4: 2.9×10−9 mg/L; 5: blank control; 6: negative control: the template with Klebsiella pneumoniae; 7: negative control: the template with Escherichia coli. (B) The sensitivity of NDM-1 gene shown in PCR. The first six lanes all have positive results. The other lanes all have negative results. 1: 2.9×10−1 mg/L; 2: 2.9×10−2 mg/L; 3: 2.9×10−3 mg/L; 4: 2.9×10−4 mg/L; 5: 2.9×10−5 mg/L; 6: 2.9×10−6 mg/L; 7: 2.9×10−7 mg/L; 8: 2.9×10−8 mg/L; 9: 2.9×10−9 mg/L; 10: blank control; 11: negative control: the template with Klebsiella pneumoniae.
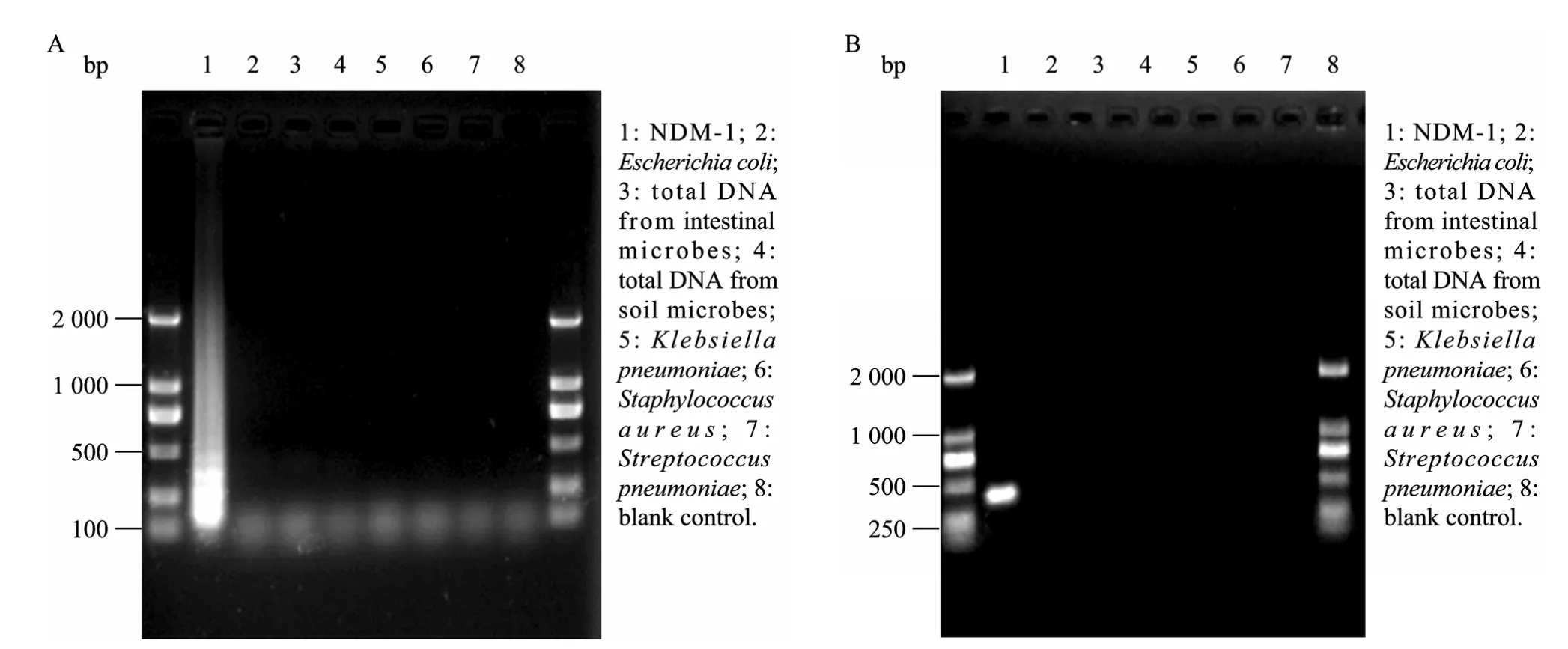
图4 LAMP及PCR特异性试验结果Fig. 4 The specificity of NDM-1 gene shown in LAMP and PCR methods. (A) The specificity of NDM-1 gene shown in LAMP. Lane 1, with NDM-1 template, was detected of positive result while the rest seven lanes, without NDM-1 template, was detected of negative result. (B) The specificity of NDM-1 gene shown in PCR. Lane 1, with NDM-1 template, was detected of positive result while the rest seven lanes, without NDM-1 template, was detected of negative result.
LAMP 技术具有许多扩增方法所无法比拟的优点。1) 只需一恒定温度就能进行扩增反应,摆脱了对于仪器的依赖。2) 高特异性:应用6个靶基因位点,内引物及外引物在 6个区域特异性结合方可进行扩增。3) 快速、高效扩增:整个扩增在不到60 min即可完成,且产率可达到0.5 g/L。4) 灵敏度高:最低检测限为 1~10拷贝。5) 步骤简单:所有试剂在反应前添加,实现一步核酸扩增。6) 鉴定简便:在核酸大量合成时,从dNTPs解离出的焦磷酸根离子与反应溶液中的Mg2+结合,产生副产物——焦磷酸镁沉淀。只要用肉眼观察或荧光显色就能够判断扩增与否,实现了结果可视化。
因此,环介导恒温扩增技术,在实际应用中表现出灵敏度高、速度快、特异性强、简便等特点。为 NDM-1基因以及其他病原微生物的检测提供了有力的技术支持。作为快速、便洁的检测方法,其广泛应用将大大提高低仪器配置地区的病原微生物检测能力,对病原微生物的早期、准确诊断有着重大意义。
REFERENCES
[1] Huttner B, Harbarth S. “Antibiotics are not automatic anymore”—the french national campaign to cut antibiotic overuse. PLoS Med, 2009, 6(6): e1000080.
[2] Harbarth S, Samore MH. Antimicrobial resistance determinants and future control. Emerg Infect Dis, 2005, 11(6): 794−801.
[3] Norrby SR, Nord CE, Finch R. Lack of development new antimicrobial drugs: a potential serious threat public health. Lancet Infect Dis, 2005, 5(2): 115−119.
[4] Kumarasamy KK, Toleman MA, Walsh TR, et al. Emergence of a new antibiotic resistance mechanism in India, Pakistan, and the UK: a molecular, biological, and epidemiological study. Lancet Infect Dis, 2010, 10(9): 597−602.
[5] Yong D, Toleman MA, Giske CG, et al. Characterization of a new metallo-beta-lactamase gene, bla (NDM-1), and a novel erythromycin esterase gene carried on a unique genetic structure in Klebsiella pneumoniae sequence type 14 from India. Antimicrob Agents Chemother, 2009, 53(12): 5046−5054.
[6] Walsh TR, Toleman MA, Poirel L, et al. Metallo-βlactamases: the quiet before the storm? Clin Microbiol Rev, 2005, 18(2): 306−325.
[7] Sun MW, Zheng BW, Gao GF, et al. Arms racing between human beings and pathogens: NDM-1 and superbugs. Chin J Biotech, 2010, 26(11): 1461−1472.孙明伟, 郑焙文, 高福, 等. 人类与病原菌的军备竞赛: NDM-1耐药基因与超级细菌. 生物工程学报, 2010, 26(11): 1461−1472.
[8] Sharma VK, Guleria R, Mehta V, et al. NDM-1 resistance: fleming’s predictions become true. Int J Appl Biol Pharm Technol, 2010, 1(3): 1244−1251.
[9] Notomi T, Okayama H, Masubuchi H, et al. Loopmediated isothermal amplification of DNA. Nucleic Acids Res, 2000, 28(12): e63.
[10] Aryana E, Makvandia M, Farajzadeha A, et al. A novel and more sensitive loop-mediated isothermal amplification assay targeting IS6110 for detection of Mycobacterium tuberculosis complex. Microbiol Res, 2010, 165(3): 211−220.
[11] Mori Y, Notomi T. Loop-mediated isothermal amplification (LAMP): a rapid, accurate, and cost-effective diagnostic method for infectious diseases. J Infect Chemother, 2009, 15(2): 62−69.
[12] Boehme CC, Nabeta P, Henostroza G, et al. Operational feasibility of using loop-mediated isothermal amplification for diagnosis of pulmonary tuberculosis in microscopy centers of developing countries. J Clin Microbiol, 2007, 45(6): 1936−1940.
