多主枝孢霉重组变应原Cla h8的制备及其免疫活性鉴定①
2011-02-06付永锋李雪萍程训佳复旦大学上海医学院病原生物学系上海200032
杨 柳 付永锋 李雪萍 冯 萌 程训佳 (复旦大学上海医学院病原生物学系,上海 200032)
多主枝孢霉重组变应原Cla h8的制备及其免疫活性鉴定①
杨 柳 付永锋 李雪萍 冯 萌 程训佳 (复旦大学上海医学院病原生物学系,上海 200032)
目的:通过基因工程手段,获得重组多主枝孢霉变应原蛋白Cla h8,有利于进行变应原的标准化,为标准化抗原的临床特异性诊断与治疗奠定基础。方法:从多主枝孢霉菌体中提取总RNA,采用RT-PCR的方法扩增Cla h8编码基因,将其连入pET-19b载体。转入大肠杆菌 BL21 Star(DE3)pLysS,经诱导表达后,进行提纯复性,用Western blot和 Dot-blot检测其免疫活性。结果:重组多主枝孢霉变应原Clah8蛋白可以与多主枝孢霉过敏患者的血清中IgE和IgG抗体特异性结合,与天然蛋白具有相似的免疫活性。结论:制备并获得了具有生物学活性的可溶性重组多主枝孢霉变应原Cla h8蛋白,可用于多主枝孢霉变应原的标准化,克服天然提取物的非单一性及标准化难的障碍。
多主枝孢霉;重组变应原Cla h8;蛋白表达;变应原活性
过敏性哮喘是危害严重的公共卫生问题,其发病率及死亡率呈持续上升趋势。环境中存在的各种变应原是过敏性哮喘主要诱发原因。这些变应原包括尘螨、动物的皮屑、花粉和霉菌等。在温湿环境中,霉菌是引起过敏性疾病的主要诱因。在全世界,霉菌可引起5%~30%的过敏患者的IgE反应[1]。多主枝孢霉(Cladosporiumherbarum)是引起过敏性疾病的主要霉菌之一,它不仅是一种主要的室内过敏原,也是夏秋两季主要的室外过敏原,可导致患者出现严重的过敏性哮喘[2]。
多主枝孢霉含有多种变应原蛋白,现已被成功纯化鉴定的变应原有8种。最近,纯化出Cla h8是一种NADP依赖性甘露醇脱氢酶(NADP-dependent M tDH),可被57%左右多主枝孢霉过敏患者血清中的IgE抗体特异性识别;临床皮肤点刺实验结果表明Cla h8可以引起患者出现皮肤的红肿,而其它7种变应原阳性检出率则不到22%[3]。因而,Cla h8是多主枝孢霉的主要变应原,可作为多主枝孢霉过敏患者的诊断和免疫治疗的候选分子。本研究从培养的多主枝孢霉获得cla h8基因并在大肠杆菌中进行表达,纯化制备出具有天然免疫活性的重组Cla h8,实现多主枝孢霉变应原的标准化,为了特异性诊断与免疫治疗奠定基础。
1 材料与方法
1.1 材料
1.1.1 菌株和载体 多主枝孢霉(C.herbarum)(ATCC 6056)购自美国ATCC菌种库;原核表达载体pET-19b购自美国Novagen公司;大肠杆菌JM 109感受态细胞购自大连TaKaRa公司;E.coliBL21 Star(DE3)pLysS购自美国Invitrogen公司。
1.1.2 主要实验材料 Rneasy Total RNA kit购自德国Qiagen公司;GeneAmp RNA PCR Kit购自美国Perkin-Elmer公司;Protein refolding kit购自 Novagen公司;Taq酶和100 bp Laddermaker购自大连TaKaRa公司;引物合成和测序由上海Invitrogen公司完成;His-probe(H-3)购自美国Santa公司;鼠抗Cla h8变应原单克隆抗体3G10和1F3由本实验室自制保存;本研究所用患者血清由福建莆田人民医院提供并存储于-80℃备用。
1.2 方法
1.2.1 多主枝孢霉的培养 将保存的多主枝孢霉(C.herbarum)菌株接种于100ml YPD培养基(10 g/L yeastextract,20 g/L peptone,20 g/L glucose,pH6.0~6.5),25~28℃培养6天,离心收集菌体沉淀,PBS缓冲液洗涤菌体三次,-80℃保存备用[4]。
1.2.2 重组表达质粒的构建 按照Rneasy Total RNA Kit的使用说明,提取多主枝孢霉菌体的总RNA,使用GeneAmp RNA PCRKit进行 RT-PCR,获得cDNA。根据GeneBank公布的cla h8的mRNA序列(AY191816)设计特异性引物,并加入NdeⅠ和BamHⅠ酶切位点和保护性碱基。上游引物为 5′-CCCATATGCCTGGCCAGCAAGCAA-3′,下游 引物 为 5′-CGGGATCCTTATCTGGTGGTGTAACCA-3′。 以 cDNA为模板,PCR扩增编码Cla h8成熟肽段的基因片段。经纯化的PCR产物以NdeⅠ和BamHⅠ酶切后,插入pET19b载体中。转入大肠杆菌JM109,将菌液涂布于LB琼脂板(含氨苄青 50μg/ml,氯霉素34μg/m l),37℃过夜培养后,提取质粒进行双酶切鉴定和测序鉴定。
1.2.3 重组多主枝孢霉变应原Cla h8表达 重组质粒 pET19b-Cla h8转入E.coliBL21 Star(DE3)pLysS后,挑取单菌落入800ml LB培养液中(含氨苄青霉素50μg/m l,氯霉素34μg/ml),37℃振摇培养至OD600约为0.5时,加终浓度为1mmol/L的异丙基-β-D-硫代半乳糖苷(Isopropylβ-D-1-Thiogalactopyranoside,IPTG),37℃诱导3小时后,4℃10 000 r/min离心10分钟,收集细菌沉淀。将沉淀超声后取其少量,12.5%SDS-PAGE电泳,观察结果。
1.2.4 重组多主枝孢霉变应原Cla h8纯化与复性参照Protein公司的refolding kit使用说明,细菌沉淀中,加入40 ml IB wash buffer和1 mmol/L苯甲基磺酰氟(Phenylmethanesulfonyl fluoride,PMSF),冰上超声后,加入溶菌酶(终浓度为200μg/m l)混匀,30℃振摇30分钟后,冰上超声,10 000 r/min离心10分钟,弃上清,反复洗涤直至沉淀的颜色一致。以12.5%的SDS-PAGE电泳检测蛋白纯度。将纯化复性后的蛋白,以DC Protein Assay试剂盒测定蛋白浓度后,4℃冰箱保存。
1.2.5 免疫印迹实验 参照Tachibana等人[5]的方法进行免疫印迹实验。多主枝孢霉浸提液和重组Cla h8进行还原SDS-PAGE电泳后,电转到醋酸纤维素膜上。以含5%脱脂奶的PBS于湿盒内室温封闭膜1小时;分别加His-probe(H-3)(1∶500稀释)、鼠抗Cla h8抗体3G10和1F3,多主枝孢霉过敏的哮喘病人血清(1∶2稀释),4℃孵育过夜;分别加HRP-goat Anti-mouse抗体(1∶500稀释),HRP-Mouse Anti-Human IgE抗体(1∶250稀释),室温孵育1小时;以Konica Immunostaining HRP-100显色,20分钟后终止反应,观察结果。
1.2.6 Dot blot检测 参照Tachibana等人的方法进行Dotblot检测[6]。分别将多主枝孢霉浸提物2μg和重组Cla h8蛋白2μg加样于硝酸纤维素膜上,室温干燥后,以含3%牛血清白蛋白的PBS湿盒内室温封闭1小时;分别加对多主枝孢霉过敏的哮喘病人血清(1∶2稀释和1∶100稀释),4℃孵育过夜;分别加HRP-Mouse Anti-Human IgE抗体(1∶250稀释)和HRP-Mouse Anti-Human IgG 抗体(1∶250稀释),室温孵育1小时;以Konica ImmunostainingHRP-100显色,20分钟后终止反应。
2 结果
2.1 RT-PCR反应扩增Cla h8基因 用RNA提取试剂盒提取多主枝孢霉的总RNA,用引物通过RTPCR反应扩增出Cla h8蛋白编码基因,PCR产物经2%琼脂糖凝胶电泳,结果显示在800 bp左右处有明显条带,大小与理论值(804 bp)相符(图1)。
2.2 重组表达载体的构建与序列分析 表达载体pET19b-Cla h8经NdeⅠ和BamHⅠ双酶切,电泳结果表明目标条带与clah8基因片段的PCR产物大小一致,说明成功构建了多主枝孢霉变应原Cla h8的重组质粒pET19b-Cla h8(图2)。对cla h8基因片段进行测序鉴定,并将该序列在GeneBank中进行注册(HQ317138)。与GeneBank中公布的序列(AY191816)进行比对,结果表明cla h8基因片段编码的氨基酸序列缺少C末端非编码区(由63个核苷酸组成),并有9个核苷酸位点与AY191816不同,但未引起氨基酸残基的改变。
2.3 重组蛋白Clah8的表达 以重组质粒pET19b-Cla h8转入 E.coli BL21 Star(DE3)pLysS,挑取转化子培养,进行诱导表达,菌体经超声破碎后,进行SDS-PAGE分析,结果显示在M r约为33 kD处有明显条带。超声破碎的上清中无目的蛋白,表达蛋白主要以包涵体的形式存在于沉淀中(图3A)。
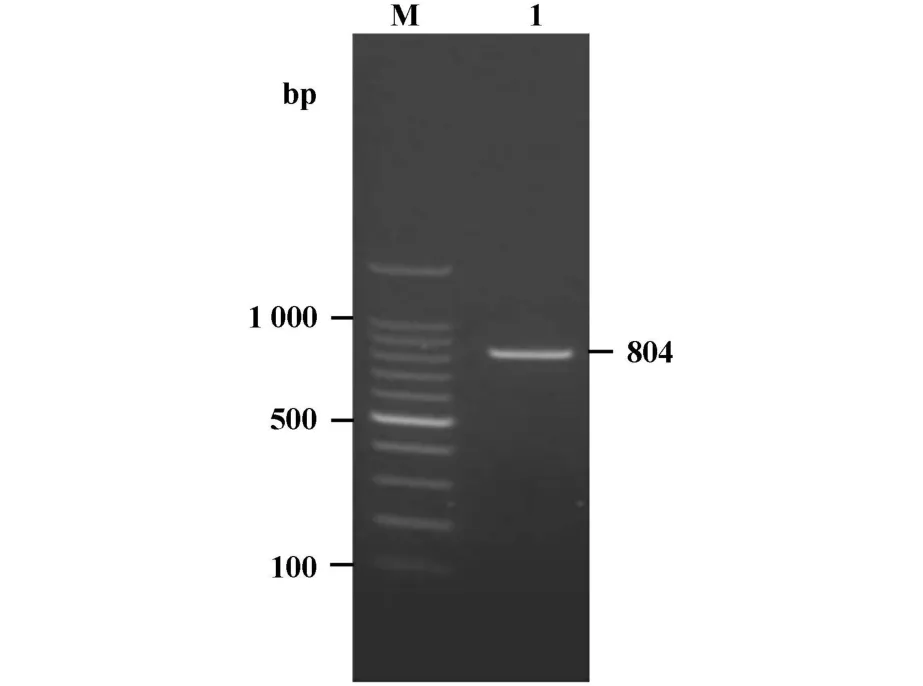
图1 cla h8基因RT-PCR产物琼脂糖凝胶电泳分析Fig.1 Argarose gel electrophoresis analysis of RT-PCR p roduction of cla h8 gene
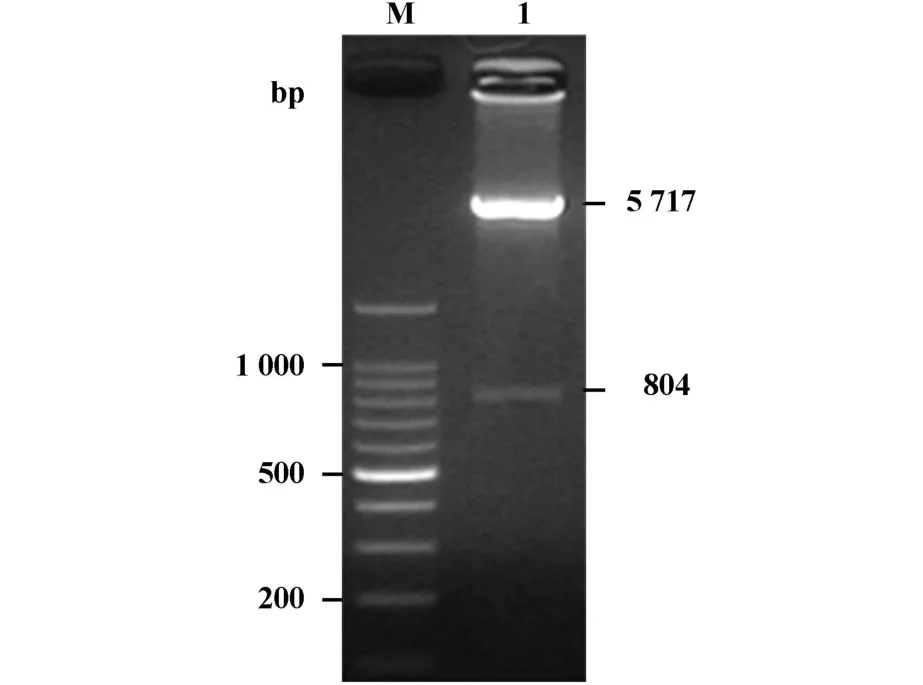
图2 重组表达载体pET19b-Cla h8的双酶切鉴定Fig.2 Doub le enzyme cutting result
2.4 重组蛋白Cla h8的纯化和复性 将包涵体反复洗涤以去除外膜蛋白,直至沉淀颜色一致,SDSPAGE电泳分析,可见较高纯度的包涵体(图3B)。经复性重构后,用SDS-PAGE电泳分析,结果显示目的蛋白纯度可达98%以上(图3C)。DCProtein Assay试剂盒测定所得纯化蛋白的浓度,最终结果表明每升培养液能够得到纯化重组蛋白22.5mg。
2.5 Western blot分析 经过还原条件SDS-PAGE转膜后,用本实验室筛选出的重组Cla h8的单抗细胞株3G10和1F3分别作用于重组蛋白和天然蛋白,重组蛋白在33 kD处有明显条带,天然蛋白在31 kD处有明显条带(图4)。多主枝孢霉过敏病人血清中的IgE抗体可与重组Cla h8蛋白特异性结合,其中2号病人反应性最强(图5)。
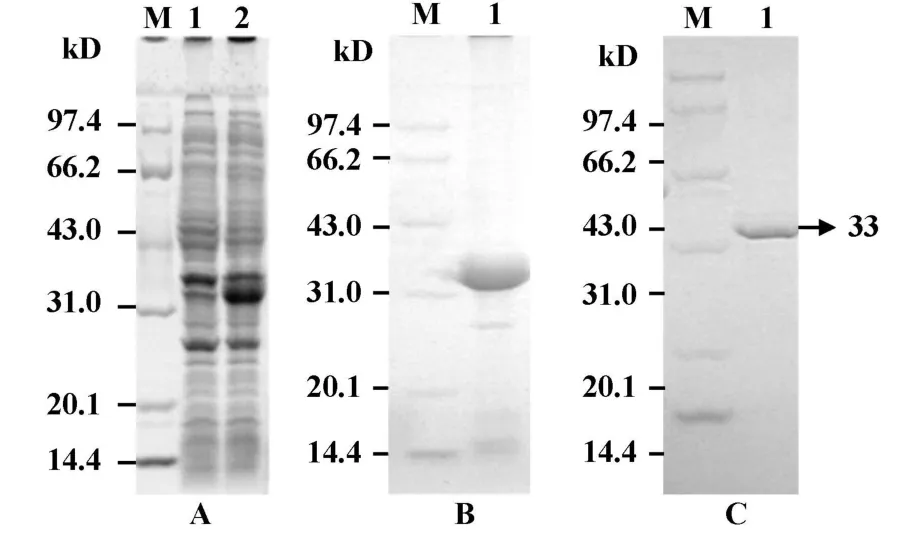
图3 重组蛋白Cla h8的SDS-PAGE分析图Fig.3 SDS-PAGE analysis of the recombinant Cla h8 protein

图4 单克隆抗体与多主枝孢霉变应原的反应性Fig.4 Responses of the monoclonal antibodies to Cladosporium herbarum allergen

图5 目的蛋白 Cla h8的Western blot鉴定Fig.5 Western b lot analysis of Cla h8 p rotein

图6 目的蛋白 Cla h8的Dot blot鉴定Fig.6 Dot blotanalysis of Cla h8 p rotein
2.6 Dot blot检测 多主枝孢霉浸提物和重组Cla h8蛋白均可与多主枝孢霉过敏的哮喘病人血清中的IgE和IgG发生特异性结合。重组Cla h8蛋白与病人血清中的IgE和IgG抗体的反应性要强于多主枝孢霉的浸提液(图6)。
3 讨论
变应原可引起不同程度的过敏性疾病,以哮喘最为常见。全世界现有3亿的哮喘患者,其中50%以上的成人和至少80%的儿童患者均由各种环境中的变应原诱发,每年有25万以上的患者死于哮喘。霉菌是引起变态反应性疾病的主要原因之一,其中多主枝孢霉和链隔孢霉是主要的致敏真菌。在美国波特兰市,30%的哮喘患者与对多主枝孢霉过敏有关[7]。因此,真菌变应原对于变态反应性疾病的诊断与治疗具有重要意义,但由于真菌变应原蛋白的组分受多种因素影响,以及天然真菌提取液中变应原种类繁多,造成制备标准化制剂的难度极大,故限制了它在临床上的应用[8]。
多主枝孢霉变应原Clah8是一种NADP依赖性甘露醇脱氢酶(NADP-dependentMtDH),是多主枝孢霉的主要变应原蛋白,可被57%左右多主枝孢霉过敏患者血清中的IgE抗体特异性识别,并且皮肤点刺实验可引起患者出现皮肤的红肿[3]。本研究中,3个对多主枝孢霉过敏的患者血清中IgG和IgE抗体都能与重组Cla h8特异性的结合,说明Cla h8作为多主枝孢霉的主要变应原,可以作为对多主枝孢霉过敏患者的诊断和特异性免疫治疗的候选分子。
利用DNA重组技术制备霉菌的主要变应原,具有成分单一,活性稳定,操作简单的优点,有利于工艺流程的标准化。pET载体系统是一种原核表达载体,本研究采用的是pET19b,其特点可以在重组蛋白的N末端具有10个组氨酸标签以利于蛋白纯化,因此重组Cla h8比天然蛋白分子大2 kD左右,而组氨酸标签对重组蛋白生物学活性影响不大。由于目的蛋白在大肠杆菌BL21 Star(DE3)pLysS中高效表达,蛋白聚积形成不溶性的包涵体蛋白,为此需对包涵体蛋白进行变性重构使其成为与天然蛋白相似的可溶性蛋白。包涵体蛋白的变性重构的关键是复性后的可溶性蛋白和天然蛋白具有相同的生物活性。在还原条件下,重组Cla h8和天然蛋白都能被抗Cla h8鼠单抗和对多主枝孢霉过敏病人血清中的IgE和IgG特异性识别,说明重组变应原与天然蛋白具有相同线性抗原表位。非还原条件下的Dot bolt也证实重组变应原与天然蛋白具有相同抗原活性。
本研究利用DNA重组技术建立了Cla h8变应原蛋白的制备方法,鉴定了其良好的免疫学活性。为大量制备标准化真菌变应原诊断试剂,推进临床应用标准化抗原特异性免疫治疗奠定了良好基础。
1 HornerW E,Helbling A,Salvaggio JEetal.Fungal allergens[J].Clin Microbiol Rev,1995;8:161-179.
2 Zureik M,Neukirch C,Leynaert Betal.Sensitisation to airbornemoulds and severity of asthma:cross sectional study from European Community respiratory health survey[J].BMJ,2002;325:411-414.
3 Simon-Nobbe B,Denk U,SchneiderP Betal.NADP-dependentmannitol dehydrogenase,a major allergen of Cladosporium herbarum[J].J Biol Chem,2006;281:16354-16360.
4 AchatzG,Oberkofler H,Lechenauer Eetal.Molecular cloning ofmajor andm inor allergens of A lternaria alternata and Cladosporium herbarum[J].Mol Immunol,1995;32:213-227.
5 Tachibana H,Cheng X J,MasudaGetal.Evaluation of recombinant fragments of Entamoeba histolytica Gal/GalNAc lectin intermediate subunit for serodiagnosisof amebiasis[J].JClinM icrobiol,2004;42:1069-1074.
6 Tachibana H,Watanabe K,Cheng X Jetal.VH3 gene usage in neutralizing human antibodies specific for the Entamoeba histolytica Gal/GalNAc lectin heavy subunit[J].Infect Immun,2003;71:4313-4319.
7 Hasnain SM,Al-Frayh A S,Al-Suwaine Aetal.Cladosporium and respiratory allergy:diagnostic implications in Saudi Arabia[J].Mycopathologia,2004;157:171-179.
8 American Academy of A llergy,Asthma and Immunology(AAAAI).The useof standardized allergen extracts[J].JAllergy Clin Immunol,1997;99:583-586.
[收稿2010-11-27 修回2011-01-11]
(编辑 张晓舟)
Production of recombinantCladosporiumherbarumallergen Cla h8 and investigation on its immunological activities
YANGLiu,FUYong-Feng,LIXue-Ping,FENGMeng,CHENGXun-Jia.DepartmentofMedicalMicrobiologyandparasitology,ShanghaiMedicalCollegeofFudanUniversity,Shanghai200032,China
Objective:To gain large amount of recombinant allergen Cla h8 ofCladosporiumherbarumthrough genetic engineering method,which notonly facilitates the standardization of allergen vaccination,butalso ismore suitable fordiagnosis and treatment.Methods:The total RNA was acquired fromC.herbarumculture,then the clah8 gene fragments amplified by RT-PCRwas cloned into vector pET-19b and then transformed toE.coliBL21 Star(DE3)pLysS.After induction,Cla h8 was expressed as inclusion body inE.coliBL21 Star(DE3)pLysS.The solub le protein,following purification and renaturation,was obtained.The immunological activity was identified by Dot-blot and Western blot.Results:The IgE and IgG of the serum fromC.herbarumallergic patients could specially reactwith the recombinantClah8(rCla h8),and the immunologicalactivity of rCla h8was comparablewith the native protein.Conclusion:We have successfu lly obtained the recombinantCla h8 equippedwith immunologicalactivity,which leads to significant improvements in allergy diagnosis and treatment.The approach has also resolved the problems of natural allergen extracts associated withmulti-componentand difficult standardization.
Cladosporiumherbarum;Recombinantallergen Cla h8;Protein expression;IgE
R392.8
A
1000-484X(2011)05-0446-04
10.3969/j.issn.1000-484X.2011.05.015
①本文受国家高技术研究发展计划项目(2007AA02Z472)和卫生行业科研专项项目(20082001)资助
杨 柳(1983年-),女,在读硕士,主要从事过敏性疾病诊断与防治研究;
及指导教师:程训佳(1960年-),女,博士,教授,博士生导师,主要从事过敏性疾病诊断、防治和医学原虫的致病机制与分子生物学研究,E-mail:xjcheng@shmu.edu.cn。
