复方头孢克洛干混悬剂处方工艺及质量研究
2011-01-27刘哲鹏施与群
刘哲鹏,潘 风,施与群
[1.上海理工大学医疗器械与食品学院药物制剂(设备与工艺)研究所,上海200093;2.上海美优制药有限公司产品开发部,上海201423]
头孢克洛(cefaclor)为广谱半合成头孢菌素类抗生素,对G+菌和G—杆菌效果均较好。盐酸溴己新(bromhexine hydrochloride)为祛痰药。将头孢克洛与盐酸溴己新制成复方头孢克洛干混悬剂(siccative compound cefaclor suspension,SCCS),可用于咽炎、扁桃体炎、慢性支气管炎急性发作、肺炎、鼻窦炎等的治疗,效果良好。干混悬剂药物吸收快,易储存、携带,病人服用方便,尤其适合吞咽困难的病人服用[1,2]。由于头孢菌素类药物对湿、热等外界条件比较敏感,因此对于SCCS的处方工艺开发难度较大,特别是在研究过程中常会出现药物降解产物含量超标、药物含量均匀度不合格等问题,影响了产品质量和临床应用[3,4]。本研究针对 SCCS处方工艺开展研究,得到合适处方,并考察样品的稳定性,最终得到可以进行临床研究的处方工艺条件。
1 仪器和试药
1.1 仪器 D IONEX P680型高效液相色谱仪(美国戴安公司);GL-5型干法制粒机(浙江明天机械有限公司);RCZ-6CZ型药物溶出度仪(上海黄海药检仪器有限公司);低温光照仪(药物制剂国家工程研究中心);GSP-9050MBE型隔水式恒温培养箱(上海博讯实业有限公司医疗设备厂);BPS-250C恒温恒湿箱(上海一恒科技有限公司)。
1.2 药品和试剂 头孢克洛原药(苏州中联化学制药有限公司,含量99.68%,批号20109194);头孢克洛对照品(中国药品生物制品检定所,含量93.2%,批号130481-200503);盐酸溴己新原药(浙江万邦药业,含量100.4%,批号H090205);盐酸溴己新对照品(上海市食品药品检验所标定,含量99.8%,批号040918);羧甲基纤维素钠(安徽山河药用辅料有限公司);羧甲基淀粉钠(永日化学工业股份有限公司);蔗糖(苏州市中泰药用辅料有限公司);甜菊素(天津南大凯泰药业有限公司);枸橼酸(浙江省台山市新宁制药有限公司);日落黄(上海染料研究所有限公司);桔子香精(上海孔雀香精香料有限公司);硬脂酸镁(浙江省海盐六和淀粉化工有限公司);微粉硅胶(上海昌为医药辅料技术有限公司);SCCS [上海理工大学医疗器械与食品学院药物制剂(设备与工艺)研究所自制,规格:每包含头孢克洛250 mg,盐酸溴己新8.77 mg]。
2 方法和结果
2.1 含量测定及有关物质检查 (1)头孢克洛色谱条件 Welchrom-C18色谱柱(150 mm×4.6 mm, 5μm);流动相:含0.005 mol/L四丁基氢氧化铵溶液[磷酸调节p H值(3.2±0.1)]-甲醇(68∶32);流速1.2 m l/min;检测波长249 nm;进样量20μl。理论塔板数按头孢克洛峰计应≥3 000,头孢克洛峰与相邻杂质峰的分离度>1.5。该色谱条件下,各辅料对头孢克洛检测无干扰,峰形良好,保留时间约3.0 min。头孢克洛浓度在215.6~593.7μg/m l范围内与峰面积线性关系良好,日间和日内RSD值均<0.5%,相对回收率为98.3%~101.5%。(2)盐酸溴己新色谱条件 Welchrom-C18色谱柱(150 mm×4.6 mm,5μm);流动相:含0.01 mol/L三乙胺甲醇溶液-甲醇-水(1.5∶95∶5);流速1.2 m l/min;检测波长249 nm;进样量20μl。理论塔板数按盐酸溴己新峰计应≥1 500,盐酸溴己新峰与相邻杂质峰的分离度>1.5。该色谱条件下,各辅料对盐酸溴己新检测无干扰,峰形良好,保留时间约6.5 min。盐酸溴己新浓度在7.24~21.67μg/m l范围内与峰面积线性关系良好,日间和日内RSD值均<0.4%,相对回收率为97.7%~101.6%。
SCCS中盐酸溴己新的含量均匀度测定方法按盐酸溴己新的含量测定方法测定,计算 A+1.8 S (《中华人民共和国药典》2010年版中规定的含量均匀度计算公式,其中A表示药物标示量与均值之差的绝对值;S表示标准差),即得。
取SCCS细粉适量(约相当于含头孢克洛100 mg),置于100 m l量瓶中,加头孢克洛色谱条件项下流动相适量,强力振摇2 min,超声5 min,放冷,再用该流动相稀释至刻度,摇匀,滤过,取续滤液得到供试品溶液。精密量取1 m l,置50 m l量瓶中,加该流动相稀释至刻度,摇匀,得到对照溶液;准确量取上述溶液各20μl,按头孢克洛色谱条件进样测定,记录色谱图至主成分峰保留时间的2.5倍;供试品溶液的色谱图中如出现杂质峰(扣除系统溶剂峰、辅料峰),量取各杂质峰峰面积之和,将之与对照品溶液峰面积比较,得到头孢克洛有关物质含量[3]。另取 SCCS细粉适量(约相当于含盐酸溴己新3.5 mg),置于100 m l量瓶中,加盐酸溴己新色谱条件项下流动相适量,其他操作同上,得到盐酸溴己新有关物质含量。
2.2 溶出度测定[5]
2.2.1 头孢克洛溶出度测定 取SCCS样品6份,按《中华人民共和国药典》2010年版附录ⅩC第一法检测其溶出度,800 m l水为介质,75 r/min转速。30 min后,取溶液10 m l,0.45μm微孔滤膜滤过,准确量取上述溶液20μl,按头孢克洛色谱条件进样测定,记录色谱图。另取头孢克洛对照品31.3 mg,置100 m l量瓶中,加水溶解并定容,制成含药物313μg/m l溶液,同法测定。按外标法以峰面积计算,即得每包中头孢克洛的溶出量。
2.2.2 盐酸溴己新溶出度测定 取SCCS样品6份,500 m l水为介质,余同2.2.1项相关操作,按盐酸溴己新色谱条件进样测定,记录色谱图。另取盐酸溴己新对照品17.5 mg,置100 m l量瓶中,加甲醇10 m l溶解并用水定容至刻度。移取1 m l于10 m l量瓶中,用水定容至刻度,得到含药物17.5μg/m l的溶液,同法测定。按外标法以峰面积计算,即得每包中盐酸溴己新的溶出量。
2.3 休止角测定 底盘为直径5.5 cm的培养皿,将两只玻璃漏斗上下交错重叠,固定在铁架台上,下漏斗出口与底盘距离为3.0~5.0 cm。取颗粒约45 g,从上部漏斗慢慢加入,使颗粒经过两只漏斗的缓冲逐渐堆积在底盘上,形成锥体,直至得到最高的锥体为止。测定锥体的高(H),按下式计算休止角: α=arctg(H/R)。其中,α为休止角,R为底盘半径。
2.4 沉降体积比 取供试品约7 g置具塞量筒中,加水10 m l,密塞,用力振摇1 min,观察分散情况,同时记下混悬剂开始高度 H0。静置3 h,记下混悬剂最终高度 H,计算沉降体积比=H/H0。
2.5 口感考察 用含量均匀度实验后剩下的样品考察其口感。
2.6 SCCS影响因素考察及处方筛选
2.6.1 头孢克洛、盐酸溴己新与辅料间的影响因素实验 取头孢克洛、盐酸溴己新原药,分别与羧甲基纤维素钠、羧甲基淀粉钠、蔗糖、甜菊素、枸橼酸、微粉硅胶、硬脂酸镁等辅料两两混匀后,粉末直接压制成片状物,将片状物分别放置在40℃隔水式恒温培养箱、低温光照仪和内置有饱和氯化钠溶液的干燥器内进行高温(40℃)、强光照射(光照强度为4 500 lx)和高湿[25℃,湿度(75±5)%)]等影响因素实验,于0、5、10 d取样,按有关物质检查方法,主成分自身对照法考察其有关物质变化,结果见表1。另取头孢克洛、盐酸溴己新原药,分别以药用乙醇作为湿润剂制软材,过20目筛制粒,制得的颗粒在60℃干燥,比较处理前后药物有关物质变化。结果制粒前、后头孢克洛有关物质含量分别为0.68%和1.43%,盐酸溴己新分别为0.57%和2.41%。可见头孢克洛、盐酸溴己新经过湿法制粒后有关物质变化明显,提示药物对湿热等条件敏感。药物与各辅料混匀后,粉末直接压片,影响因素考察结果显示,药物与羧甲基淀粉钠经影响因素考察后有关物质上升较明显,因此在处方筛选中不使用羧甲基淀粉钠。另外,羧甲基纤维素钠、蔗糖、枸橼酸在高湿条件下,有关物质也有较大变化,提示干混悬剂应密封、干燥保存。
2.6.2 单因素筛选SCCS的处方 将头孢克洛原药、盐酸溴己新原药和辅料分别过100目筛后,按表2处方混合均匀,其中盐酸溴己新原药与其他原辅料以等量递加的方式混合均匀。GL-5型干法制粒机制粒(压轮压力80 kN,压缩空气0.5 M Pa,流量1 L/m in),颗粒经20目筛网整粒,即得,制备环境相对湿度控制在50%以下。考察各处方所得颗粒的外观、口感、颗粒休止角、沉降体积比和溶出度,结果见表3。处方1~3颗粒口感稍有苦味,且处方1沉降体积比稍低,处方3加水分散性稍差;处方6颗粒口感酸味稍大,处方4和5口感较好,并且颗粒休止角、加水分散性、沉降体积比、药物溶出度等指标均较好。将处方4和5所得样品进行影响因素考察,结果见表4。影响因素考察结果显示,处方4和处方5制得样品在相对湿度较高情况下(75%)有关物质上升较明显,提示干混悬剂应在密封、干燥的条件下保存。两者影响因素考察结果(药物溶出、有关物质等)相近,经过综合考虑,处方4更好一些。
2.7 SCCS试制及影响因素和加速考察结果 按处方4和2.6.2项下颗粒制备方法制备SCCS 3批,样品用双铝复合袋包装后,进行加速实验考察[(30±2)℃,相对湿度75%]。结果显示,试制3批SCCS经加速6个月考察后,其性状、药物含量、药物降解有关物质等质量指标未见显著变化。
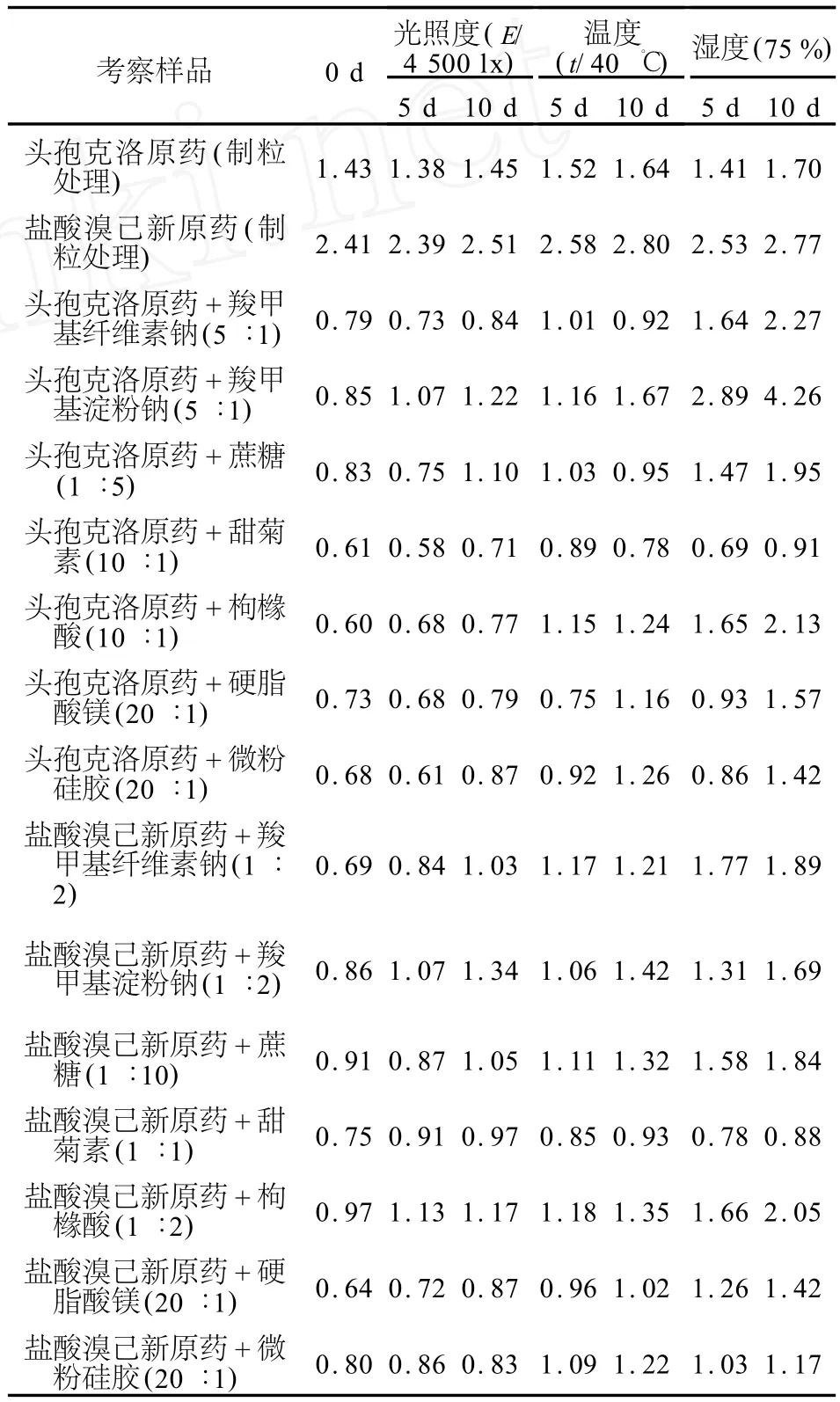
表1 头孢克洛、盐酸溴己新原药与各辅料影响因素实验中有关物质的变化Table 1 The changes of related substances in influence factor tests between cefaclor/bromhexine hydrochloride and excipients (%)
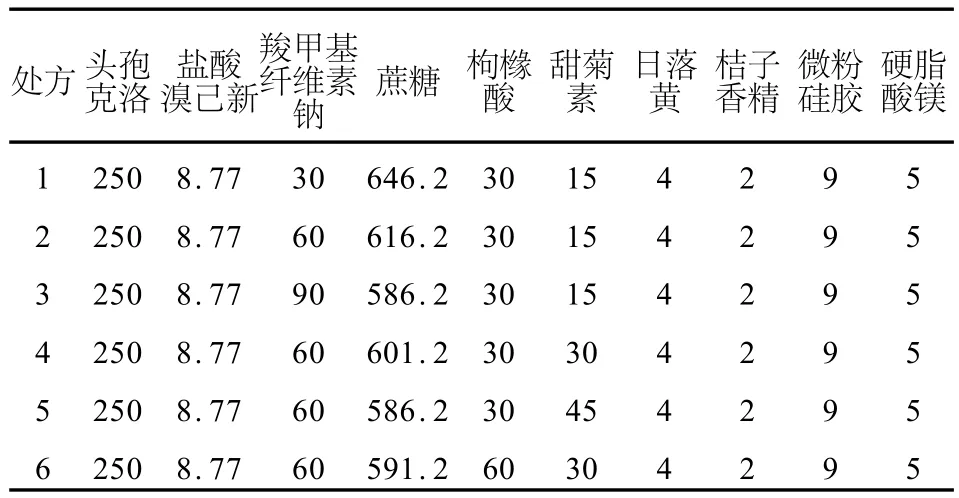
表2 复方头孢克洛干混悬剂处方筛选Table 2 Screen ing formulae of siccative compound cefaclor suspension (m/g)
3 讨 论
干混悬剂的开发应特别关注口感及药物降解有关物质的变化。在矫味剂的选择中,合适的甜度对口感影响较大,除了有适量的甜味剂外,填充辅料也多选用口感好的蔗糖、甘露醇等,另外在处方中有一定量的酸味剂存在,特别有助于调节口感。
在干混悬剂的处方中,除了填充剂外,另有较多量的矫味剂(包括酸性矫味剂)、助悬剂、色素等,这对药物在制剂制备过程及以后的储存过程中的稳定性带来挑战。特别是头孢克洛和盐酸溴己新对光、热等外界条件较敏感,易产生降解产物。作者在处方筛选前考察原料药与辅料在湿、热、光等影响因素条件下的稳定性,从中选择合适的辅料,采用干法制粒技术,并严格控制存储条件,制得口感良好、质量稳定的SCCS,值得进一步开发。
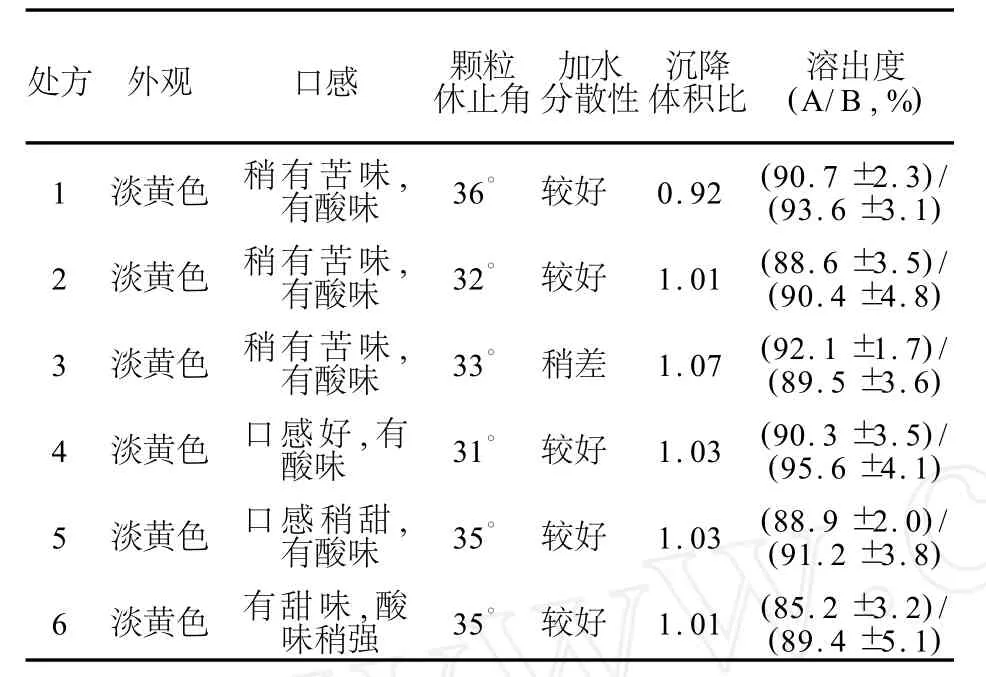
表3 复方头孢克洛干混悬剂处方考察Table 3 Formulae exam ination of siccative compound cefaclor suspension
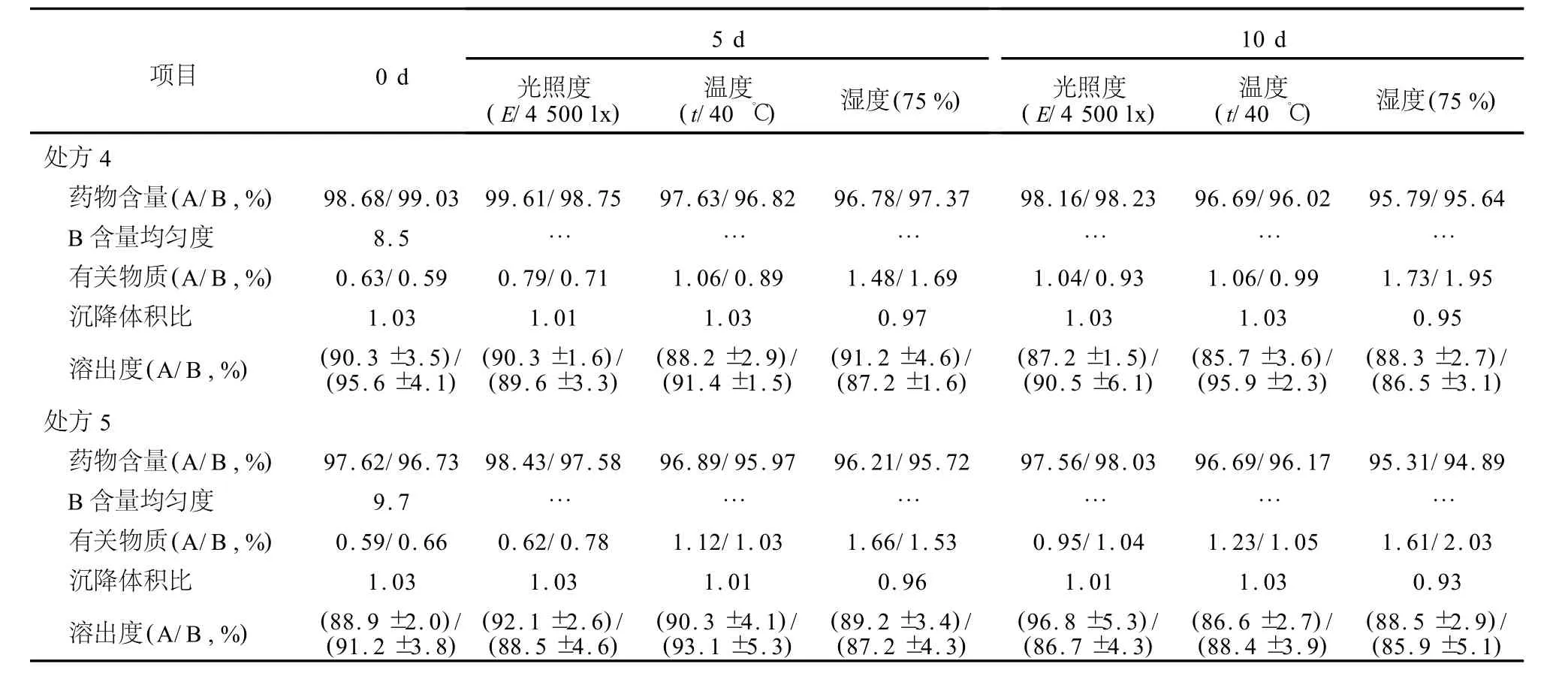
表4 处方4和处方5的影响因素考察结果Table 4 Results of influence factor tests of formulae 4 and 5
[1] 邢清坡,杜金凤,焦晓升.阿奇霉素干混悬剂处方工艺的改进[J].中国现代药物应用,2008,2(9):28-29.
Xing QingBo,Du JinFeng,Jiao XiaoSheng.Imp rovement of p rescription technology of siccative azithromycin suspension [J].Chin J Mod Drug Appl,2008,2(9):28-29.Chinese.
[2] Palma-Aguirre J A,Villalpando-Hernández J,Novoa-Heckel G,et al.Bioavailability of two oral-tablet and two oral-suspension fo rmulations of nap roxen sodium/paracetamol(acetaminophen):single-dose,randomized,open-label,two-period crossover comparisons in healthy Mexican adult subjects[J].Clin Ther,2009,31(2):399-410.
[3] 向世英,林 波,梁振益.头孢克洛干混悬剂中有关物质的研究[J].化学分析计量,2009,18(1):42-45.
Xiang ShiYing,Lin Bo,Liang Zhen Yi.Determination of relevant substances of cefaclor suspension by HPLC[J].Chem Anal Meter,2009,18(1):42-45.Chinese with abstract in English.
[4] 李 萍,尤孝庆,卢 丹.头孢克洛片的研究[J].广东药学, 2001,11(3):13-15.
Li Ping,You XiaoQing,Lu Dan.Study on cefaclor tablet[J]. Guangdong Pharm J,2001,11(3):13-15.Chinese.
[5] 仝立卿,杨 帆.头抱克洛颗粒及干混悬剂溶出度的研究[J].中国实用医药,2007,2(31):23-24.
Tong LiQing,Yang Fan.Studieson the dissolution of cefaclo r granules and suspensions[J].China Pract Med,2007,2(31): 23-24.Chinese w ith abstract in English.
