乳腺癌干细胞中活性氧簇水平的研究*
2011-01-26田允鸿陈卫国谢国柱孙权权孙爱民袁亚维
田允鸿,陈卫国,谢国柱,刘 英,孙权权,张 肖,孙爱民,袁亚维△
(1.南方医科大学南方医院放疗科,广州 510515;2.江西省萍乡市人民医院消化内科 337000)
乳腺癌干细胞中活性氧簇水平的研究*
田允鸿1,陈卫国2#,谢国柱1,刘 英1,孙权权1,张 肖1,孙爱民1,袁亚维1△
(1.南方医科大学南方医院放疗科,广州 510515;2.江西省萍乡市人民医院消化内科 337000)
目的探讨乳腺癌MCF-7细胞中CD44+CD24-/low表型乳腺癌干细胞活性氧簇水平。方法用悬浮培养的方法富集乳腺癌干细胞。用流式细胞仪检测CD44+CD24-/low表型乳腺癌干细胞含量,体内成瘤实验验证其干细胞特性,克隆形成实验检测其辐射敏感性,2′-7′-二氯荧光素双醋酸盐(DCFH-DA)法检测其活性氧簇水平。结果贴壁培养和悬浮培养的细胞中CD44+CD24-/low表型乳腺癌干细胞含量分别为(8.10±1.69)%、(84.88±1.74)%,二者比较差异有统计学意义(P<0.01);悬浮培养细胞致瘤能力明显强于贴壁培养细胞;悬浮培养细胞2 Gy剂量点存活分数为(0.876±0.061)分,明显高于贴壁培养细胞的(0.783±0.097)分(P<0.01);贴壁培养和悬浮培养细胞活性氧簇水平分别为32.91±3.61和5.39±0.66,二者比较差异有统计学意义(P<0.01)。结论悬浮培养能富集乳腺癌干细胞,乳腺癌干细胞活性氧簇水平明显低于分化乳腺癌细胞,这可能在维持其自我更新特性及放疗抵抗中起重要作用。
肿瘤干细胞;活性氧;乳腺肿瘤;悬浮培养
活性氧簇是一类含氧的、具有化学活性物质的总称,主要包括超氧阴离子、过氧化氢、氢氧自由基等,它们广泛存在于机体内并参与调节机体许多生理病理过程[1]。肿瘤干细胞是指肿瘤中具有自我更新能力并能分化产生异质性肿瘤细胞的细胞,是放、化疗抵抗和复发的重要因素之一。2003年Al-Hajj等[2]首次从乳腺癌细胞中分离出表面标记物为CD44+CD24-/low的乳腺癌干细胞,随后Ponti等[3]成功利用悬浮培养方法富集乳腺癌干细胞。大量研究显示,低水平的活性氧簇在维持中枢神经系统干细胞和造血干细胞的特性方面起重要作用[4],而肿瘤干细胞与干细胞之间有许多共同的特性,且目前尚未见乳腺癌干细胞中活性氧簇水平的报道。因此,本研究采用悬浮培养方法富集乳腺癌干细胞,并进一步研究其活性氧簇水平。
1 材料与方法
1.1 材料 MCF-7细胞由山东大学提供,DM EM/F12、RPM I1640培养基及新生牛血清购自Hyclone公司,表皮生长因子(EGF)、成纤维细胞生长因子(bFGF)购自 Peprotech公司,B27购自 Invitrogen公司,牛血清清蛋白(BSA)购自Gibco公司,大鼠抗人CD44-FITC单克隆抗体、小鼠抗人CD24-PE单克隆抗体及相应的同型对照抗体均购自Ebioscience公司,非肥胖型糖尿病/重症联合免疫缺陷(NOD/SCID)小鼠购自中国医学科学院实验动物研究所,17β-雌二醇和 2′-7′-二氯荧光素双醋酸盐(2′-7′-dichlorofluorescein diacetate,DCFH-DA)购自Sigma公司。
1.2 细胞培养 MCF-7细胞系用含10%新生牛血清的RPM I1640培养基贴壁培养。取指数生长期细胞,消化成单细胞悬液,重悬于不含血清的DMEM/F12培养基中,并添加20 ng/mL EGF、20 ng/mL bFGF、0.4%BSA 和 2%B27,以5 000 cells/mL接种于6孔板(3毫升/孔),在37℃、5%CO2培养箱中静置培养,每 2天加1 mL新鲜培养基[5]。
1.3 流式细胞仪检测CD44+CD24-/low表型细胞含量 将贴壁培养细胞用胰酶消化为单细胞悬液,悬浮培养细胞第7天机械吹打成单细胞悬液,以磷酸盐缓冲液(PBS)调整细胞浓度至1×106cells/100 μ L。加入大鼠抗人CD44-FITC和小鼠抗人CD24-PE单克隆抗体,并做同型对照实验。4℃避光孵育,30 min后加5 mL PBS漂洗去除未结合抗体,1 h内用流式细胞仪检测,常规检测2次。
1.4 体内成瘤实验 将悬浮培养1周和贴壁培养细胞消化成单细胞悬液后分别重悬于含有基质胶的DMEM/F12培养基中,分别在NOD/SCID小鼠腹部双侧皮下注入不同浓度细胞悬液。将溶解于乙醇中的17β-雌二醇溶解在DMEM/F12培养基中,每周注射1次(0.4 mg/kg)。12周后断颈处死动物观察动物成瘤情况。所有动物实验遵照南方医科大学动物管理委员会的规定进行[2]。
1.5 克隆形成实验 收集细胞制成单细胞悬液,稀释成不同浓度后接种到6孔板中,给予0、2、4、6、8 Gy照射。照射方法:采用Varian 2100C直线加速器6 MV X线为放射源,固定源皮距照射,剂量率300 cGy/min,SSD=100 cm,PDD=80%,照射野100 mm×100 mm。静置培养14 d后计数大于50个细胞的克隆数。
1.6 细胞内活性氧簇含量检测 用无血清RPMI1640培养基稀释DCFH-DA,使其终浓度为10-5mol/L;分别收集悬浮培养7 d的细胞及指数生长期的贴壁培养细胞,以106cells/mL悬浮于稀释好的DCFH-DA中,37℃细胞培养箱内孵育20 min。每隔5 min颠倒混匀1次,使探针和细胞充分接触。用无血清RPMI1640培养基洗涤细胞3次,以充分去除未进入细胞内的DCFH-DA。1 h后用流式细胞仪检测。相同体积的未加DCFH-DA细胞悬液作为阴性对照,10-6mol/L H2O2作为阳性对照。
1.7 统计学处理 采用SPSS13.0统计软件进行统计学处理,计量资料进行独立样本t检验,以 P<0.05为差异有统计学意义。
2 结 果
2.1 细胞培养结果 贴壁培养的MCF-7细胞呈扁平多形生长,见封2图1A,悬浮培养的MCF-7细胞呈球形,培养第 2天出现悬浮细胞球,见封2图1B,第7天可见由成百个细胞聚集成的球体,见封2图1C。
2.2 流式细胞仪检测结果 CD44+CD24-/low表型乳腺癌干细胞的细胞含量在贴壁培养和悬浮培养细胞中分别为(8.10±1.69)%、(84.88±1.74)%,二者比较差异有统计学意义(P<0.01),见图 2。
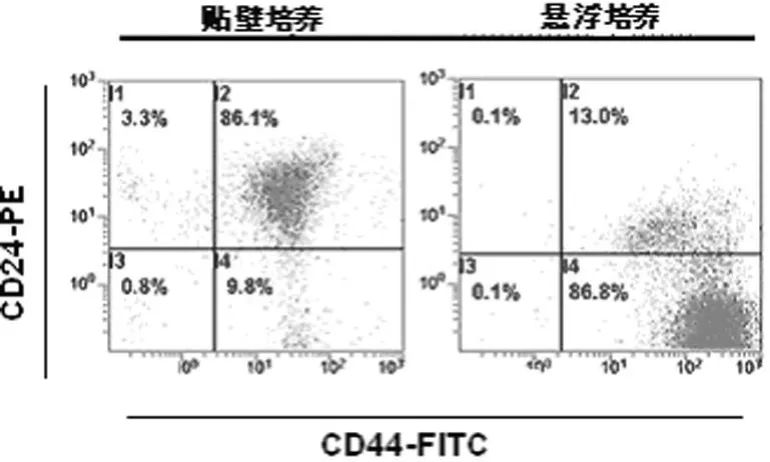
图2 流式细胞仪检测CD44+CD24-/low表型乳腺癌干细胞含量
2.3 体内成瘤实验结果 接种5×102个悬浮培养细胞至NOD/SCID小鼠皮下,第12周时可见87.5%小鼠体内成瘤;接种5×102个贴壁培养细胞至NOD/SCID小鼠皮下,第12周时未见成瘤小鼠,仅当细胞数量大于5×104个时才能成瘤,见封2图3。
2.4 克隆形成实验结果 悬浮及贴壁培养细胞经0、2、4、6、8 Gy 5个剂量照射后,培养13 d,计算出各剂量组的细胞存活分数,数据经Prism5.0软件处理,单击多靶模型曲线拟合并求得各参数,见图4。在悬浮培养和贴壁培养细胞中,2 Gy照射后细胞存活分数(SF2Gy)分别为(0.876±0.061)分和(0.783±0.097)分,二者比较差异有统计学意义(P<0.01);反映细胞损伤修复能力的 Dq值分别为3.719±0.170、2.200±0.122,二者比较差异有统计学意义(P<0.01)。
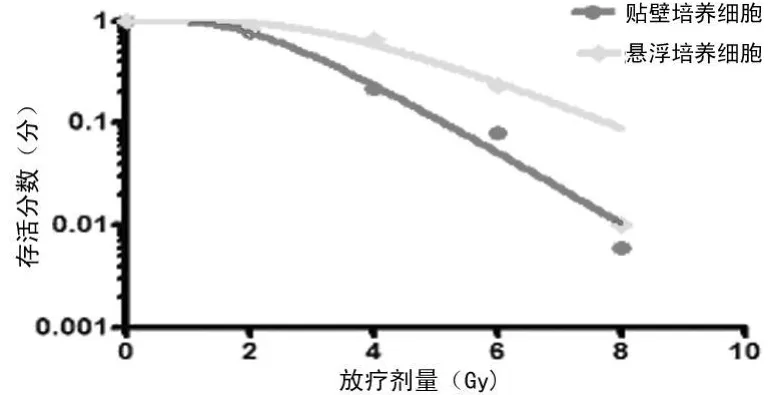
图4 悬浮与贴壁培养细胞放疗敏感性比较
2.5 活性氧簇水平检测结果 在贴壁和悬浮培养细胞中,活性氧簇水平(平均荧光强度)分别为32.91±3.61和5.39±0.66,二者比较差异有统计学意义(P<0.01),低水平活性氧簇细胞含量分别为(0.733±0.210)%和(0.863±0.700)%,二者比较差异有统计学意义(P<0.01),见图5。
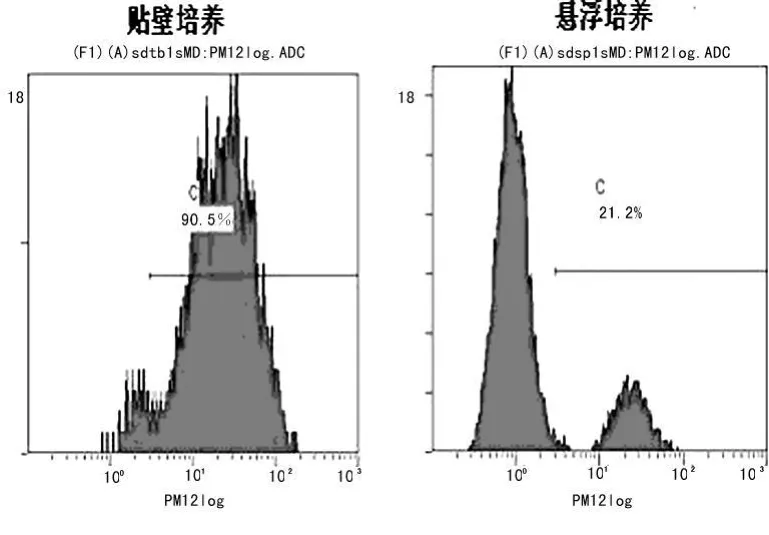
图5 贴壁与悬浮培养细胞中活性氧簇水平比较

3 讨 论
肝瘤干细胞是具有自我更新、无限增殖和高致瘤特性的肿瘤细胞,2003年Al-Hajj等[2]首次分离出乳腺癌干细胞,并证实CD44+CD24-/low为乳腺癌干细胞表面标记物。随后Ponti等[3]以及Cariati和Purushotham[6]成功利用悬浮培养的方法富集CD44+CD24-/low表型乳腺癌干细胞。因此,本研究采用添加生长因子的无血清体系悬浮培养乳腺癌干细胞,培养7 d后见由上百个细胞组成的球囊,流式细胞仪计数结果显示悬浮培养细胞中CD44+CD24-/low表型乳腺癌干细胞含量明显高于贴壁培养细胞。体内成瘤实验已成为肿瘤干细胞验证的金标准[7-8],为了进一步分析悬浮培养所富集的乳腺癌干细胞的可靠性,本研究采用体内成瘤实验了解其致瘤能力,结果显示悬浮细胞有更高的致瘤性。大量研究证实肿瘤干细胞具有放、化疗抵抗特性[8]。为进一步验证悬浮培养富集的乳腺癌干细胞的放疗敏感性,本研究进行了辐射后克隆形成实验,结果显示悬浮培养细胞表现出对放疗抵抗特性,这与Phillips等[7]研究证实乳腺癌干细胞放射相对抗拒的结果一致。总之,本研究采用体外无血清悬浮培养法富集了具有高致瘤性和放疗抵抗的乳腺癌干细胞。
活性氧簇是一类含氧的、具有化学活性物质的总称。正常情况下,活性氧簇在代谢过程中产生(例如细胞呼吸链中),并保持平衡。它参与人体许多生理过程,是细胞主要的信号分子。大量研究显示低水平活性氧簇在干细胞特性维持中起重要作用。Armstrong等[9]发现人胚胎干细胞能通过增加清除及减少生成来维持低水平活性氧簇,保持基因组的完整性,而高糖等因素能诱导活性氧簇水平升高并使间充质干细胞分化为成熟脂肪细胞[10]。Kim和Wong[11]证实当维持活性氧簇稳定的atm基因丢失后,活性氧簇水平的升高将减少神经干细胞球囊的形成和神经干细胞的增殖。Tothova等[12]利用DCFHDA法检测造血干细胞中活性氧簇水平的变化,同样证实活性氧簇水平升高能使静止期造血干细胞进入细胞周期并分化成熟。更重要的是,大量研究证实Wnt通路在CSCs的发生、“干性”特征维持及放、化疗抵抗中起重要作用。而Funato和Miki[13]发现活性氧簇可以调节Wnt信号通路,间接表明了活性氧簇对肿瘤干细胞“干性”的影响。总之,活性氧簇在正常干细胞中起重要作用,DCFH-DA法是活性氧簇水平检测最常用且可靠的手段,而肿瘤干细胞与正常干细胞有许多相似的特性,且有研究间接表明活性氧簇水平能通过Wnt信号通路影响肿瘤干细胞的特性。因此,本研究进一步采用DCFH-DA方法检测悬浮培养富集的乳腺癌干细胞活性氧簇水平,结果显示悬浮培养富集的乳腺癌干细胞活性氧簇水平较低。虽然导致乳腺癌干细胞低活性氧簇水平的机制不是很清楚,但本研究对乳腺癌干细胞中活性氧簇水平的探讨为进一步研究乳腺癌干细胞特性提供了新的出发点,同时为通过改变活性氧簇水平影响肿瘤干细胞自我更新特性、诱导其凋亡和分化提供了部分思路。
放疗是肿瘤治疗的重要方式之一,其主要作用机制之一是通过辐射与细胞内的其他原子或分子(特别是水)相互作用,解离成活性氧簇造成DNA关键靶点的氧化应激损伤[14]。Kattan等[15]研究显示许多抗氧化酶在雌激素受体表达阴性的乳腺癌中高表达,减少其中的抗氧化酶能升高细胞内的活性氧簇水平而达到放疗增敏作用;Zhang等[16]研究发现射线照射MCF-7细胞后,存活下来的细胞比未照射组含更低水平活性氧簇,进一步利用RNA干扰技术改变活性氧簇水平能显著影响放疗敏感性。总之,肿瘤细胞的放疗敏感性与活性氧簇水平密切相关。本研究发现乳腺癌干细胞含有低水平活性氧簇,这可能也是肿瘤干细胞放、化疗抵抗重要因素之一。因此,对活性氧簇水平的研究可能开启以肿瘤干细胞为靶标的肿瘤放射治疗增敏的途径。
综上所述,活性氧簇在正常干细胞和肿瘤中均有大量研究,但在肿瘤干细胞中尚未见报道。本研究发现乳腺癌干细胞含低水平活性氧簇,这可能与其自我更新等特性维持及放疗抵抗相关。因此,以活性氧簇为靶标的干预不仅能影响其干细胞的“干性”还能起到放疗增敏的作用。尽管本研究只是对乳腺癌干细胞活性氧簇水平进行了初步研究,但给予了更多的启示:活性氧簇在肿瘤干细胞中作用机制和信号传导通路是什么?活性氧簇是否与肿瘤干细胞的高致瘤和多向分化等特性相关?因此,今后将进一步从基因和蛋白水平对其进行更深入的研究。
[1]Baumann M,Krause M,Hill R.Exploring the role of cancer stem cells in radioresistance[J].Nat Rev Cancer,2008,8(7):545-554.
[2]Al-Hajj M,Wicha MS,Benito-Hernandez A,et al.Prospective identification of tumorigenic breast cancer cells[J].Proc Natl Acad Sci USA,2003,100(7):3983-3988.
[3]Ponti D,Zaffaroni N,Capelli C,et al.Breast cancer stem cells:an overview[J].Eur JCancer,2006,42(9):1219-1224.
[4]Tsatmali M,Walcott EC,Crossin KL.Newborn neurons acquire high levels of reactive oxygen species and increased mitochondrial proteins upon differentiation from progenitors[J].Brain Res,2005,1040(1-2):137-150.
[5]谢国柱,詹军芳,孙爱民,等.辐射与悬浮球培养联合纯化乳腺癌干细胞[J].实用医学杂志,2010(11):1893-1896.
[6]Cariati M,Purushotham AD.Stem cells and breast cancer[J].Histopathology,2008,52(1):99-107.
[7]Phillips TM,Mcbride WH,Pajonk F.The response of CD24-/low/CD44+breast cancer-initiating cells to radiation[J].J Natl Cancer Inst,2006,98(24):1777-1785.
[8]Diehn M,Clarke MF.Cancer stem cells and radiotherapy:new insights into tumor radioresistance[J].J Natl Cancer Inst,2006,98(24):1755-1757.
[9]Armstrong L,Tilgner K,Saretzki G,et al.Human induced pluripotent stem cell lines show stress defense mechanisms and mitochondrial regulation similar to those of human embryonic stem cells[J].Stem Cells,2010,28(4):661-673.
[10]Aguiari P,Leo S,Zavan B,et al.High glucose induces adipogenic differentiation of muscle-derived stem cells[J].Proc Natl Acad Sci USA,2008,105(4):1226-1231.
[11]Kim J,Wong PK.Loss of ATM impairs proliferation of neural stem cells through oxidative stress-mediated p38 MAPK signaling[J].Stem Cells,2009,27(8):1987-1998.
[12]Tothova Z,Kollipara R,Huntly BJ,et al.Foxos are critical mediators of hematopoietic stem cell resistance to physiologic oxidative stress[J].Cell,2007,128(2):325-339.
[13]Funato Y,Miki H.Redox regulation of Wnt signalling via nucleoredoxin[J].Free Radic Res,2010,44(4):379-388.
[14]Liu Q,He X,Liu Y,et al.NADPH oxidase-mediated generation of reactive oxygen species:a new mechanism for X-rayinduced hela cell death[J].Biochem Biophys Res Commun,2008,377(3):775-779.
[15]Kattan Z,Minig V,Leroy P,et al.Role of manganese superoxide dismutase on growth and invasive properties of human estrogen-independent breast cancer cells[J].Breast Cancer Res Treat,2008,108(2):203-215.
[16]Zhang B,Wang Y,Su Y.Peroxiredoxins,a novel target in cancer radiotherapy[J].Cancer Lett,2009,286(2):154-160.
The levels of reactive oxygen species in breast cancer stem cells*
Tian Yunhong1,Chen Weiguo2#,Xie Guozhu1,Liu Ying1,Sun Quanquan1,Zhang Xiao1,Sun Aimin1,Yuan Yawei1△
(1.Department of Radiation Oncology,Nanfang Hospital,Southern Medical University,Guangzhou 510515,China;2.Department of Gastroenterology,People′s Hospital of Pingxiang,J iangxi 337000,China)
ObjectiveTo investigate the levels of reactive oxygen species(ROS)in human breast cancer stem cells which were enriched by suspension culture.MethodsHuman breast cancer stem cells were cultured in serum-free media,and the percentage of CD44+CD24-/lowphenotype was measured by flow cytometry.Tumorigenicity of mammosphere was confirmed by NOD/SCID mice and cloning formation assay following radiation was used to assess the radiosensitivity of purified mammosphere cells.Finally,the levels of ROS were measured on the basis of 2′-7′-dichloro fluorescein diacetate(DCFH-DA).ResultsThe proportion of CD44+CD24-/lowcells were(8.10±1.69)%and(84.88±1.74)%,and the survival fraction of 2 Gy were 0.783±0.097 and 0.876±0.061,respectively in attachment-culture system and suspension sphere-culture system,the differences were statistically significant(P<0.01).However,compared with monolayer cells,mammosphere cells contained lower level of reactive oxygen species(mammosphere cells were 5.39±0.66,monolayer cells were 32.91±3.61)and increased tumorigenicity in NOD/SCID mice.Conclusion
Breast cancer stem cells with increased tumorigenicity can be purified in the suspension sphere-culture system,and the CD44+CD24-/lowcells which included lower levels of reactive oxygen species possibly contributed to the resistance to conventional forms of therapy and maintenance of self renewing.
neoplastic stem cells;reactive oxygen species;breast neoplasms;suspension culture
10.3969/j.issn.1671-8348.2011.05.001
A
1671-8348(2011)05-0417-03
国家自然科学基金资助项目(30670633);广东省自然科学基金资助项目(06024386)。△< class="emphasis_bold">通讯作者,
,Tel:13316085871;E-mail:y uanyw66@yahoo.cn。#共同第一作者。
2010-10-20
2010-11-08)
