肿瘤化疗消化道症状量表的编制1)
2011-01-23何海燕朱京慈张佳佳王淑琼宋佶芳
何海燕,朱京慈,张佳佳,彭 娜,王淑琼,宋佶芳,刘 红
在抗肿瘤治疗中,化疗占据重要的地位。消化道反应是肿瘤化疗药物最常见的毒性反应,常表现为恶心呕吐、食欲减退、便秘腹泻等症状。据报道,恶心、呕吐在化疗病人中发生率为70%~80%[1,2];腹泻可引起病人严重的水电解质紊乱、酸碱平衡失调、营养不良、感染甚至危及生命,便秘可以比疼痛更让人痛苦[3-6]。这些症状给病人及其家人的生活造成严重的负面影响,可能导致病人及其家人恐惧化疗、拒绝继续化疗而达不到肿瘤的最佳治疗效果。症状管理是减轻病人痛苦、提高治疗依从性、改善生活质量的重要手段;化疗消化道症状管理一直是近年临床医护人员关注和研究的重点[7]。化疗期间,病人消化道症状多以症状群的形式出现,即同时出现两个或多个相互影响的症状[8],而目前关于化疗消化道症状的评估和管理多集中于单症状的现象描述和治疗干预,如恶心、呕吐等,没有把消化道症状作为一个整体来评估和研究,并且缺乏化疗消化道症状的专用评估工具。因此,本研究将化疗消化道症状作为一个整体,运用心理测量学有关技术,编制一份具有较好信、效度的化疗消化道症状量表,为其临床症状管理和科学研究提供有效的量化评估工具。
1 方法
1.1 初测项目的形成 参照国内外涉及消化道症状的量表、肿瘤或化疗胃肠道症状的中英文文献、化疗毒副反应及消化疾病诊断学等专著和教科书,搜集可能相关的消化道症状条目。然后对79位临床肿瘤专家以及50例肿瘤化疗病人进行问卷调查和半结构式访谈,在此基础上,对条目进行筛选优化和修改,选择有代表性和普遍性的条目,遵从浅显易懂的原则,最终形成该量表的初测版本。包括食欲减退、恶心、呕吐、味觉异常(如口淡无味、口苦、口酸、口咸等)、口腔/咽喉疼痛、口腔/咽喉干燥、吞咽不适(如吞咽疼痛、吞咽梗阻等)、呃逆(俗称“打嗝、扯嗝儿”)、烧心/胃灼热(胸骨后或剑突下烧灼感)、胃/腹胀、胃/腹痛、便秘、腹泻共13个项目。要求化疗病人根据自己过去24 h中消化道症状最严重的程度对这些项目逐一进行Likert式5点评分(没有、轻度、中度、较重、非常重)。
1.2 正式量表的编制
1.2.1 测试对象 ①测试对象1:重庆和成都市6所医院(均为三级甲等医院,其中4所综合性医院、2所肿瘤专科医院)肿瘤科化疗的626例病人进行分批测试,收回有效问卷596份(包括探索性因素分析所用问卷294份、验证性因素分析302份),有效率为95.2%;其中男345例,女251例;年龄53.62岁±12.82岁;肺癌145例,大肠癌62例,鼻咽癌 61例,乳腺癌 47例,食管癌47例,恶性淋巴瘤41例,子宫颈癌33例,卵巢癌31例,胃癌29例,急性白血病17例,原发性肝癌 12例,软组织肉瘤10例,其他61例。②测试对象2:为检验量表的实证效度,本研究对重庆市某综合性医院的110例化疗病人分别在化疗实施前、化疗第3天进行测试,比较化疗实施前后消化道症状的评分差异。其中男64例,女46例;年龄56.55岁±12.55岁;肺癌47例,大肠癌13例,鼻咽癌 9例,食管癌 8例,恶性淋巴瘤 6例,乳腺癌 5例,子宫颈癌4例,软组织肉瘤4例,胃癌 3例,卵巢癌3例,其他8例。
1.2.2 分析程序 主要分两个阶段进行:①探索性因素分析采用主成分分析,采用最大正交旋转法,计算工具应用SPSS 13.0统计学软件包,初步构建化疗消化道症状的理论构架。②验证性因素分析采用AMOS 7.0统计学软件包,对量表的理论模型进行验证和修订,并将该量表命名为“化疗消化道症状量表(chemotherapy-related gastrointestinal tract symptom inventory,C-GITSI)”
2 结果与分析
2.1 探索性因素分析 首先进行项目分析,挑选具有鉴别力的题项行因素分析。通过总分高低端各27%的被试组成高分组和低分组,计算各题项的临界比率值(critical ratio,CR),结果CR值均达0.000的显著水平。
由于化疗消化道症状量表是根据病人的临床症状编制的,研究者在事前对这些项目没有理论上的因素归属假设。因此,对于该量表将采用探索性因素分析来考察其内部结构。为了检验数据是否适合做因素分析,对数据进行了Bartlett球形检验,检验值为1 366.841,P<0.001,说明各项目间有共享因素的可能性,同时,样本适当性度量值KM O为0.782,说明适宜做因素分析。
对量表的13个项目首先进行一阶因素分析,经主成分分析和最大正交旋转,提取出特征值大于1的4个公因子,累积方差贡献率为64.137%。然后,对因素分析结果进行最大正交旋转,发现4因素的旋转结果不理想,其内部意义难以进行合理解释;根据陡坡检验原理,结合碎石图,从第3个因子以后,因素变异量由陡坡趋于平坦;进一步分析发现,3因素结构可解释性强,且累积方差贡献率已经达到56.015%,可以代表此量表的因素结构。因此,将肿瘤化疗消化道症状的主要因素归为3个方面。因素负荷矩阵见表1。

表1 因子结构及各项目的因子负荷
从表1可以看出,各项目的因子负荷除了项目12便秘和项目4味觉异常在两个因素上的载荷都大于0.3以外,其他项目都很好地归入了所属因素中。由于本量表是一个症状量表,如果按照测量学一般对量表因素分析的步骤删除这两个项目就会与临床应用的需要冲突。因此,为了照顾临床上的需要保留这两个项目。尽管这两个因素为“双重载荷”,但是也可以根据其中一个相对较高的载荷分别归属到因子2和因子3中。由此,正式测验由 3个因子 13个项目构成。其中,因子 1包括 3个项目,命名为饮食摄入;因子 2包括 6个项目,命名为胃肠症状;因子3包括4个项目,命名为口咽感知。每个项目与总量表之间的相关系数为0.236~0.737(P<0.01),3个因子与总量表之间的相关系数为 0.797、0.799、0.715(均 P<0.01),3个因子之间的相关系数分别为0.466、0.303、0.410(均P<0.01);在一阶因子分析的基础上,对化疗消化道症状进行二阶因素分析,方法同上,结果显示:3个一阶因子构成1个高阶因素(C-GITS),因子载荷分别是 0.827、0.765、0.722,可以解释一阶因子总方差的59.665%。
2.2 验证性因素分析 通过探索性因素分析,初步获得CGITSI的二阶一因素同质性测量模型。为了考察构建模型与实际模型拟合度,以及项目与各因素之间的关系,对该模型采用验证性因素分析,因子结构模型及标准化路径系数如图1所示。
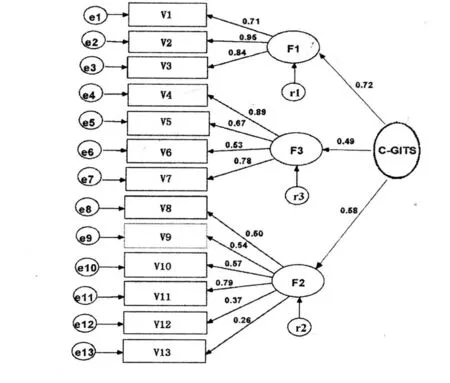
图1 化疗消化道症状的3因素标准化路径图
在众多的拟合性指标中,比较广泛采用的是绝对拟合指标中的 χ2/df、拟合优度指数(GFI)、修正的拟合优度(AGFI)、均方根残差(RM R)、近似误差均方根(RMSEA)、比较拟合指数(CFI)、递增拟合指数(IFI),相对拟合指标中的Bentler-Bonett规范拟合指数(NFI)、Bentler-Bonett非规范拟合指数(NNFI)。其中χ2与传统的χ2检验相反,结构方程模型希望得到的是不显著(P>0.05)的结果。由于χ2与样本大小有关,因此不直接作为评价模型的指标,而与自由度一起使用说明模型正确性的概率,一般认为χ2/d f<2,模型较好;RMR和RMSEA的取值范围均在0~1之间,<0.05表明观测数据与模型很好拟合;其他几个拟合指标 GFI、AGFI、CFI、NFI、NNFI等的取值范围也在0~1之间,>0.90则认为模型得到较好拟合[9]。本研究中χ2/df是 1.293,同时 GFI(0.970)、AGFI(0.943)、NFI(0.948)、NNFI(0.979)、CFI(0.987)、IFI(0.988)均在 0.9以上;而 RMR(0.039)、RMSEA(0.031)的值都小于0.05,各项参数均达到了可接受水平,说明C-GITSI 3个一阶因子的二阶因素模型可以和数据相拟合,问卷具有较好的结构效度。
2.3 实证效度检验 为检验量表的实证效度,对110例病人化疗实施前、化疗第3天的C-GITSI评分差异进行实证研究。结果表明,化疗实施前、化疗第3天病人C-GITSI总分和各因子评分差异有统计学意义,化疗第3天消化道症状评分明显高于化疗实施前,见表2。

表2 化疗实施前、化疗第3天C-GITSI评分比较 分
2.4 信度分析 本研究考察各因素内部一致性信度,饮食摄入、胃肠症状、口咽感知的Cronbach'sα系数分别是0.898、0.680、0.700,总量表的 Cronbach's α系数是0.820。根据心理测量学要求,各分量表信度系数最好在0.70以上,在0.60~0.70之间也可以接受使用,总量表信度系数最好在0.80以上[10]。本研究信度结果达到了可接受水平,说明该问卷具有较好的信度。
3 讨论
3.1 编制化疗消化道症状量表的必要性 症状管理始于症状评估。症状的准确和动态评估,可以为病人的个体化治疗、饮食指导和症状管理提供依据,是临床决策的基础。肿瘤症状评估国外始于20世纪70年代,经过几十年的努力,尽管肿瘤症状评估工具和技术不断的更新和多样化[7,11],但是肿瘤化疗消化道症状管理的评估依然亟待研究。迄今为止,未见化疗消化道症状专用评估工具的报道。常见的肿瘤症状量表如Memorial症状量表、Edmonton症状量表、Anderson症状量表以及化疗症状评估量表等[12-16]也涉及部分消化道症状条目,但是各量表涵盖的消化道症状项目各不相同,测量的症状维度、间隔时间段、计分方法等也不一样,不适合临床化疗消化道症状的评估管理和信息交流,不能完全满足临床医护人员的关注点[17]。因此,编制针对化疗消化道症状的评估量表具有很强的理论和临床实用价值。
3.2 化疗消化道症状量表的结构 本研究在参照国内外研究成果、结合临床专家意见和病人症状感知的基础上,运用心理测量学的有关技术编制了化疗消化道症状量表。量表包括13个条目,基本涵盖了化疗消化道主要症状;探索性因素分析发现量表由二阶1因素一阶3因素构成,因素结构清晰,结构效度较好,其中饮食摄入、胃肠症状、口咽感知3个一阶因子所含项目数分别是3、6和 4,各项目因素负荷均大于0.4,总方差解释率为56.015%,其命名根据所含项目的内容进行,力求简洁完整地反映因素的共同性。实际上,从人体消化道解剖来看(口腔、咽、食管、胃、小肠和大肠),3因素大体上是从消化道的解剖组成来区分的,是一种部位性的特征结构。量表中“便秘”在两个因素上的载荷0.403、0.362相差不大,说明便秘不仅与胃肠症状密切相关,也与饮食摄入有关。从医学的角度看:便秘病人因排泄不畅,不但加重腹胀等胃肠不适,也会引起食欲下降,增加恶心呕吐的风险[18,19]。
另外,量表各因子之间的相关系数为0.303、0.410、0.466,明显小于各因素与总分的相关系数(0.715、0.797、0.799),表明各因素之间相对独立,与总体概念一致,也说明量表具有较好的结构效度。同时,验证性因素分析结果表明,化疗消化道症状的3因素结构模型较好地拟合了观测数据,支持了探索性因素分析的研究结果。
3.3 化疗前和化疗第3天消化道症状的比较 对病人化疗实施前和化疗第3天的消化道症状评估发现,化疗第3天的消化道症状在各维度评分及总分上都明显高于化疗实施前。化疗实施前病人消化道症状评分高低依次是口咽感知、胃肠症状、饮食摄入;化疗第3天,饮食摄入的影响最严重、增长幅度最大,口咽感知、胃肠症状也进一步加重,症状总分是化疗实施前的两倍。说明化疗期间由于药物的影响,消化道黏膜受损、神经递质异常释放、胃肠动力障碍等导致病人消化道整体症状负荷明显增加[4,20-23],与临床实际吻合,也表明C-GITSI有较好的实证效度。化疗和非化疗病人消化道症状鉴别参照点有待在对照研究中进一步加以探索。
本研究还考察了各因素与总量表的内部一致性信度,各Cronbach's α系数均符合心理测量学的要求。因此,本研究编制的化疗消化道症状量表具有较好的信度和效度,适合用于测量化疗消化道症状,可为指导临床用药、预防严重不良反应以及进行饮食指导和症状自我管理等提供重要的工具和有效的参考。但化疗消化道症状量表的开发和应用尚在初始阶段,作为一个国内自主研制的临床多症状量表,其在化疗消化道症状的临床管理和相关研究中的应用有待进一步深入探讨。
[1]Wiser W,Berger A.Practical management of chemotherapy-induced nausea and vomiting[J].Oncology(Williston Park),2005,19(5):637-645.
[2]Naeim A,Dy SM,Lorenz KA,et al.Evidence-based recommendations for cancer nausea and vomiting[J].J Clin Oncol,2008,26(23):3903-3910.
[3]M uehlbauer PM,Thorpe D,Davis A,et al.Putting evidence into practice:Evidence-based interventions to prevent,manage,and treat chemotherapy-and radiotherapy-induced diarrhea[J].Clin J Oncol Nurs,2009,13(3):336-341.
[4]Sharma R,Tobin P,Clarke SJ.M anagement of chemotherapy-induced nausea,vomiting,o ral mucositis,and diarrhoea[J].Lancet Oncol,2005,6(2):93-102.
[5]Dranitsaris G,Maroun J,Shah A.Severe chemotherapy-induced diarrhea in patients with colorectal cancer:A cost of illness analysis[J].Support Care Cancer,2005,13(5):318-324.
[6]Gibson RJ,Keefe DM.Cancer chemotherapy-induced diarrhoea and constipation:Mechanisms of damage and prevention strategies[J].Support Care Cancer,2006,14(9):890-900.
[7]Abernethy AP,Wheeler JL,Zafar SY.Detailing of gastrointestinal symptoms in cancer patients with advanced disease:New methodologies,new insights,and a proposed approach[J].Curr Opin Support Palliat Care,2009,3(1):41-49.
[8]Fan G,Filipczak L,Chow E.Symptom clusters in cancer patients:A review of the literature[J].Curr Oncol,2007,14(5):173-179.
[9]吴明隆.结构方程模型——AMOS的操作与应用[M].重庆:重庆大学出版社,2010:254.
[10]吴明隆.问卷统计分析实务——SPSS操作与应用[M].重庆:重庆大学出版社,2010:244.
[11]Abernethy AP,Wheeler JL,Zafar SY.Management of gastrointestinal symptoms in advanced cancer patients:The rapid learning cancer clinic model[J].Curr Opin Support Palliat Care,2010,4(1):36-45.
[12]Kirkova J,Davis MP,Walsh D,et al.Cancer sy mptom assessment instruments:A systematic review[J].J Clin Oncol,2006,24(9):1459-1473.
[13]Wang XS,Williams LA,Eng C,et al.Validation and application of a module of the M.D.Anderson Symptom Inventory for measuring multiple sy mptoms in patients with gastrointestinal cancer(the MDASI-GI)[J].Cancer,2010,116(8):2053-2063.
[14]Brown V,Sitzia J,Richardson A,et al.The development of the Chemotherapy Symptom Assessment Scale(C-SAS):A scale for the routine clinical assessment of the symptom experiences of patients receiving cytotoxic chemotherapy[J].Int J Nurs Stud,2001,38(5):497-510.
[15]Sitzia J,Dikken C,Hug hes J.Psy chometric evaluation of a questionnaire to document side-effects of chemotherapy[J].J Adv Nurs,1997,25(5):999-1007.
[16]Kearney N,M cCann L,Norrie J,et al.Evaluation of a mobile phone-based,advanced symptom management system(ASyMS)in the management of chemotherapy-related toxicity[J].Suppo rt Care Cancer,2009,17(4):437-444.
[17]Bovio G,M ontagna G,Bariani C,et al.Upper gastrointestinal symptoms in patients with advanced cancer:Relationship to nutritional and perfo rmance status[J].Support Care Cancer,2009,17(10):1317-1324.
[18]Twycross R,Wilcock A.Sy mptom management in advanced cancer[M].3rd edition.Oxford:Radcliffe Medical Press,2001:84;105.
[19]Campbell T,Draper S,Reid J,et al.The management of constipation in people with advanced cancer[J].Int J Palliat Nurs,2001,7(3):110-119.
[20]Nelson K,Walsh D,Sheehan F.Cancer and chemotherapy-related upper gastrointestinal symptoms:The role of abnormal gastric motor function and its evaluation in cancer patients[J].Support Care Cancer,2002,10(6):455-461.
[21]Riezzo G,Clemente C,Leo S,et al.The role of electrogastrography and gastrointestinal hormones in chemotherapy-related dy speptic sy mptoms[J].J Gastroenterol,2005,40(12):1107-1115.
[22]Hesketh PJ.Chemotherapy-induced nausea and vomiting[J].N Engl J Med,2008,358(23):2482-2494.
[23]Cleeland CS.Symptom burden:Multiple sy mptoms and their impact as patient-reported outcomes[J].J Natl Cancer Inst Monogr,2007(37):16-21.
