免疫固定电泳技术在多发性骨髓瘤诊断及分型中的应用
2011-01-23孙国华
韩 青,孙国华
(大连医科大学 附属第一医院 检验科,辽宁 大连 116011)
多发性骨髓瘤(Multipe myeloma,MM)是发生在浆细胞的克隆增殖性的恶性疾病,它的特征表现为骨髓中有大量的克隆性的浆细胞的增生和积聚,并且能分泌单克隆的免疫球蛋白或其片段,同时伴有广泛的溶骨性病变和(或)骨质疏松。中国MM年发病率约为1/100000,占所有恶性肿瘤的1%,在恶性血液系统疾病中占10%左右,而目前随着人口老龄化以及检测技术的不断提高,MM的发病率不断增加[1]。
增生的浆细胞可以产生结构均一的单克隆的免疫球蛋白(M蛋白)。一般来说,它可以分为7型,如IgG、IgA、IgM、IgD、IgE及游离轻链(Kappa或Lamda)和无分泌型[2],通过电泳后,它可以呈现出一条有特征性的带即M带。骨髓瘤的患者多以骨病、肾病等继发病就诊,常被误诊为骨病或肾脏疾病。因此,许多患者错过了最佳的治疗时期。本实验旨在说明免疫固定电泳对多发性骨髓瘤诊断和分型的意义。
1 材料和方法
1.1 标本来源
30例多发性骨髓瘤的患者系大连医科大学附属第一医院2009~2010年门诊或住院病人,均符合国内诊断MM的标准[3],男20例,女10例,年龄35~75岁。免疫球蛋白正常对照组采用的是健康体检者,男20例,女10例,年龄35~74岁,共30例。
1.2 主要仪器
美国Helena 公司全自动电泳仪,西门子BNⅡ免疫分析仪。
1.3 主要试剂
Helena 公司生产的电泳试剂盒,西门子公司生产的免疫球蛋白及血轻链检测相关试剂盒。
1.4 实验方法
免疫固定电泳的检测,使用美国Helena 公司全自动琼脂糖凝胶电泳仪,第1步根据血清蛋白质的电荷不同而分开,第2步加抗血清:不同抗原与特异性抗体形成抗原抗体复合物并沉淀下来,固定后洗脱去蛋白,以去除未结合蛋白质,只保留抗原抗体复合物于琼脂板上,最后染色判读结果。免疫球蛋白及血轻链定量:采用西门子BNⅡ免疫分析仪。采用速率散射比浊分析对样本进行免疫球蛋白(IgG、IgA、IgM)含量测定和血轻链(Kappa链和Lamda链)测定。
1.5 统计学方法
数据使用SPSS11.5软件进行分析,统计方法使用t检验,P<0.05为差异有统计学意义。
2 结 果
2.1 免疫固定电泳结果判断
单克隆蛋白带(M带)是呈狭窄浓染且致密界限分明的沉淀带,与蛋白电泳的M带出于同一个水平位置,呈“镜像式”的呼应。
2.2 血清免疫固定电泳分型结果
血清免疫固定电泳分型结果见表1。30例MM经免疫固定电泳之后其中有28例为阳性,阳性符合率为93%,各种类型呈现明显浓集的或卷发状的浓染带,表1结果显示,28例MM阳性患者中,IgG型18例为最多。IgGλ型10例,占35.71%;IgGκ型8例,占28.59%;IgAκ型4例,占14.29%;IgAλ型1例,占3.57%;游离的λ链4例,占14.29%;游离的κ链1例,占3.57%。
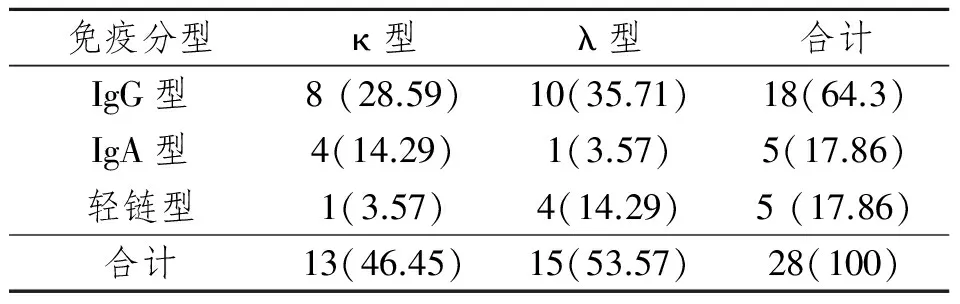
表1 28例MM患者血清免疫固定电泳分型结果
其中2例为免疫固定电泳阴性(免疫分型百分比按28例计算)
2.3 MM血清中免疫球蛋白含量测定结果
30例MM血清中免疫球蛋白含量测定结果见表2。各类型多发性骨髓瘤患者的免疫球蛋白与正常对照组免疫球蛋白比较,IgG型中IgG含量明显增高,P<0.05,IgA、IgM含量明显下降P<0.05;IgA型中IgA含量明显增高,P<0.05,IgG、IgM含量明显下降,P<0.05;轻链组的IgG、IgM含量偏低,P<0.05;IgA含量与正常对照组比较差异无显著性意义,P>0.05。
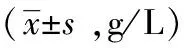
表2 各型MM免疫球蛋白含量
1)与正常对照组比较,P<0.05 ;2) 与正常对照组比较,P>0.05
3 讨 论
MM是恶性的浆细胞病中的最常见的一种单克隆骨髓的浆细胞恶性增殖性的疾病,其增生的浆细胞产生结构均一的单克隆的免疫球蛋白即M蛋白,不同类型的MM显示的M蛋白位置不同[4]。增生的浆细胞浸润及其所生成的产物可引起一系列的器官功能障碍,临床多有骨痛、溶骨损害、贫血、肾功能不全、高钙血症等表现[5]。据不同医院的统计资料分析,MM误诊率可达54.00%~69.11%[6],误诊的时间长则年余,短则数月,因此,许多MM患者错过了最佳的治疗时期。
免疫固定电泳技术是目前最广泛的应用于鉴别M蛋白的方法之一,多项实验证明了免疫固定电泳技术是一种特异性、灵敏度及准确性很好的能快速分离及鉴别单克隆M蛋白的最直观的方法。本组30例MM患者中,有2例免疫固定电泳为阴性,分析其可能原因是患者处在治疗恢复期,导致其含量较低,以至于无法检测到或者也可能属于MM中的另一种类型为不分泌型多发性骨髓瘤,其余的28例免疫固定电泳均阳性,阳性符合率为93%。其中,IgGλ型占35.71%;IgGκ型占28.59%;IgAκ型占14.29%;IgAλ型占3.57%;游离的λ链占14.29%;游离的κ链占3.57%。在IgG型MM中,IgG含量较正常对照组高,IgA 、IgM较正常对照组低,P均<0.05;在IgA型MM中,也可以见到IgA含量比正常对照组含量高,IgG和IgM较正常对照组低,P也均<0.05。提示高浓度异常的M蛋白可能通过反馈的机制而抑制正常人免疫球蛋白的合成。这与国内报道相一致[7]。M蛋白数量反映瘤细胞容量的大小和单克隆增生的程度,由于突变株细胞恶性增生,正常细胞受抑,M蛋白明显增高[8]。目前,MM的发病率有上升的趋势,所以应该把M蛋白检测作为临床实验室的常规检测手段,减少漏诊率。随着中国人口老龄化的程度进一步加深,MM的发病率也越来越高。利用免疫固定电泳对MM诊断及分型鉴定具有重要临床意义。骨穿虽是诊断此病的金标准,但因它是局灶性病变,一次骨穿很难查出瘤细胞,况且MM患者的瘤细胞形态多种多样,很难用常规检查方法证实为骨髓瘤细胞,而免疫固定电泳技术是结合了蛋白质电泳的高分辨率和抗原抗体反应的特异性,而且容易判断结果。因此,免疫固定电泳可以大大降低MM的误诊率,对提高临床的诊断效率有很大的帮助。
[1] 田永芳,贾海英,田洪燕.47例多发性骨髓瘤综合分析[J].临床血液学杂志,2010,23(8):473-478.
[2] 李勇.副蛋白血症的实验室研究状况[J].国外医学临床生物化学与检验学分册,2001,22(3):158-159.
[3] 叶任高,陆再英.内科学[M].第6版.北京:人民卫生出版社,2005,631.
[4] 潘继文,王娟,王艾丽,等.35例多发性骨髓瘤患者血清轻链检测及结果分析[J].现代诊断与治疗,2003,14(4):214-215.
[5] 杨志才,高玉洁,张春明,等.多发性骨髓瘤血清蛋白电泳与免疫学分型[J].国际检验医学杂志,2005,26(7):34-35,38.
[6] International Myeloma Working Group.Criteria for the classification of monoclonal gammopathies,multiple myeloma and related disorders: a report of the InternationalMyelomaWorking Group[J].Br J Haematol,2003,121(5):749-757.
[7] 万静,占竹英.40例多发性骨髓瘤临床早期漏诊的原因分析[J].医学新知杂志,1995,5(3):121-123.
[8] 邹小立,佘妙容,黄梓伦,等.28例多发性骨髓瘤免疫分型及临床分析[J].实用医学杂志,1996,12(5):290-291.
