砷对小鼠脑单胺类神经递质浓度影响及牛磺酸、维生素C的保护作用
2011-01-23朴丰源
张 璇,朴丰源,刘 鹏
(大连医科大学 劳动卫生与环境卫生学教研室,辽宁 大连 116044)
砷(As)是自然界存在的有毒类金属元素,广泛分布于岩石、土壤和水环境中[1]。人体暴露主要经呼吸道和消化道途径进入机体,长期摄入会在体内蓄积,引起慢性砷中毒。由于神经系统具有神经细胞不能再生及对毒物的毒性作用较其他组织系统更为敏感的特殊性,使之在砷中毒的研究中显得尤为重要。人群流行病学调查和动物实验均显示,砷可引起认知障碍、智力低下等神经行为异常[2],但其神经毒作用机制尚不清楚。学习记忆是脑的高级功能之一,是衡量动物智力发育的重要指标,是通过神经系统中突触的神经化学传递等一系列生理生化过程实现的。单胺类神经递质对注意力、记忆力和反应能力有着重要的调节作用,主要包括多巴胺(DA)、去甲肾上腺素(NE) 和5-羟色胺(5-HT)等。任何有害因素使神经系统内这些神经递质的合成、释放和转运减少,都会影响神经递质在突触的正常传递,导致学习功能损伤[3]。
关于砷暴露对动物脑中单胺类神经递质浓度影响的文献报道不多,尤其对低剂量染砷的影响研究更为少见。因此,本文针对亚慢性低剂量暴露条件下,砷对小鼠脑组织单胺类神经递质浓度的影响以及牛磺酸和维生素C对砷中毒时脑的保护作用进行了观察,以期为砷的神经毒作用机制研究提供毒理学依据。
1 材料和方法
1.1 主要药品与试剂
As2O3(sigma,美国);牛磺酸(St.Louis,美国);维生素C(St.Louis,美国); 5-羟色胺(5-HT)(sigma,美国); 多巴胺(DA) (sigma,美国);去甲肾上腺素(NE)(sigma,美国);色谱级甲醇(国药集团化学试剂有限公司,中国);乙酸钠(上海化学试剂有限公司,中国); 高氯酸(天津市鑫源化工有限公司,中国)。实验用水为双蒸水。
1.2 主要仪器
高效液相色谱(1525)-荧光检测器(waters 474)(waters 公司,美国);HC-2518R 高速冷冻离心机(科大创新股份有限公司中佳分公司,中国);玻璃匀浆器;Milli-Q超纯水系统; Morris水迷宫(中国医学科学院药物研究所DMS-2)。
1.3 实验方法
1.3.1 动物分组及处理
SPF级小鼠70只,雌雄各半,体重(20±2) g,购于大连医科大学动物实验中心。按体重将小鼠随机分为6组,即饮用水对照组、1 ppm As2O3染砷组、2 ppm As2O3染砷组、4 ppm As2O3染砷组、两个保护组(4 ppm As2O3+ 150 mg/kg牛磺酸[4]和4 ppm As2O3+45 mg/kg维生素C[5])。除高剂量染砷组(4 ppm As2O3染砷组)20只外,其余每组10只小鼠。小鼠通过自然饮用含不同浓度As2O3蒸馏水方式暴露于砷,保护剂是以灌胃方式给予,每星期2次。高剂量染砷组分别染毒第30和60天,其余组均在第60天断头处死小鼠,取脑组织,-80 ℃冻存。
1.3.2 脑匀浆的制备
颈椎脱臼法处死小鼠,取脑组织,置于-80 ℃冷冻存放。取冰冻脑组织称重,放入预冷的玻璃匀浆器中,加入0.1 mol/L的高氯酸上下转动数十次,充分研磨使组织匀浆化。将匀浆液转入Ependorf离心管中,4 ℃低温离心(10000 r/min,10 min),重复2次,收集上清液,用微孔过滤器过滤,得到待测样品溶液。
1.3.3 Morris水迷宫行为测定
Morris水迷宫[6]实验是一种强迫实验动物游泳、学习寻找隐藏在水中平台的一种实验,主要用于测试实验动物对空间位置感和方向感的学习记忆能力。每次实验以120 s为限,记录动物在120 s内寻找到平台的时间(称逃避潜伏期)。以所需时间作为学习和记忆成绩,若设定时间内未找到站台,计算机停止跟踪,记录时间为120 s。本实验中,设立对照组、1 ppm As2O3和4 ppm As2O3染毒组,每组10只小鼠,雌雄各半。
1.3.4 高效液相色谱-荧光检测法测定脑内单胺类神经递质变化
仪器:Waters 1525高效液相色谱仪,配备Waters 474荧光检测器。分析柱为C18反相色谱柱(250 mm×4.6 mm)。流动相:A=甲醇、 B=0.1 mol/L醋酸钠(内含0.1 mol/L EDTA-2Na)缓冲液(用浓盐酸调pH为5.0,经0.45 μm的微膜过滤并超声脱气后使用),A∶B=1∶9,流速1.0 mL/min。进样体积为20 μL,柱温为室温(25 ℃)。荧光检测器波长设置:激发波长280 nm,发射波长315 nm,采用外标法定量。
标准品的制备:称取标准品NE 4.23 mg、DA 47.40 mg、5-HT 5.318 mg,分别溶于0.1 mol/L HCl中,并定容于50 mL容量瓶,制成标准品储备液(NE 2.5 mmol /L,DA 5 mmol/L,5-HT 0.5 mmol/L),4 ℃保存,再按需要用0.1 mol/L HCl稀释成各种浓度的标准液。
标准曲线:NE在1.0~300 ng/g之间、DA为1.0~250 ng/g之间、5-HT为1.0~200 ng/g之间设定3个浓度系列,取20 μL进样,以峰面积对浓度绘制标准曲线,确定线性范围。
3种单胺类神经递质混合液标准测定色谱图:如图1所示。在本实验条件下,NE、DA、5-HT 3种单胺类神经递质的标准品能够很好的分离。
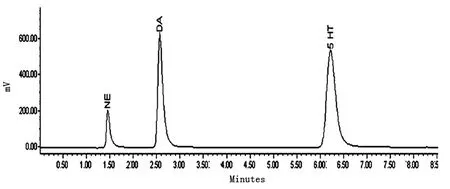
图1 3种单胺类神经递质混合液标准测定色谱图(ng/g)
小鼠脑匀浆中各物质测定色谱图:如图2所示。在本次实验的色谱条件下,NE、DA、5-HT 3种单胺类神经递质得到了良好的分离,其他杂质对测定结果几乎没有干扰。
样品测定:处理后的样品直接进样,以保留时间定性,外标法定量。
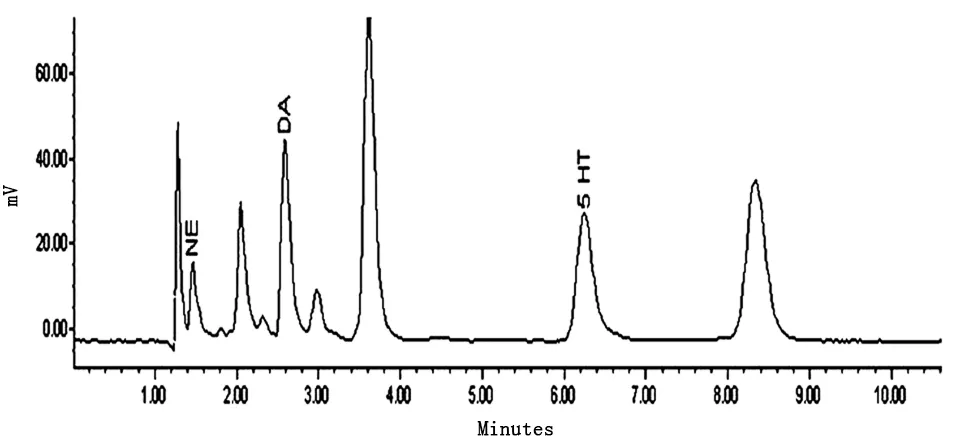
图2 小鼠脑匀浆中3种单胺类神经递质测定色谱图(ng/g)
1.4 统计学方法
2 结 果
2.1 砷对小鼠学习和记忆能力的影响
Morris 水迷宫结果显示,As2O3染毒60 d后,4 ppm As2O3染毒组小鼠的逃避潜伏期比对照组长 (P<0.05),并且逃避潜伏期随着染毒剂量的增加而增长(图3A)。此外,图3B显示,对照组小鼠的逃避潜伏期在60 d内,逐渐呈缩短趋势,而4 ppm As2O3染砷组小鼠的逃避潜伏期从染毒30 d后逐渐增加,与对照组比较差异有显著性意义 (P<0.05)。
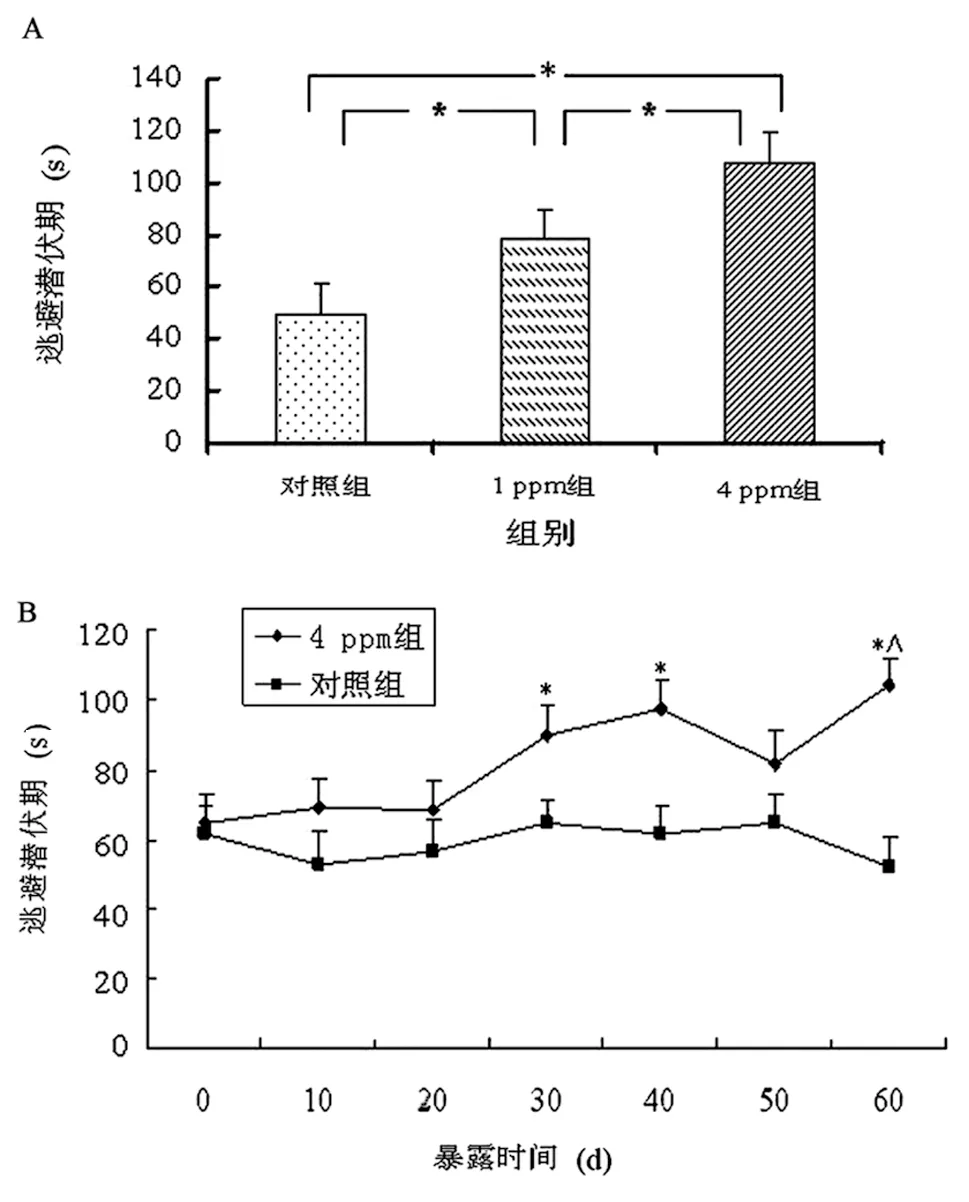
图3 Morris水迷宫测定As2O3对小鼠空间学习和记忆能力的影响
2.2 亚慢性砷暴露小鼠大脑NE、DA和5-HT浓度的变化
如表1所示,与对照组比较,染砷60 d后,染砷组小鼠大脑中5-HT、DA和NE浓度明显减少,差异有显著性意义 (P<0.05),但1 ppm染毒组NE浓度与对照组比较差异无显著性意义;与1 ppm染砷组比较,2 ppm和4 ppm染毒组NE浓度明显减少,差异有显著性意义 (P<0.05);DA含量随染毒剂量的增加逐渐降低,差异有显著性意义(P<0.05)。

表1 亚慢性砷暴露小鼠大脑中3种单胺类神经递质含量
NE:去甲肾上腺素,DA:多巴胺,5-HT: 5-羟色胺。1) 与对照组比,P<0.05; 2) 与1 ppm染砷组比,P<0.05; 3) 与2 ppm染砷组比,P<0.05
2.3 染砷组小鼠大脑中NE、DA和5-HT浓度随时间变化差异
如图4所示,随染砷时间增加,4 ppm组小鼠大脑中NE、DA和5-HT浓度逐渐减少,与染砷第0天比较差异有显著性意义(P<0.05);5-HT在染砷30 d下降趋势较大,但在染砷第30天和第60天比较,差异无显著性意义(P>0.05)。
2.4 牛磺酸和维生素C保护组对小鼠大脑NE、DA和5-HT的影响
如表2所示,与对照组比较,高剂量染砷组小鼠大脑中5-HT、DA和NE浓度明显降低,且差异有显著性意义(P<0.05);与4 ppm染砷组比,维生素C组和牛磺酸组小鼠大脑中3种单胺类神经递质浓度明显升高,除了5-HT在牛磺酸组差异无显著性意义外,其余均差异有显著性意义(P<0.05)。
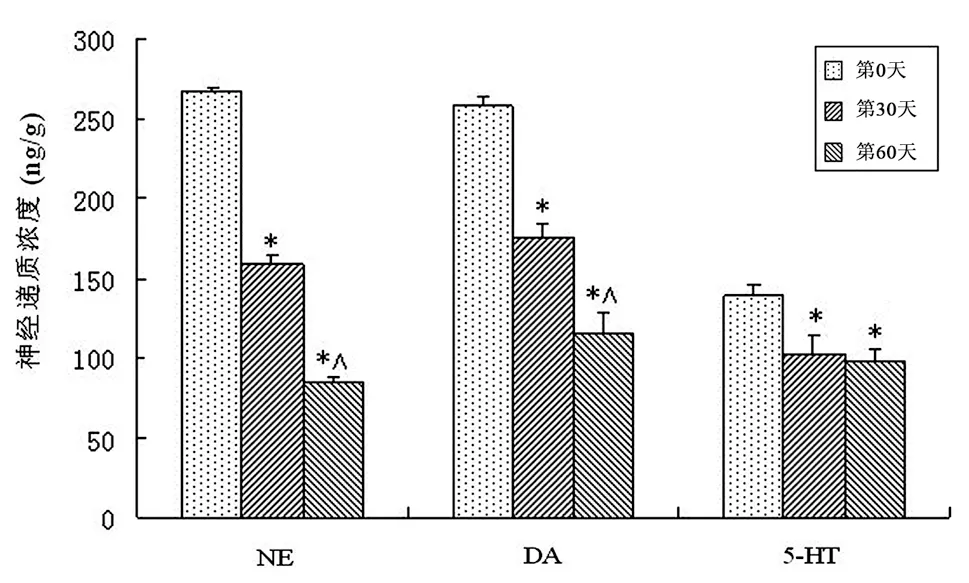
图4 4 ppm染砷组小鼠大脑中单胺类神经递质浓度随时间变化

表2 牛磺酸和维生素C对砷暴露小鼠大脑中3种单胺类神经递质浓度的保护作用
NE:去甲肾上腺素,DA:多巴胺,5-HT:5-羟色胺。1) 与对照组比,P<0.05;2) 与4 ppm组比,P<0.05
3 讨 论
砷是一种公认的神经毒物。据文献报道,职业砷接触可引起成人学习和记忆能力的损害,环境砷暴露可影响儿童的语言能力和长期记忆[7,8]。Morris水迷宫结果显示,砷暴露组小鼠的逃避潜伏期明显比对照组长(P<0.05),随着砷暴露时间的延长,砷暴露小鼠的逃避潜伏期增加,与Miyagawa等[9]的研究结果一致。提示砷暴露可能严重影响小鼠的学习和记忆功能。但目前其神经毒作用机制并不十分清楚。Tripathi等[10]发现,当给予100 ppm砷后大鼠脑内的多巴胺(DA)和去甲肾上腺素(NE)的浓度下降。Delqado[11]也报道,当砷暴露剂量在20~100 ppm时,影响脑中神经递质的含量。这些文献结果提示,神经递质很可能是砷的神经毒作用的靶部位。
本次实验的目的是观察亚慢性低剂量砷暴露对小鼠脑中3种单胺类神经递质水平的影响。与对照组比较,各染砷组小鼠脑中5-HT、DA和NE浓度均有显著性降低(P<0.05)。除5-HT浓度外,其他2种单胺类神经递质随着染毒剂量的增加而逐渐降低,呈现一定的剂量反应关系。而且,随着染毒天数的增加,高剂量染砷组小鼠脑中3种单胺类神经递质均显著降低。本研究结果表明,在接近环境中实际暴露剂量的亚慢性染砷也能够降低小鼠脑中3种单胺类神经递质的水平。一些研究结果显示,NE减少可导致抑郁、痴呆和注意力低下。多巴胺能神经元起源于纹状体而投射到中脑皮质和边缘叶,而这两部分恰恰构成了行为学习通路,所以多巴胺能活性跟学习行为激发有很大关联[12]。大多数的5-HT分布在丘脑、下丘脑、中脑以及脑干的脊核中[13],证明5-HT系统对于调整记忆系统的重要性[14]。本研究结果和文献提示,亚慢性砷暴露对小鼠脑单胺类神经递质浓度影响可能与染砷小鼠学习和记忆力低下有关。
牛磺酸是人体内含量较高的游离氨基酸,在中枢神经系统中具有重要生理功能,是一种有抑制性作用的氨基酸,具有广泛的细胞保护作用[15]。维生素C是人体必需的营养素,参与许多重要的生理功能,如维持细胞正常能量代谢、消除自由基等。本实验结果表明,与4 ppm染砷组小鼠比较,添加牛磺酸和维生素C的小鼠脑中3种单胺类神经递质水平都有不同程度的增高,对砷的毒性具有一定的拮抗作用。这些结果说明,牛磺酸和维生素C对砷所产生的神经递质有害影响具有一定的保护作用。
综上所述,亚慢性低剂量的砷暴露能够降低小鼠脑中3种单胺类神经递质的水平,并且牛磺酸和维生素C对砷导致NE、DA、5-HT水平降低有一定的拮抗作用。今后,进一步深入研究亚慢性砷暴露致脑中3种单胺类神经递质减少的分子机制以及与染砷小鼠学习、记忆力低下之间的内在联系是十分必要的。
[1] 杨克敌.环境卫生学[M].第5版.北京:人民卫生出版社,2006.228.
[2] Rodríguez VM,Limón-Pacheco JH,Carrizales L,et al.Chronic exposure to low levels of inorganic arsenic causes alterations in locomotor activity and in the expression of dopaminergic and antioxidant systems in the albino rat[J].Neurotoxicol Teratol,2010,32(6):640-647.
[3] 封银曼,韦大文,高志卿,等.地黄饮子对痴呆小鼠脑功能及单胺氧化酶活性的影响[J].山东中医杂志,2002,21(11):683-685.
[4] Junyent F,Utrera J,Romero R,et al.Prevention of epilepsy by taurine treatments in mice experimental model[J].J Neurosci Res,2009,87(6):1500-1508.
[5] Nandi D,Patra RC,Swarup D.Effect of cysteine,methionine,ascorbic acid and thiamine on arsenic-induced oxidative stress and biochemical alterations in rats[J].Toxicology,2005,211 (1-2):26-35.
[6] Morris R.Developments of a water-maze procedure for studying spatial learning in the rat[J].J Neurosci Methods,1984,11(1):47-60.
[7] 王三祥,王正辉,程晓天,等.砷氟中毒地区儿童智力水平及生长发育调查与评价[J].中国地方病学杂志,2005,24(2):179-182.
[8] Calderon J,Navarro ME,Jimenez-Capdeville ME,et al.Exposure to arsenic and lead and neuropsychological development in Mexican children[J].Environ Res,2001,85(2):69-76.
[9] Miyagawa K,Narita M,Miyatake M,et al.Behavioral analysis of chronic exposure to diphenylarsinic and associated influence on central nervous systems[J].Nihon Shinkei Seishin Yakurigaku Zasshi,2007,27(5-6):181-189.
[10] Tripathi N,Kannan GM,Pant BP,et al.Arsenic- induced changes in certain neurotransmitter levels and their recoveries following chelation in rat whole brain[J].Toxicol Lett,1997,92(3):201-208.
[11] Delgado JM,Dufour L,Grimaldo JI,et al.Effects of arsenite on central monoamines and plasmatic levels of adrenocorticotropic hormone (ACTH) in mice[J].Toxicol Lett,2000,117(1-2):61-67.
[12] Eagle DM,Humby T,Dunnett SB,et al.Effects of regional srtriatal lesions on motor,motivational,and executive aspects of progressive-ratio performance in rats[J].Behav Neurosci,1999,113(4):718-731.
[13] Page IH,Carlson A.Serotonin.In:Lajhya A,editor.Handbook of neuron- chemistry[M].New York:Plenum Press,1970.251.
[14] Ha TM,Cho DM,Park SW,et al.Evaluating associations between 5-HTTLPR polymorphism and Alzheimer's disease for Korean patients[J].Dement Geriatr Cogn Disord,2005,20(1):31-34.
[15] Pan C,Giraldo GS,Prentice H,et al.Taurine protection of PC12 cells against endoplasmic reticulum stress induced by oxidative stress[J].J Biomed Sci,2010,17(Suppl 1):S17.
