玫瑰花环抑制实验检测肉牛早孕因子(EPF)活性
2011-01-18贺加双马卫明邓立新宋移福刘莲莲曹永芝
贺加双,马卫明,邓立新,宋移福,刘莲莲,曹永芝,谢 冰
(1.山东农业大学动物科技学院,山东泰安 271018;2.河南农业大学牧医工程学院,河南郑州 450002)
早孕因子是哺乳动物受精后最早在血清中检测到的具有免疫抑制和生长调节作用的妊娠相关蛋白。它是一种免疫抑制因子和生长因子,1974年由澳大利亚学者Morton等[1]在孕鼠血清中首次发现,由于在小鼠受精6 h后就可检测到,因此被命名为早孕因子。此后,在妊娠妇女[2]、羊[3]、猪[4]、牛[5]等妊娠哺乳动物母体内相继检测到了EPF。目前普遍认为EPF是热激蛋白家族成员—伴侣蛋白10(Cpn-10)的同系物[6,7],是最早确认妊娠的生化标志之一,是防止母体对胚胎乃至胎儿发生免疫排斥反应的必需物质[8]。由于它能增强抗淋巴细胞血清抑制 T淋巴细胞花环形成,可用花环抑制试验做生物学鉴定。在牛授精后尽早对其做妊娠诊断可以避免空怀,胚胎死亡后早孕因子会迅速下降,因此监测早孕因子活性对肉牛产业意义重大,由于早孕因子在超早期妊娠诊断,肿瘤病的诊断,胚胎监测,治疗实验性自身免疫性脑脊髓膜炎[9,10],流产预测等方面具有潜在的应用价值,因此成为研究的重点。
1 材料与方法
1.1 血样的采集与处理
肉牛血样采自山东省鄄城县鲁西黄牛保种繁殖基地。颈静脉采血取11头不同孕期孕牛(孕期1~2月5头,3~5月4头,6~9月2头)和4头未怀孕肉牛血液做对照。该15头牛体重相当,营养状况和饲喂条件均一致。2 500 r/min离心20 min,分离血清,并在56℃下钝化 30 min,分装,-20℃保存备用。采样时已做妊娠诊断。
1.2 牛外周血淋巴细胞悬液的制备
采集健康肉牛血液,0.1%肝素钠抗凝。加入等体积pH 7.4的PBS液,混匀,按每管4 mL轻轻叠加于盛有等量牛淋巴细胞分离液(D=1.086)的10 mL离心管中。2 000 r/min离心15 min。离心结束后,吸取分离液与血浆交界部位的灰白云雾层,用3倍体积的PBS液以2 500 r/min离心20 min。弃上清,沉淀洗涤2次,取l滴细胞悬液,用台盼兰拒染法镜检计数细胞,最后将细胞调整到2×106个/ mL,备用,并3 h内使用。
1.3 绵羊红细胞(SRBC)的制备
绵羊颈静脉采血,0.1%肝素钠抗凝,2 500 r/min离心15 min分离红细胞。用PBS液洗5次,配成终浓度为1.5%。4℃保存备用。
1.4 玫瑰花环形成率检测
孕牛血清倍比稀释成终体积为100 μ L。加等体积的淋巴细胞,37℃孵育 60 min,加 100 μ L 1.5%的绵羊红细胞,37℃孵育5 min,2000 r/min离心2 min,室温孵育40 min,轻轻重悬,20 μ L 10%的戊二醛固定,涂片,瑞氏染色,镜检。计数淋巴细胞和红细胞形成的花环结构。结合红细胞少于3个的不计入。花环抑制滴度(RIT值)按花环数低于对照组75%的最高血清稀释倍数的对数计算。
1.5 数据分析
数据分析采用SPSS。
2 结果
2.1 玫瑰花环抑制滴度
怀孕1~9月肉牛玫瑰花环抑制滴度是8~10,而对照组花环滴度为3,显著高于对照组,因此按此法做玫瑰花环抑制试验检测肉牛的早孕因子活性,可以认为滴度高于8为怀孕状态(见表1)。

表1 不同孕期肉牛玫瑰花换抑制滴度(RIT值)
2.2 玫瑰花环形成情况
2.2.1 对照组 能形成完整的玫瑰花环,结合红细胞多,花环形成率高。详见图1,图2。
2.2.2 怀孕牛组 淋巴细胞结合红细胞少,花环不完整,花环形成率低,详见图3,图4。

图 1

图2
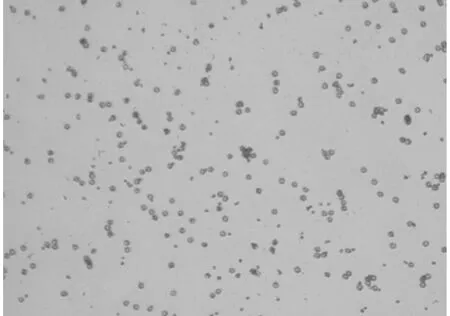
图 3

图4
3 讨论
随着生物技术在畜牧生产中的应用,超早期妊娠诊断、评价胚胎的存活及其活力、分析早期胚胎丢失的原因等显得尤为重要。EPF的发现为其提供了可能,通过Ea玫瑰花环形成抑制试验,测定RIT值判别其存在与否,是目前对EPF的检测的唯一方法,该方法一般需要制备抗淋巴细胞白蛋白(ALS),检测ALS的最大稀释倍数[11,12],用以计算RIT值。方法繁琐,灵敏度差。本试验建立检测抗淋巴血清的最大稀释倍数来计算RIT值的方法,对试验步骤进行了简化,宜于操作,简单可行。
EPF对妊娠母体具有很高的特异性。一旦妊娠终止,血清中EPF立即消失。通过本实验,观察到妊娠牛玫瑰花环抑制滴度显著高于对照组未妊娠牛,是对照组的2倍多。在本实验中,玫瑰花环率高于8可以确认牛怀孕,低于4可以认为未怀孕。因此使用此法早期确认牛是否怀孕是可行的。由于牛胚胎死亡以后,EPF含量迅速减少,所以也可以用来检测胚胎状态。
淋巴细胞和孕牛血清孵育之后,形成的玫瑰花环结合的红细胞减少,可能是淋巴细胞和EPF作用时,影响到牛T细胞膜上具有能和绵羊红细胞膜上的糖蛋白相结合的受体。
由于玫瑰花环抑制试验需要的药品试剂多,操作程序繁琐,在生产中的大规模推广受到了一定的限制,可以通过制备EPF单克隆抗体、多克隆抗体等手段,作出快速诊断试剂或试纸,则可直接检测 ,将为肉牛,乃至哺乳动物的早期、超早期妊娠诊断开创新的途径。
4 结论
本试验使用的检测抗淋巴血清的最大稀释倍数来计算RIT值的方法,对试验步骤进行了简化,宜于操作,效果确实。
在本实验发现,玫瑰花环抑制滴度高于8可以确认牛怀孕,低于4可以认为未怀孕。因此使用此法早期确认牛是否怀孕具有可行性。
[1] Morton H,Hegh V,Chunie G.Immunosuppression detected in pregnant mice by the rosette inhibition test.Nature,1974,249 (456):459.
[2] Morton H,Rolfe B E,Cavanagh A C.Early pregnancy factor [J].Semin Reprod Endocrinol,1992,10:72-82.
[3] A thanasas-Platsis S,Morton H,Dunglison G F,et al.Antibodies to early pregnancy factor retard embryonic development in mice in vivo[J].J Reprod Fertil,1991,92:443-51.
[4] Athanasas-Platsis S,Corcoran C,Kaye P,et al.Early pregnancy factor is required at two important stages of embryonic development in the mouse[J].AJRI,2000,43:223-33.
[5] Noonan F P,Halliday W J.M orton Clunnie GIA:Early pregnancy facto r is immunosuppressive[J].Nature,1979,278:649-651.
[6] Esnglebretsen D R,Gamham B,Alewood P F.A cassette 1igation strategy with thioether replacenebt of three Ghy-Gly peptide bonds:total chemical sy nthesis of the lOl residue protein early pregnancy factor[psi(CH2S)28-29,56-57,76-77].J 0rg Chem.2002,67(17):5883.
[7] F1etcher B H,Cassad A I,Summers K M,et al.The murine chaperonin 10 gene fami1y contains an intronless,putative gene for early pregnancy facto r,Cpnl0-rs1.Mamm Genome,2001,12 (2):133.
[8] Clara Aranha,Arvind Bordekar,Savitri,et al.Isolation and purification of an early pregnancy factor-like molecule from culture supernatants obtained from lymphocy tes of pregnant women[J].Journal of Assisted Reproduction and Genetics, 1998,(15):619-624.
[9] Jacqueline Harness,Alice Cavanagh,Halle M orton,et al.A protective effect of early pregnancy factor on experimental autoimmune encephalomyelitis induced in Lewis rats by inoculation with myelin basic protein[J].Journal of the Neurological Sciences,2003,216:33-41.
[10] Zhang B,Harness J,Somodevilla-Torres M J,et al.Early pregnancy factor suppresses experimental autoimmune encephalomyelitis induced in Lewis rats with myelin basic protein and in SJL/J mice with myelin proteolipid protein peptide[J].Neurol Sci,2000,182(1):5-15.
[11] 孙文东,张 坚,赵丽霞,等.早孕因子生物学活性的研究现状和应用前景[J].中华临床医药,2004,5(17):56-58.
[12] 权 凯 ,张改平.应用 Ea玫瑰花环抑制试验检测奶牛血清EPF活性[J].中国奶牛,2008,26(6):29-31.
