急性脑梗死患者血清中基质金属蛋白酶9和脂蛋白相关磷脂酶A2的动态改变
2011-01-16阳泽彬王金良
阳泽彬 王金良
急性脑梗死患者血清中基质金属蛋白酶9和脂蛋白相关磷脂酶A2的动态改变
阳泽彬 王金良
脑梗死 急性病 基质金属蛋白酶9 磷脂酶A2 脂蛋白类
脑梗死是多发病之一,且发病趋于年轻化。对脑梗死早期诊断的血清标志物的研究受到重视,但真正能反映早期脑梗死的标志物甚少。最近,国外报道血清中基质金属蛋白酶9(MMP-9)和脂蛋白相关磷脂酶A2(LP-PLA2)升高与缺血性心脑血管疾病,尤其是脑梗死早期发病关系密切,且可反映患者的治疗效果和预后[1]。本文就急性脑梗死患者的此2项指标进行动态观察与探讨。
1 对象与方法
1.1研究对象 选择我院2007年6月—2009年5月收治入院的急性脑梗死患者146例(A组),年龄41~66岁,平均(54±12)岁,男88例,女58例。诊断符合2004年全国第4届脑血管病学术会议修定的《各类脑血管疾病诊断要点》的标准,且均经CT或MRI检查确定梗死部位与面积。均排除冠心病、感染、肝肾功能不全和自身免疫病等。患者的神经功能缺损评分依据1995年全国脑血管病学术会议通过的脑卒中患者的评分标准(NDS)。依据CT或MRI检查结果和NDS评分将患病严重程度分为轻型(0~15分)、中型(16~30分)和重型(31~45分)。患者的脑梗死面积依入院时的首次CT或MRI检查结果,按Adama分型法分为腔隙性梗死(梗死直径<1.5 cm),小梗死(1.5~3.0 cm)和大梗死(直径>3.0 cm,且累及2个脑解剖部位)。选择同期入院的年龄和性别匹配的良性胃、肠疾患,外伤,骨折患者50例为非脑梗死疾患组(B组),均排除脑梗死的症状与体征。男28例,女22例,平均年龄(54±10)岁。同期健康查体者50例为健康组(C组),男28例,女22例,平均年龄(54±9)岁。3组间性别(χ2=1.22)和年龄(F=0.81)差异无统计学意义(P>0.05)。患者均经体检和常规生化检验排除了高血压和心、脑血管疾病。
1.2观察方法 患者均于入院的当日进行治疗前采血,并于入院治疗后的5、10、15及20 d采血,分离血清,冻存于-40℃待测定。按上述方法完成患者病情严重程度、脑梗死面积的判定。
1.3测定方法 用酶联免疫吸附测定(ELISA)法测定血清中2项指标水平。测定用酶标仪为BIO-RAO Model 680,洗板机为Model 1575。MMP-9试剂用美国TPI公司制品。该试剂盒的测定批内变异6.6%,批间变异8.9%。LP-PLA2试剂用美国R&D公司制品。该试剂盒的测定批内变异5.5%,批间变异7.8%。
1.4统计学方法 采用SPSS 12.0统计软件包进行统计分析。符合正态分布的计量资料以x ±s表示,组间比较采用单因素方差分析,进一步组间比较用q检验,P<0.05为差异有统计学意义。
2 结果
2.1各组血清中MMP-9和LP-PLA2水平比较 3组间MMP-9比较差异均有统计学意义(均P<0.05)。A组与B、C组间LP-PLA2的比较差异有统计学意义(P<0.05),见表1。
表1 各组血清中MMP-9和LP-PLA2水平的比较
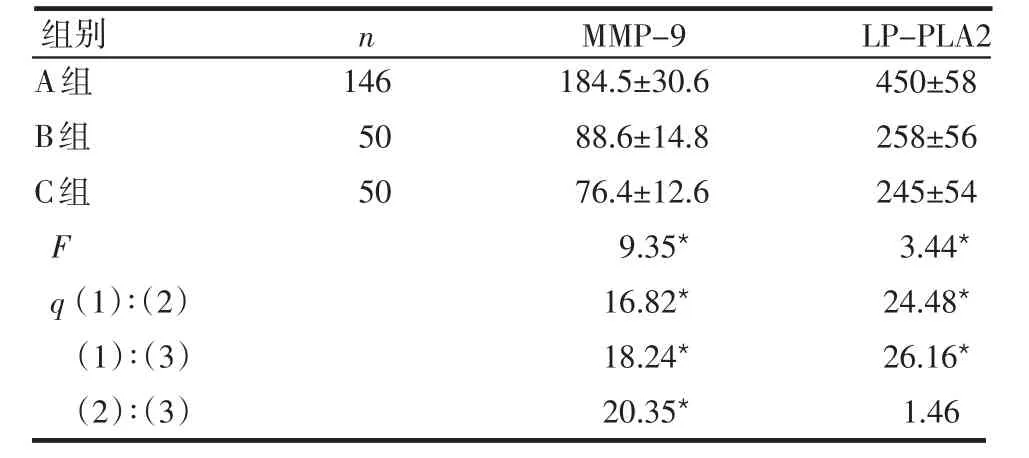
表1 各组血清中MMP-9和LP-PLA2水平的比较
*P<0.05
组别 n MMP-9 LP-PLA2 A组B组C组F q(1)∶(2)(1)∶(3)(2)∶(3)146 50 50 184.5±30.6 88.6±14.8 76.4±12.6 9.35*16.82*18.24*20.35*450±58 258±56 245±54 3.44*24.48*26.16*1.46
2.2急性脑梗死患者血清中2项指标的动态变化 1 d与10 d,10 d与20 d间MMP-9和LP-PLA2的差异均有统计学意义,(P<0.05或P<0.01),见表2。
2.3不同严重程度急性脑梗死患者血清中2项指标水平比较 MMP-9和LP-PLA2在轻型组和中、重型组的1 d与20 d的组间比较差异有统计学意义(均P<0.05),见表3。
2.4不同梗死面积急性脑梗死患者血清2项指标比较 3组MMP-9和LP-PLA2的1 d和20 d的组间比较差异均有统计学意义(P<0.05),见表4。
作者单位:300042 天津市公安医院检验科
表2 急性脑梗死患者血清中2项指标的动态变化
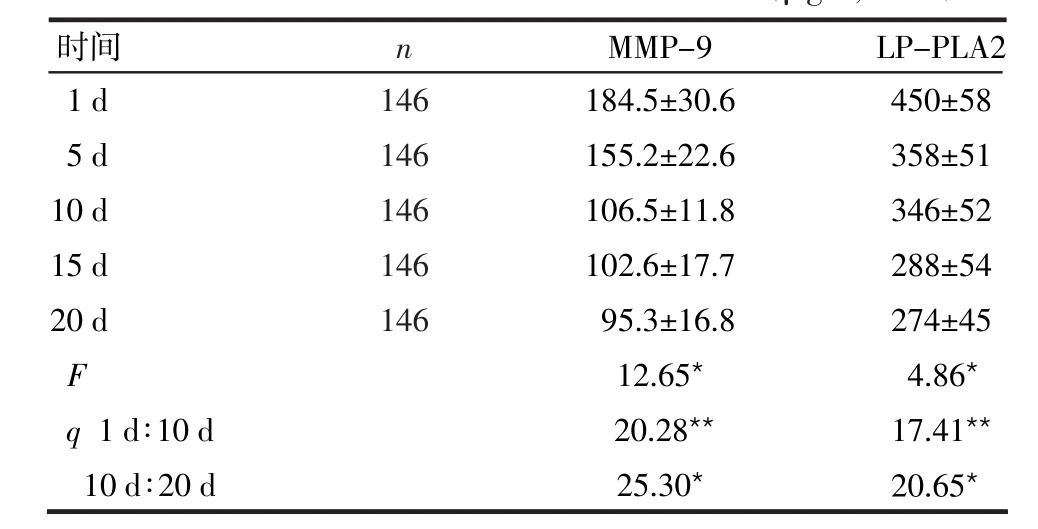
表2 急性脑梗死患者血清中2项指标的动态变化
**P<0.01,*P<0.05
时间 MMP-9 LP-PLA2 1 d 5 d 10 d 15 d 20 d F q 1 d∶10 d 10 d∶20 d 184.5±30.6 155.2±22.6 106.5±11.8 102.6±17.7 95.3±16.8 12.65*20.28**25.30*450±58 358±51 346±52 288±54 274±45 4.86*17.41**20.65*n 146 146 146 146 146
表3 不同严重程度急性脑梗死患者血清中2项指标水平比较
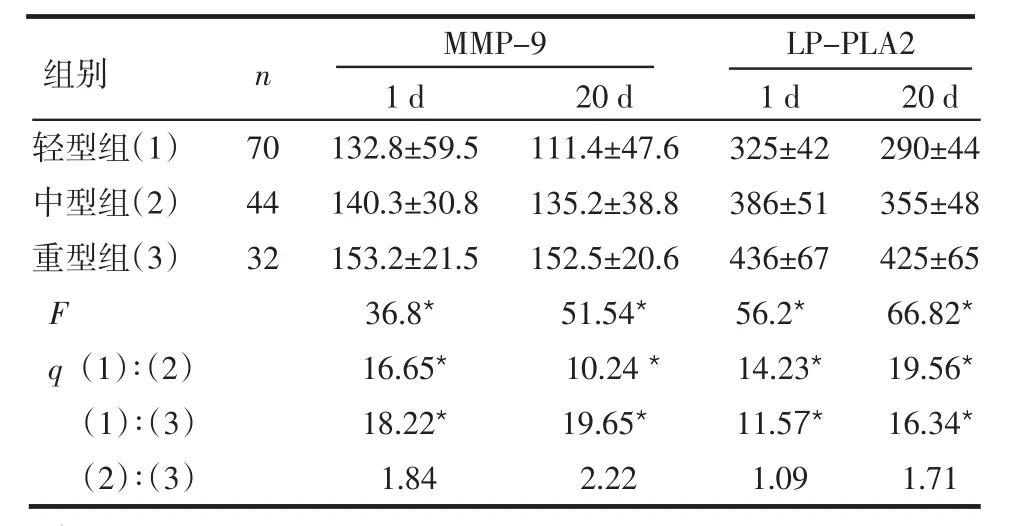
表3 不同严重程度急性脑梗死患者血清中2项指标水平比较
*P<0.05
组别 n MMP-9 1 d 20 d LP-PLA2 1 d 20 d轻型组(1)中型组(2)重型组(3)F q(1)∶(2)(1)∶(3)(2)∶(3)70 44 32 132.8±59.5 140.3±30.8 153.2±21.5 36.8*16.65*18.22*1.84 111.4±47.6 135.2±38.8 152.5±20.6 51.54*10.24*19.65*2.22 290±44 355±48 425±65 66.82*19.56*16.34*1.71 325±42 386±51 436±67 56.2*14.23*11.57*1.09
表4 不同梗死面积急性脑梗死患者血清中2项指标水平比较

表4 不同梗死面积急性脑梗死患者血清中2项指标水平比较
*P<0.05
组别 n MMP-9 1 d 20 d LP-PLA2 1 d 20 d腔隙性梗死组(1)小梗死组(2)大梗死组(3)F q(1)∶(2)(1)∶(3)(2)∶(3)65 38 43 135.8±28.5*143.3±30.5*188.2±41.6*44.55*14.44*15.82*11.46*102.7±27.6 140.2±21.8 174.5±24.2 74.66*21.25*16.34*18.22*286±29 367±46 407±48 84.82*26.28*22.46*18.51*304±40*385±47*422±51*87.67*24.26*27.42*23.45*
3 讨论
患者血清中的脑标志物研究已引起国内外的广泛重视。近年来发现值得重视的标志物有S100B蛋白、神经元特异性烯醇化酶(NSE)、超敏C反应蛋白(hsCRP)、MMP-9、髓性碱性蛋白(MBP)、血管内皮细胞黏附因子(VCAM)、von Willbrand因子(vWF)和 D 二聚体(D-D)等[1]。国内对MMP-9和LP-PLA2的研究报道尚少。
MMP是依赖锌和钙离子的水解酶家族,其中可降解明胶类者有明胶酶A(MMP-2,分子质量72 ku),和明胶酶B(MMP-9,分子质量92 ku)。脑组织损伤时,MMP-9表达上调,并可导致血脑屏障漏出和细胞死亡。
本文发现急性脑梗死组患者MMP-9在发病入院的当日即明显升高,病情越严重,梗死面积越大患者血清MMP-9含量越高。Castellanos等[2]观察250例脑栓塞患者,发现血清中MMP-9是其独立相关因素。在鼠卒中模型中,脑缺血后6~24 h即有MMP-9的升高[3]。上述结果与本文的结果一致。一项最新的研究显示,接受rtPA溶栓治疗的卒中患者的MMP-9浓度升高,可能提示“洗脱”现象[4]。超急性的MMP-9浓度升高可作为rtPA治疗后出血并发症的预测。
本研究发现急性脑梗死患者LP-PLA2水平升高,梗死面积越大LP-PLA2水平越高。LP-PLA2是分子质量为50 ku的钙离子非依赖性丝氨酸酯酶,水解氧化的磷脂释放促炎症溶血磷脂酰胆碱和氧化脂肪酸。LP-PLA2结合于血循环中的低密度脂蛋白(LDL),尤其易与小而密的LDL颗粒结合,其活性可以代表血浆中小而密LDL颗粒的水平,故可促动脉硬化,是心、脑血管病的重要因素[5]。美国FDA已经批准使用LP-PLA2作为冠心病和卒中长期预后风险的指标。鹿特丹一项研究观察8 000例年龄>55岁的男性和女性,LP-PLA2升高者在平均随访时间为6.4年里有110例发生缺血性卒中[6]。LP-PLA2的检测可以测质量也可以测活性,活性测定法的结果差异很大[7]。故本文采用质量法。
本文结果表明2项指标均是早期辅助诊断急性脑梗死的有用指标,其共同特点是:在脑梗死的早期血清中即明显升高,经治疗后逐步减少。其水平与脑梗死的严重程度和梗死面积有一致关系。
近年来,多种标志物联合检测辅助诊断脑梗死逐渐受到重视。Laskowitz等[8]对130例疑为急性脑梗死的患者在症状出现的6 d内检测D-二聚体、CRP和MMP-9等指标,结果显示缺血性卒中的敏感性为81%,特异性70%。Whiteley等[9]最近发表关于预测和诊断缺血性卒中的标志物的系统评价结果显示,大多数的生物标志物单独使用时有较高的敏感性或特异性,但研究设计均有缺陷,包括研究规模较小,对照人群选择不当,诊断的分割点不明确等,本文由条件所限也难避免上述缺陷,尚有待进一步深入研究。
[1] Laterza OF,Modur VR,Crimmins Dl,et al.Identification of novel brain biomarkers[J].Clin Chem,2006,52(9):1713-1721.
[2] Castellanos M,Leira H,Serena J,et al.Plasma MMP-9 concentra⁃tion predict Acute focal ischemia[J].Stroke,2003,34(1):40-46.
[3] Sumli T,Lo EH.Involvement of MMP in thrombolysis-associated hemorrhagic transformation after embolic focal ischemia in rats[J].Stroke,2002,23(2):831-836.
[4] Horstmann S,Kalb P,Koziol J,et al.Profiles of matrix metalloprotein⁃ases and their inhibitors,and laminin in stroke patients:influence of different therapies[J].Stroke,2003,34(11):2165-2170.
[5] Gazi I,Lourida ES,Filipatos T ,et al.Lipoprotein-associated phos⁃pholipase A2 activity is a marker of small,dense LDL particles in human plasma[J].Clin Chem,2005,51(10):2264-2273.
[6] Oei HH,van der Meer IM,Hofman A,et al.Lipoprotein-associated phospholipase A2 activity is associated with risk of coronary heart disease and ischemic stroke:the Rotterdam Study[J].Circulation,2005,111(3):570-575.
[7] Ballantyne CM,Hoogeveen RC,Bang H,et al.Lipoprotein-associat⁃ed phospholipase A2,high sensitivity C-reactive protein,and risk for incident coronary heart disease in middle-aged men and women in the ARIC study[J].Arch Intern Med,2005,165(9):2479-2484.
[8] Laskowitz DT,Blessing R,Floyd J,et al.Panel of biomarkers pre⁃dicts stroke[J].Ann N Y Acad Sci,2005,1053(10):30.
[9] Whiteley W,Chong WL,Sengupta A,et al.Blood markers for the prognosis of ischemic stroke:a systematic review[J].Stroke,2009,40(5):e380-389.
(2010-04-19收稿2010-08-31修回)
(本文编辑 魏杰)
