长牡蛎细胞周期调控关键基因cyclin B3的克隆及其在性腺发育中的作用
2011-01-12阙华勇张国范
王 桐, 李 莉 阙华勇 张国范
(1. 中国科学院 海洋研究所, 山东 青岛 266071; 2. 中国科学院 研究生院, 北京 100049)
长牡蛎细胞周期调控关键基因cyclin B3的克隆及其在性腺发育中的作用
王 桐1,2, 李 莉1, 阙华勇1, 张国范1
(1. 中国科学院 海洋研究所, 山东 青岛 266071; 2. 中国科学院 研究生院, 北京 100049)
首次在长牡蛎(Crassostrea gigas)中克隆得到细胞周期蛋白B3(cyclin B3)的cDNA全长序列和基因组结构序列。cyclin B3基因cDNA全长2383 bp, 其中编码区长度为1293 bp, 编码一条含430个氨基酸的多肽链, 氨基酸序列比对和结构域分析均表明其为其他物种cyclin B3的同源蛋白, 预测的蛋白大小为47.8 kD。cyclin B3基因含有10个外显子和9个内含子, 外显子和内含子的数目和大小与其物种的进化地位相符。Real Time PCR分析表明, 该基因表达有较强的组织特异性, cyclin B3 mRNA在性腺中的含量最高, 而在外套膜中的含量最少, 前者是后者的 92倍左右; 对处于不同发育阶段性腺中cyclin B3基因表达分析结果显示, 性腺中cyclin B3 mRNA含量随性腺发育程度的提高而提高, 这与其在细胞分裂和减数分裂中的作用相符, 同时也有助于满足早期胚胎发育时期旺盛的细胞分裂对 cyclin B3蛋白需求。
长牡蛎(Crassostrea gigas); 细胞周期调控; cyclin B3; 性腺; Real Time PCR
细胞周期是一个在 S期进行 DNA复制并在M期进行染色体分离的循环过程, 对大多数细胞而言,还有 G1、G2两个时相, 分别为细胞进入 S期和 M期在营养物质等方面做必要准备[1]。细胞周期的时相转换是一个复杂的过程, 蛋白激酶或调控因子如细胞周期蛋白(cyclin)、周期蛋白依赖性激酶(Cyclin Dependent Kinase, CDK)、CDK抑制性因子(CDKI)、CDK 活化激酶(CDK Activation Kinase)、PLK(Polo-like Kinase)等组成的调控网络组成的调控网络参与其中, 为细胞周期时相的有序推进进行精细调控。
周期蛋白 B(cyclin B)是首先在海洋无脊椎动物海胆中发现的一种细胞周期调控因子, 以在细胞周期中其蛋白丰度呈现周期性变化为典型特征, 在细胞分裂间期积累, 在细胞分裂期被蛋白酶复合物APC降解。cyclin B作为调节亚基依靠周期蛋白框与CDK1(p34CDC2)组成 MPF(Maturation或 M-phase Promoting Factor)二聚体复合物[2], 在精母/卵母细胞减数分裂、G1/S和G2/M 转化中发挥作用[3-8], CDK1的T14、Y15的去磷酸化和T161的磷酸化实现MPF的活化[9-12]而MPF活性降低依靠CDK1上述氨基酸位点的去磷酸化以及 cyclin B蛋白的泛素化降解途径[13]实现。目前已知的MPF的底物有200多种, 如组蛋白H1(histone 1), DNA复制相关的基因(cdc6、orc2/6 等)、纺锤体组装相关基因(Ase1、Kar3、Kip2/3、Slk19、Stu2等)、微丝聚合相关基因(Bem1/3)等[14],MPF通过磷酸化上述底物, 完成细胞周期时相的转换或停滞, 实现体细胞的增殖和分化、配子减数分裂,进而保证胚胎或机体生长发育和生殖等生理过程的正常进行。
长牡蛎(Crassostrea gigas)是世界上重要海水养殖物种, 也是我国传统的四大养殖贝类之一, 目前对长牡蛎细胞周期调控基因克隆方面的研究还未见报道。本研究中克隆了长牡蛎cyclin B3基因的cDNA全长序列和基因组结构序列, 对其进行比较分析,利用Real Time PCR技术检测了该基因在不同组织中的表达特点并分析了其在性腺发育中的作用。本研究首次在贝类中克隆得到cyclin B3基因, 初步证实了cyclin B3基因与性腺成熟发育的密切关系, 期望对深入研究双壳贝类性腺成熟机理和指导长牡蛎养殖实践能起到一定作用。
1 材料与方法
1.1 实验材料与主要试剂
本研究中所用的牡蛎个体购自青岛市南山水产品市场, 实验前选择活力强、壳长8.8~11.8 cm的长牡蛎去净附着物后在海水温度19 ℃± 2 ℃的暂养池中充气暂养7d以上, 每天换水一次并每天3次定时定量投喂螺旋藻粉饵料, 使其充分适应实验室环境。
外资银行的争相布局,其国际化程度、人力资源等方面的优势,让云南的企业成了最先的受益者,为企业带来了更多选择。
本实验研究中所用基因组DNA提取试剂盒、总RNA提取试剂盒购自上海飞捷生物技术有限公司,M-MLV、DNase I 等购自Promega公司, dNTP mix、DNA 片段纯化试剂盒、末端转移酶(TdT)、dCTP、反转录试剂盒(含gDNA Eraser)、Real Time PCR试剂盒等购自TAKARA公司, 高保真Taq酶、pEASY-T1克隆载体、Trans1-T1化学感受态细胞购自北京TransGen生物技术有限公司, PCR胶回收试剂盒购自 Axygen公司, 实验所用引物由生工生物工程(上海)有限公司合成(表1), 序列测定由上海桑尼生物科技有限公司完成。
用test-F和test-R获得PCR的扩增产物经测序获得473 bp的片段, 双序列比对结果显示与待验证EST中对扩引物之间的序列有 99.32%的一致性, 证明该EST的正确性, 可用于cDNA全长的克隆。
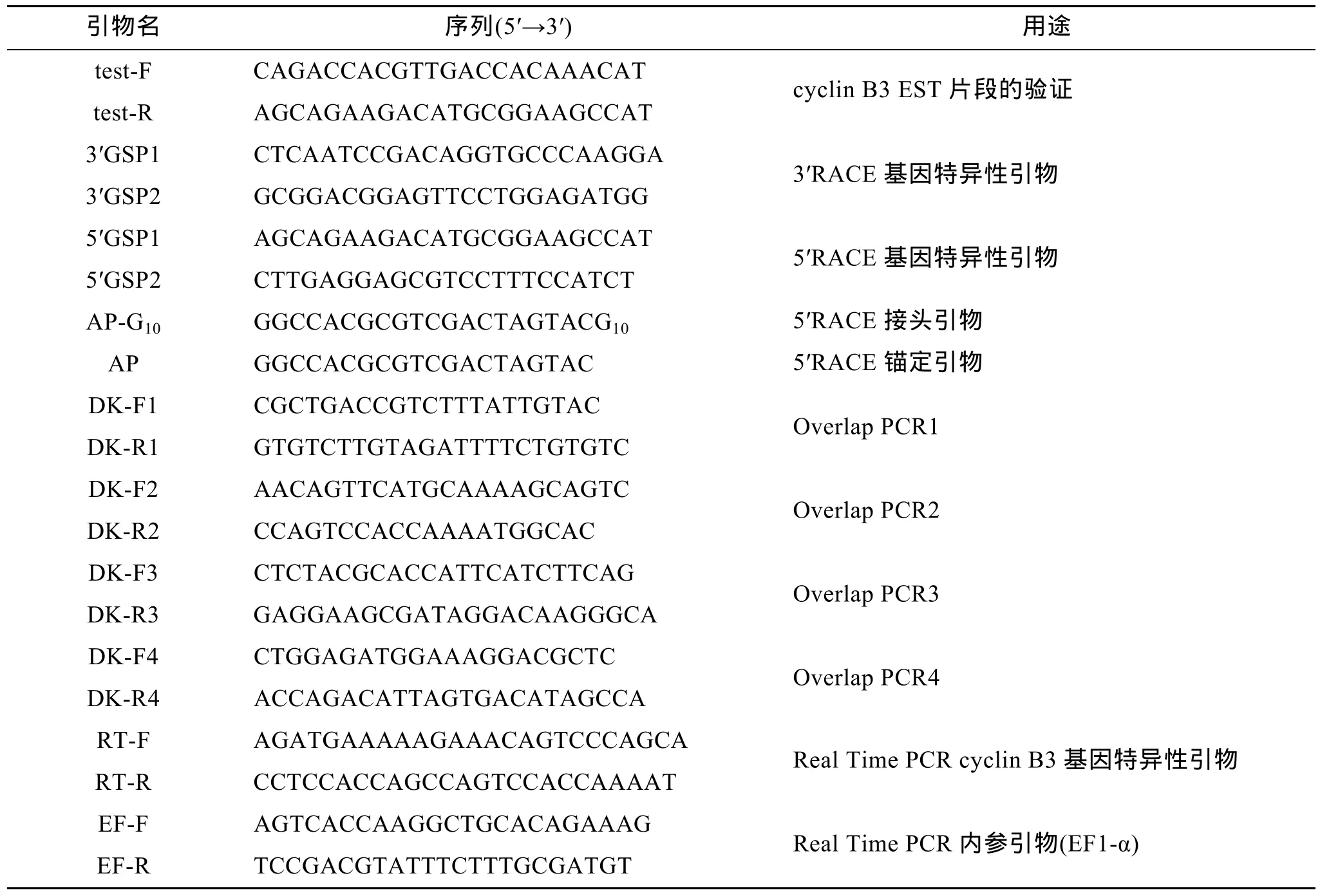
表1 本研究所用到的主要引物序列及用途Tab. 1 Sequences and applications of primers used in this study
1.2 长牡蛎cyclin B3基因全长cDNA序列的克隆与分析
1.2.1 cDNA的制备
3′RACE 获得一条长 1147 bp 的片段, 5′RACE 得到一条长1082 bp的片段。将上述序列与EST验证测序结果进行拼接, 获得长牡蛎cyclin B3基因全长cDNA序列(Accession NO. HQ878119), 总长 2383 bp(含Poly A尾), 其中编码区长度为1293 bp, 终止密码子为UAG, 编码1条含430个氨基酸的多肽链。5′UTR长度为 185 bp, 3′UTR长度为 880bp, 含有 2个加尾信号(AAUAAA), 4个cyclinA/B mRNA降解敏感性位点(AUUUA)以及 10个 CPE元件(A/UUUUUAU/A)。所编码的多肽链预测蛋白大小约为48.7 kD, 等电点为5.56。该多肽链含有B3-型周期蛋白特有的结构域, 如中部含有可与MPF的催化亚基 CDK1(p34CDC2)结合的周期蛋白框, N端第60~68位含有可与泛素结合进而被蛋白酶体降解的的M期B3型周期蛋白降解盒(destruction box)序列RXAFGXIXN, 且降解盒下游有一个在整条多肽链中Lys最丰富的区域, 第77~107位区域中共有13个Lys位点(cyclin蛋白中该区域平均Lys含量为6个[13]),在cyclin泛素降解途径中执行与泛素(Ubiquitin)结合的功能; C端第313~319位有B3-型周期蛋白的典型序列cAMP依赖的pKA磷酸化相关区域FLRRXAK。
1.2.2 一段长牡蛎cyclin B3基因EST序列的验证
分别选取性腺透明内脏团完全可见、性腺初现白色且内脏团可见和性腺白色且基本遮盖内脏团但光学显微镜下仍不能分辨性别的长牡蛎各 3只, 编号 Gn1、Gn2、Gn3, 剪取各组性腺组织块, 组内混合在一起并提取其总 RNA, 进行完整性检测后反转录获得实验用cDNA模板。Real Time PCR检测各性腺发育时期的 cyclin B3基因表达水平, 方法同前,收集并用SPSS 18.0软件进行数据分析。
1.2.3 长牡蛎cyclin B3基因cDNA全长的克隆和序列分析
阳光物业历经多年的跨越式发展,形成了国有企业物业管理独特的优势。分公司以天津大厦为依托,为天津石油单位提供优质服务,提升阳光物业品牌的市场影响力和知名度,让“阳光品牌”在天津扎根,为企业的稳健发展奠定良好的基础。
提取 1.2中长牡蛎个体鳃组织的基因组 DNA,电泳法检测 DNA的纯度和完整性。 利用获得的cyclin B3 cDNA全长序列和长牡蛎基因组序列, 在cyclin B3基因编码区和3′和5′UTR侧翼序列分别设计 4对 Overlap PCR引物 DK-F1/R1、DK-F2/R2、DKF3/R3、DKF4/R4, 将获得的 PCR产物回收并克隆测序, 用 DNAMAN6.0软件完成片段拼接, 获得cyclin B3基因的外显子-内含子序列, 利用cyclin B3基因cDNA序列和其基因组序列在NCBI网站上的Splign内含子分析工具分析获得cyclin B3基因的外显子-内含子结构, 并对cyclin B3的结构进行种间比较分析。
用DNAMAN 6.0软件将测序结果与EST验证结果进行拼接, 得到基因的cDNA全长, 并通过重测序消除不确定碱基。通过BLASTx比对, 在NCBI网站上查找相关物种的 cyclin B3蛋白氨基酸序列, 用DNASTAR 7.0 软件进行蛋白大小等性质预测, 用Mega 4.0软件进行序列比对分析和系统进化树构建。
1.3 长牡蛎cyclin B3基因基因组结构序列的克隆和分析
5′序列的获得:根据 EST验证结果设计一对巢式 PCR 引物:5′GSP1 和 5′GSP2。用 DNA 片段纯化试剂盒纯化反转录的cDNA。用TdT在cDNA3′末端加上Poly C尾巴。以加尾后的cDNA作为模板, 以AP-G10/5′GSP1和 AP/5′GSP2为引物进行巢式 PCR,将获得的产物回收测序, 方法同前。
1.4 长牡蛎cyclin B3基因RNA水平表达特点分析
长牡蛎 cyclin B3基因的组织表达分析在 ABI 7500 Fast Real Time PCR仪上实现。分别取3只长牡蛎得鳃、外套膜、血淋巴、性腺(白色、基本遮住内脏团, 但光学显微镜下仍不能分辨其性别)、闭壳肌、消化腺, 将每种组织混在一起, 提取上述组织的总RNA, 琼脂糖凝胶电泳法检测RNA完整性, 反转录获得Real Time 实验用cDNA模板。cyclin B3基因特异性引物为 RT-F/R, 内参引物为 EF-F/R, 用TAKARA Premix Ex Taq (Perfect Real Time) Real Time PCR试剂盒配成体系上机, 反应程序为 94℃30s (94 ℃ 5s、60℃ 30s)×40个循环, 收集并用SPSS 18.0软件进行数据分析。
通过BLASTx同源比对, 在NCBI数据库中找到一段长牡蛎cyclin B3基因的EST序列(Accession NO.CU998380.1), 通过这段 EST序列用Primer Premier 5.0软件设计一对引物test-F和test-R, 以cDNA为模板进行PCR反应, 对产物进行1%琼脂糖凝胶电泳、切胶、回收纯化目的片段、将目的片段连接到pEASY-T1载体中、连接产物转化Trans1-T1化学感受态细胞后送测序, 用DNAMAN 6.0软件进行序列比对分析。
3′端序列的获得:根据 EST验证结果设计一对巢式 PCR 引物 3′GSP1 和 3′GSP2。以用 3′CDS 为引物反转录合成的 cDNA为模板, 以 3′GSP1/UPM 和3′GSP2/NUP为引物进行巢式PCR, 将获得的产物进行回收测序, 方法同前。
2 结果与分析
2.1 cyclin B3基因全长cDNA的克隆与序列分析
2.1.1 EST序列的验证
观察组患者治疗前MMSE评分为(13.96±4.95)分,对照组为(14.01±4.93)分,两组比较,差异无统计学意义(P>0.05),具有可比性;治疗后,观察组MMSE评分为(21.52±3.26)分,对照组为(18.27±2.98)分,两组均较治疗前明显改善(P<0.05),且观察组改善程度更为明显(P<0.05)。
2.1.2 cyclin B3基因cDNA全长的克隆和序列分析
取长牡蛎性腺组织, 用飞捷组织RNA抽提试剂盒提取其总 RNA, 琼脂糖凝胶电泳法验证其完整性和DNaseⅠ去除混杂的基因组DNA后用M-MLV反转录酶进行反转录, 合成的第一链 cDNA保存于-20℃冰箱中备用。
将推导的长牡蛎 cyclin B3氨基酸序列与水螅(Hydra magnipapillata, Accession NO. XP_002160446.1)、佛罗里达弓背蚁(Camponotus floridanus, Accession NO. EFN74068.1)、海星(Marthasterias glacialis,Accession NO. CBG91877.1)、斑马鱼(Danio rerio,Accession NO. AAI54345.1)、爪蟾(Xenopus laevis,Accession NO. NP_001079361.1)、鸡(Gallus gallus,Accession NO. NP_990570.1)的cyclin B3氨基酸序列进行多序列比对, 发现上述6个物种与长牡蛎cyclin B3氨基酸序列一致性在40%~45%之间, N端和N端近中部的氨基酸长度和氨基酸序列变化较大, 而 C端和 C端近中部的保守性明显较高, 七个物种都具有上述cyclin B3蛋白特征性的结构域。详见图1和图2。
限于篇幅的原因,对于逻辑斯蒂方程的演绎过程与生长曲线方程的推导从略。逻辑斯蒂方程的基本形式为和μ都是经验参数,只能按所得数据用逻辑斯蒂方程本身拟合来予以确定。在求导逻辑斯蒂方程时,参数K和μ可以用最小二乘法求得,而对于Wm,可取3对观测量(t1,w1),(t2,w2),(t3,w3)代入求得。
通过邻接法构建了cyclin B3基因的系统发育树(bootstrap test中replications值设为1000000), 如图3所示。脊椎动物cyclin B3聚为一个大的分支, 而长牡蛎cyclin B3基因的进化地位与其物种的进化地位相似, 总体上处于无脊椎动物的大分支上, 并且与水螅、旋毛虫聚在一个次分支而与佛罗里达弓背蚁、印度跳蚁和海星处在不同的进化分支上。
2.2 长牡蛎 cyclin B3基因组结构的获得与分析
用Overlap PCR的方法获取了长牡蛎cyclin B3基因的基因组结构信息, 共获得5347 bp的该基因的基因组序列信息(Accession NO. HQ878120), 将其与2.1中获得的cDNA全长序列用NCBI上的Splign内含子在线分析工具进行分析, 发现该基因共含有 10个外显子和 9个内含子, 且内含子-外显子边界均符合“GT-AG”的剪接规则。不同物种cyclin B3的基因组结构比较显示, 随物种的进化, 外显子和内含子数逐渐增多, 长牡蛎的cyclin B3基因的外显子数目和编码蛋白大小处于过渡阶段, 至哺乳类时数目稳定在 12个, 编码蛋白的大小也相应增大; 除个别例外以外, 内含子随物种进化逐渐变长。对昆虫纲的埃及斑纹(Aedes aegypti)和致倦库蚊(Culex quinquefasciatus)等的cyclin B3基因组结构信息进行分析发现,昆虫纲(至少是双翅目昆虫)的外显子-内含子进化不符合上述规律。详见图4、表2和表3。
根据Zhang Y,Shao J H等[12,13]的方法,并稍作修改,使用扫描电子显微镜观察、记录添加刺槐豆胶以及空白组冷冻面团冻藏不同时间的微观结构。将冻藏后样品放入1 cm2大小的正方形模具中进行冷冻干燥,冷冻干燥结束后用导电双面胶固定到样品台上进行样品表面喷金,喷金后置于SEM下观察(电压10 kV),拍摄放大倍数2000倍的图像。

图1 长牡蛎cyclin B3基因cDNA序列全长及推导的氨基酸序列Fig. 1 The nucleotide and deduced amino acid sequence of Crassostrea gigas cyclin B3 cDNA

图2 长牡蛎与6个物种的cyclin B3氨基酸序列比对Fig. 2 Alignments of the deduced amino acid sequence of Crassostrea gigas cyclin B3 with six other species

图3 cyclin B3基因邻接法系统发育树Fig. 3 Neighbor-joining phylogenetic tree of cyclin B3 gene
2.3 长牡蛎cyclin B3基因RNA水平上表达特点分析
Real Time PCR分析cyclin B3组织表达特点如图5所示, 该基因在长牡蛎各器官中均有表达, 但也呈现出较强的组织特异性, 其中在性腺中表达量最多, 其次是血淋巴, 表达量最少的组织是外套膜, 前两个组织中cyclin B3基因的表达量分别约是外套膜的92倍和12倍。LSD法多重比较结果显示, 血淋巴与其他组织cyclin B3基因表达差异显著(P<0.05),性腺与其他组织 cyclin B3基因表达差异极显著(P<0.01)。性腺和血淋巴是细胞分裂非常旺盛的部位,该基因在这两种组织中的高表达特点与它在体细胞有丝分裂和生殖细胞减数分裂过程中的重要作用是相一致的。

图4 长牡蛎cyclin B3的基因组结构Fig. 4 Genome structure of Crassostrea gigas cyclin B3 gene
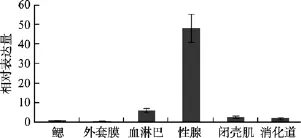
图5 长牡蛎cyclin B3组织特异性表达分析Fig. 5 Tissue-specific expressions of Crassostrea gigas cyclin B3
不同发育阶段的长牡蛎性腺中cyclin B3基因表达特点如图6所示, 该基因的mRNA在细胞中含量随性腺发育程度的提高而提高, 在透明状性腺中的最低(Gn1)而在白色且基本遮盖内脏团的性腺(Gn3)中最高(后者约为前者的 24倍), LSD法多重比较结果显示, Gn3与Gn1和G2 cyclin B3基因表达差异均极显著(P<0.05)这与其在生殖细胞减数分裂中的作用是一致的, 同时也为早期胚胎细胞的有丝分裂储备物质基础。
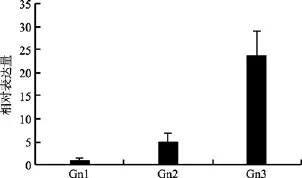
图6 三个不同发育阶段长牡蛎性腺cyclin B3基因表达特点分析Fig. 6 Expressions of Crassostrea gigas cyclin B3 in gonad at three development stages
3 讨论
3.1 cyclin B3基因组结构的进化
通过对多个物种 cyclin B3基因外显子-内含子结构的比较(表2和表3), 发现该基因基因组结构在进化上存在一定规律性:(1)随进化外显子的数目增多, 到哺乳类时稳定在 12个, 蜕皮动物至少肢动物的进化可能另成体系; (2)根据长牡蛎 E6~E8、海胆E7~E9及更高级物种E9~E11可以推断进化过程中海胆及后续高等物种的的 E-6是由于某个事件插入进来的, 长牡蛎的 E-6(即海胆的 E-7)分拆为高等物种的E7和E8, E6插入及分拆的机制和原因值得我们深入探索; (3)进化中一些外显子大小逐渐稳定下来,如E-7、E-8、E-9、E-10、E-11等; 哺乳类的E-5相比于其他物种其大小急剧膨胀, 相应编码的 cyclin B3蛋白也增大很多, 这种进化中外显子膨胀的原因及机制以及对基因功能的影响有待深入研究。(4)内含子进化方面, 其数目变化规律与外显子进化是一致的, 在大小上总体上无脊椎动物比脊椎动物的内含子要小, 脊椎动物随进化内含子有增大的趋势,出现了 1万~2万甚至 7万多个碱基的巨型内含子,如何在短时间内转录如此长的hnRNA并通过剪接获得mRNA以满足一些细胞分裂旺盛的组织对细胞周期蛋白B3的需求以及保持这种巨型hnRNA在细胞中稳定性的机制值得更深一步的研究。(5)昆虫在进化中外显子规律性不是很明显, 外显子数目及大小都与其物种的进化地位不符, 昆虫该基因的基因组结构变化较大, 如埃及斑蚊和致倦库蚊的外显子数有4个而果蝇却只有1个, 且编码的蛋白大小比前两者大很多, 但编码的蛋白大小却相差很大, 产生这种现象的原因及其与节肢动物起源的关系值得我们更进一步的探讨。
所谓初中物理课堂教学的有效方法,实际上就是教师要建立起高效的初中物理课堂。简单地说,就是物理教师在一定的、有限的课堂时间内,能够通过各种方式使得物理教学课程真正、高效地得到推进,使每一堂课都能得到最大限度的发挥,学生真正将知识点牢牢地记在脑海里。而要在初中物理课堂当中实施高效教学,就需要物理教师摒弃古板陈旧的教学方式,通过不断学习具备现代教学理念以及掌握各种高效教学的方式,使学生真正提起对物理的学习积极性,实现学习效率的提升。本文将结合人教版初中物理教材,浅探初中物理教学中的有效方法。
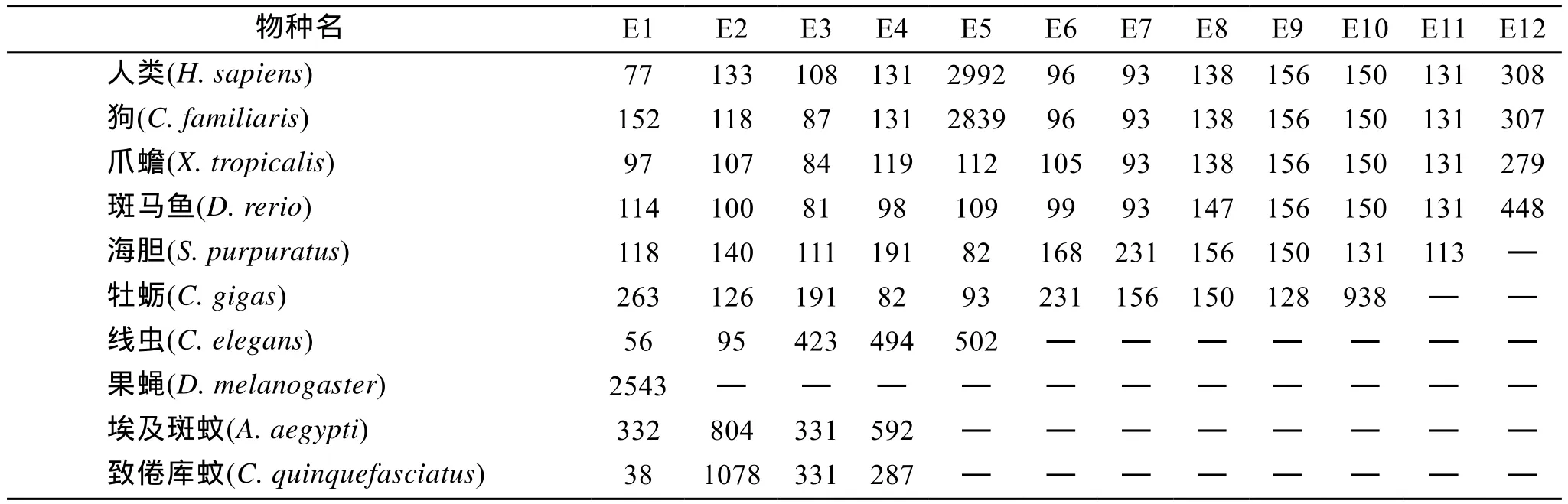
表2 一些物种cyclin B3基因外显子(E)的数目及大小(bp)Tab. 2 The number and size (bp) of exons (E) in cyclin B3 gene in some species

表3 一些物种cyclin B3基因内含子(I)的数目及大小(bp)Tab. 3 The number and size (bp) of introns (I) in cyclin B3 gene in some species
3.2 关于cyclin B3 mRNA的翻译调控和在卵细胞中的储备
cyclin B蛋白作为调节亚基与CDK1(p34CDC2)的结合是活化MPF的必要条件, MPF的活化促使细胞周期从 G2期向 M 期转变; 细胞分裂的完成伴随MPF的活性消失, 这是通过cyclin B的水解实现的[13],因此, 在蛋白水平上cyclin B蛋白在细胞中不会有很高的存量, 满足分裂细胞对cyclin B蛋白的需求主要靠mRNA翻译水平的调控实现的。在贝类[15-16]、 昆虫[17]、鱼类[18]、两栖类[19-20]、哺乳类[21]等动物类群中的研究发现, 多聚腺苷化(polyadenylation)和去腺苷化(deadenylation)是一种普遍的实现翻译调控的机制, 其中 mRNA 3’UTR区的细胞质多聚化元件(CPE)等顺式作用元件起了重要作用, 很多反式作用因子如CPEB、Bruno、Pumilio、Bicoid等参与了翻译调控过程的实现。本研究发现在长牡蛎cyclin B3的3’UTR区有多达10个CPE元件(在中华绒螯蟹中为8个[22], 在日本对虾中为4个[23]), 可见CPE元件在调控cyclin B3蛋白翻译过程的重要作用。在许多多细胞生物中, 受精后4h内细胞转录没有或水平很低, 早期胚胎发育所需的大量 mRNA主要靠卵细胞含有的母源性mRNA (保存在mRNA颗粒中)提供[24],因此在性腺发育过程中必然也会积累大量的 cyclin B3 mRNA以满足早期胚胎发育需求, 本研究中发现长牡蛎cyclin B3 mRNA含量在性腺中含量很高, 也印证了此猜测。
本研究首次在长牡蛎中克隆得到 cyclin B3 cDNA全长和基因组结构, 并对其组织表达特点及在性腺发育中的作用进行了初步探讨, 下一步将通过蛋白水平的研究进一步探讨长牡蛎性腺发育中cyclin B3蛋白的作用机理。
[1]Norbury C, Nurse P. Animal-cell cycles and their control[J]. Annual review of biochemistry, 1992, 61:441-470.
[2]Gautier J, Minshull J, Lohka M, et al. Cyclin is a component of maturation-promoting factor fromXenopus[J].Cell, 1990, 60(3):487-494.
[3]Kishimoto T. Cell-cycle control during meiotic maturation[J]. Current opinion in cell biology, 2003, 15(6):654-663.
[4]Nurse P, Bissett Y. Gene required in G-1 for commitment to cell-cycle and in G-2 for control of mitosis in fission yeast[J]. Nature, 1981, 292(5823):558-560.
[5]Stark G R, Taylor W T. Control of the G(2)/M transition[J]. Molecular biotechnology, 2006, 32(3):227-248.
[6]Nurse P M. Cyclin dependent kinases and cell cycle control[J]. Bioscience reports, 2002, 22(5-6):487-499.
[7]Lew D J, Kornbluth S. Regulatory roles of cyclin dependent kinase phosphorylation in cell cycle control[J].Current opinion in cell biology, 1996, 8(6):795-804.
[8]Katsu Y, Yamashita M, Kajiura H, et al. Behavior of the components of maturation-promoting factor, cdc2 kinase and cyclin-B, during oocyte maturation of goldfish[J]. Developmental biology, 1993, 160(1):99-107.
[9]Borgne A, Meijer L. Sequential dephosphorylation of p34(cdc2) on Thr-14 and Tyr-15 at the prophase/metaphase transition[J]. Journal of biological chemistry,1996, 271(44):27847-27854.
[10]Honda R, Ohba Y, Nagata A, et al. Dephosphorylation of human p34(cdc2) kinase on both Thr-14 and Tyr-15 by human cdc25b phosphatase[J]. Febs letters. 1993,318(3):331-334.
[11]Draetta G. Cdc2 activation:the interplay of cyclin binding and Thr161 phosphorylation[z]. 1993, 3:287-289.
[12]Gautier J, Matsukawa T, Nurse P, et al. Dephosphorylation and activation of Xenopus-p34cdc2 protein-kinase during the cell-cycle[J]. Nature. 1989, 339(6226):626-629.
[13]Glotzer M, Murray A W, Kirschner M W. Cyclin is degraded by the ubiquitin pathway[J]. Nature. 1991,349(6305):132-138.
[14]Ubersax J A, Woodbury E L, Quang P N, et al. Targets of the cyclin-dependent kinase CDK1[J]. Nature. 2003,425(6960):859-864.
[15]Standart N, Dale M. Regulated polyadenylation of clam maternal messenger-RNAsin-vitro[J]. Developmental genetics. 1993, 14(6):492-499.
[16]Walker J, Dale M, Standart N. Unmasking mrna in clam oocytes:role of phosphorylation of a 3' UTR masking element-binding protein at fertilization[J].Developmental biology. 1996, 173(1):292-305.
[17]Salles F J, Lieberfarb M E, Wreden C, et al. Coordinate initiation of Drosophila development by regulated polyadenylation of maternal messenger-RNAs[J]. Science. 1994, 266(5193):1996-1999.
[18]Rosenthal E T, Tansey T R, Ruderman J V. Sequence-specific adenylations and deadenylations accompany changes in the translation of maternal messenger-RNA after fertilization ofspisulaoocytes[J].Journal of molecular biology. 1983, 166(3):309-327.
[19]Fox C A, Sheets M D, Wickens M P. Poly(A) addition during maturation of frog oocytes - distinct nuclear and cytoplasmic activities and regulation by the sequence UUUUUAU[J]. Genes & development. 1989, 3(12b):2151-2162.
[20]Mcgrew L L, Dworkinrastl E, Dworkin M B, et al.Poly(A) elongation duringXenopusoocyte maturation is required for translational recruitment and is mediated by a short sequence element[J]. Genes & development.1989, 3(6):803-815.
[21]Gebauer F, Xu W H, Cooper G M, et al. Translational control by cytoplasmic polyadenylation of c-mos messenger-RNA is necessary for oocyte maturation in the mouse[J]. Embo journal. 1994, 13(23):5712-5720.
[22]Fang J J, Qiu G F. Molecular cloning of cyclin B transcript with an unusually long 3' untranslation region and its expression analysis during oogenesis in the Chinese mitten crab,eriocheir sinensis[J]. Molecular biology reports. 2009, 36(6):1521-1529.
[23]Qiu G F, Yamano K. Three forms of cyclin B transcripts in the ovary of the kuruma prawnmarsupenaeus japonicus:their molecular characterizations and expression profiles during oogenesis[J]. Comparative biochemistry and physiology b-biochemistry & molecular biology. 2005, 141(2):186-195.
[24]Seydoux G. Mechanisms of translational control in early development[J]. Current opinion in genetics &development. 1996, 6(5):555-561.
Molecular cloning and characterization of the key regulator of cell cycle cyclin B3 in Pacific Oyster (Crassostrea gigas),and its role in gonad development
WANG Tong1,2, LI Li1, QUE Hua-yong1, ZHANG Guo-fan1
(1. Institute of Oceanology, Chinese Academy of Sciences, Qingdao 266071, China; 2. Graduate University of the Chinese Academy of Sciences, Beijing 100049, China)
Dec., 25, 2010
Pacific oyster (Crassostrea gigas); cell cycle regulation; cyclin B3; gonad; Real Time PCR
The full length cDNA sequence of cyclin B3 was cloned from Pacific oyster (Crassostrea gigas) for the first time. Cyclin B3 cDNA was 2383 bp in length, containing a 1293bp CDS that encoded a peptide of 430 amino acids with a calculated molecular weight of 47.8 kD. Multiple alignment and converted domain analysis showed that this peptide was a homolog of cyclin B3. The gDNA sequence of cyclin B3 contained 10 exons and 9 introns,which was consistent with the position in evolution ofC. gigas. Expression of cyclin B3 gene was found in all tissues, but also showed a very strong tissue-specific feature; the amount of cyclin B3 in gonad was the highest among tissues, 100 times of mantle, the lowest expression tissue. The mRNA amount of cyclin B3 in gonad increased with the maturation of gonad. The expression implied the important role of cyclin B3 in mitosis, meiosis and early development of embryo.
S917.4 文献标识码:A 文章编号:1000-3096(2011)12-0001-09
2010-12-25;
2011-02-25
国家“863”计划资助项目(2006AA10A401); 国家“973”计划资助项目(2010CB126401); 国家公益性行业(农业)科研专项(3-53)作者简介:王桐(1987-), 男, 山东泰安人, 硕士研究生, 主要从事海洋贝类功能基因研究, 电话:0532-82898726, E-mail:humanexplorer@126.com;阙华勇, 通信作者, 研究员, 电话:0532-82898713, E-mail:hque@qdio.ac.cn
致谢:本研究过程中得到了实验室李娟博士和张琳琳同学在实验技术等方面的诸多帮助, 在此深表感谢!
梁德海)
