条石鲷消化道发育的组织学观察
2011-01-12马道远于道德肖永双刘清华徐世宏肖志忠
马道远, 于道德, 肖永双, 刘清华, 徐世宏, 李 军, 肖志忠
(1. 中国科学院 海洋研究所, 山东 青岛, 266071; 2. 山东省海水养殖研究所, 山东 青岛, 266002)
条石鲷消化道发育的组织学观察
马道远1, 于道德2, 肖永双1, 刘清华1, 徐世宏1, 李 军1, 肖志忠1
(1. 中国科学院 海洋研究所, 山东 青岛, 266071; 2. 山东省海水养殖研究所, 山东 青岛, 266002)
对人工养殖的条石鲷(Oplegnathus fasciatus)仔、幼稚鱼消化道及消化腺的发育过程进行了系统的组织学观察。研究表明:初孵仔鱼 (体长1.66~2.20 mm)的消化道完全处于未分化状态。1日龄仔鱼全长1.83~2.32 mm, 消化道中部开始形成空腔, 为初始的消化道腔。2日龄仔鱼全长2.61~2.98 mm, 小肠与食道打通。3日龄仔鱼全长2.56~2.89 mm, 上下颌开启, 口和肛门与外界开通, 部分仔鱼开口摄食。此时消化道已经分化为口咽腔、食道、胃前体、肠和直肠, 消化器官肝脏和胰腺及鳔原基出现。4日龄仔鱼全长2.73~3.05 mm, 卵黄囊吸收殆尽, 油球残存, 鳔原基进一步增生, 后肠已经出现嗜伊红囊。22日龄, 胃腺开始分化, 至45日龄, 大部分胃腺结构上分化成熟。本研究结果将为优化条石鲷产业化养殖的科学管理技术和其营养学的深入研究提供理论依据和技术资料。
条石鲷(Oplegnathus fasciatus); 消化道; 胃腺; 嗜伊红囊
世界上任何鱼类养殖品种的成功繁殖, 其育苗阶段都被认为是一个重要的时期[1-3], 条石鲷(Oplegnathus fasciatus)也不例外, 虽然其育苗技术难关业已突破, 但是在进行工厂化人工育苗的过程中, 也出现了几个高死亡期, 尤其是在开口阶段以及配饵转化阶段, 这些死亡高峰期严重阻碍了条石鲷商业化养殖。所以有必要首先描述和了解其消化系统的发生, 同时联合仔鱼食物的消化和吸收过程。这样也许能帮助揭示养殖模式中的限制因素, 减少育苗过程中的死亡率, 突破海水鱼类苗种培育瓶颈,如开口和饵料转换等[4]。
条石鲷属鲈形目(Perciformes), 石鲷科(Oplegnathidae), 主要分布于中国黄海、东海、台湾沿海, 日本北海道以南及韩国以南沿海海域, 其肉质极为细致, 口感好, 抗病力强, 是一种具有较高食用价值和观赏价值的优良地方海产鱼类。在中国虽然分布区域较广, 全年皆产, 但始终没有形成明显盛渔期。国外关于条石鲷育苗, 仅有日本和韩国有阶段性进步。作者自驯养条石鲷以来, 成功突破育苗技术难关, 养殖效果良好, 事实说明适合中国南北方沿海养殖, 发展前景乐观广阔。
目前, 关于条石鲷早期生物学研究主要包括延迟初次摄食(饥饿)对仔鱼生长和存活率影响[5]和不同光照周期对条石鲷幼鱼胁迫作用和生长影响[6]。而国内仅见辛俭[7]和常抗美[8]对条石鲷早期发育做了研究, 对条石鲷胚胎和仔稚鱼形态学进行了描述,但是缺乏20日龄后的早期发育形态学观察。而关于其早期发育组织学研究为空白。
因此, 本研究借助于组织切片技术, 描述从孵化到变态完成(也就是苗种生产阶段)条石鲷仔、稚、幼鱼消化系统和消化腺的发生发育过程, 更进一步地了解其形态结构和功能的关联性。同时结合苗种生产过程中死亡高峰期出现时间, 从内部器官发生的形态与功能上寻找到其关键期出现的内在因素,以及相应外源因素的影响, 从而为将来优化其产业养殖的科学管理技术和条石鲷的营养学的深入研究提供理论依据和技术资料。
1 材料与方法
1.1 材料
实验所用条石鲷鱼苗于2007年6月~7月取自薛家岛育苗场, 采用腹部挤压法分别获得成熟的卵子和精液, 人工干法授精获取受精卵(将成熟的卵子挤入5 L塑料圆盆中, 加入适量精液, 摇匀后, 加入少量海水, 放置5~10 min; 加入1~2 L海水, 再放置 10 min, 洗卵)。在 22℃±0.5℃, 盐度为 30的条件下, 卵子授精后经过31 h仔鱼孵出。孵出后的鱼苗培育条件:水温22℃±0.5℃, 海水盐度30, pH为8.2左右, 日换水量为1/2, 不间断充气。从3日龄到25日龄, 投喂褶皱臂尾轮虫(Branchionou plicatilis),密度为 2~15个/mL, 根据鱼苗摄食情况进行调整;18日龄到 35日龄, 增喂卤虫(Artemiaspp.)无节幼体。密度为1~5个/mL, 轮虫和卤虫无节幼体(开口后)投喂前分别用鱼油(康克 A, 青岛森淼公司)进行强化 8~12 h。从 28日龄开始进行鱼糜驯化, 经过7d可以完全驯化到鱼糜。在投喂轮虫同时添加以小球藻为主(Chlorellaspp.)单胞藻液, 进行绿水养殖方式。
1.2 实验方法
育苗孵化后, 1~10日龄每天取样1次, 11~30日龄每2 d或3 d取样1次, 31~46日龄, 每4 d或5 d取样1次, 取样的总样本数为60尾。MS-222麻醉, 30尾用于测量生长; 另30尾样品用Bouin氏液室温固定24 h, 50%乙醇洗脱, 70%乙醇保存备用。常规梯度乙醇脱水, 二甲苯透明, 石蜡包埋, 分别进行横、纵和水平 3个方向的连续切片, 切片厚度 5~12 μm,H.E.染色, 中性树胶封片, Nikon显微镜观察和照相。
2 结果
2.1 口咽腔的形成
3日龄(2.56~2.89 mm)条石鲷仔鱼消化道与外界完全接通, 口器形成, 开始摄食轮虫, 口咽腔由单层扁平上皮覆盖, 此时无黏膜下层和肌肉层发生,后部可见4个初始鳃弓(图1-1)。随着仔鱼的进一步发育, 5日龄, 咽腔后部出现一薄层环形肌肉层, 口咽腔仍然为单层扁平上皮覆盖。10日龄, 黏膜层增为复层扁平上皮, 黏膜下层的结缔组织下方分化出纵行肌肉层, 咽腔后部可见散布的杯状细胞和味蕾(图1-2), 此时第二、第三鳃弓的上皮已经增殖分化为原始鳃丝, 其上可见原始的脉管系统和少量的血细胞。12日龄, 上下颌齿从口器中凸显出来, 初始鳃弓上的原始骨细胞增多, 同时血细胞分布逐渐丰富,预示发育中的鳃小片。16日龄, 咽齿出现(图1-3)。25日龄, 咽腔分布的黏液细胞和味蕾进一步增多,鳃耙出现(图1-4, 图1-5, 图1-6)。

图1 条石鲷口咽腔发育过程Fig. 1 The ontogeny of buccopharyngeal cavity of Oplegnathus fasciatus
2.2 食道的形成
3日龄(2.56~2.89 mm)仔鱼, 食道与消化道打通,由复层柱状上皮构成, 此时无肌肉层和杯状细胞发生(图2-1)。4日龄仔鱼, 食道的黏膜层开始分化出微小的纵行褶皱, 此时出现环形肌肉层(图2-2)。 10日龄, 食道前段分布少量杯状细胞。
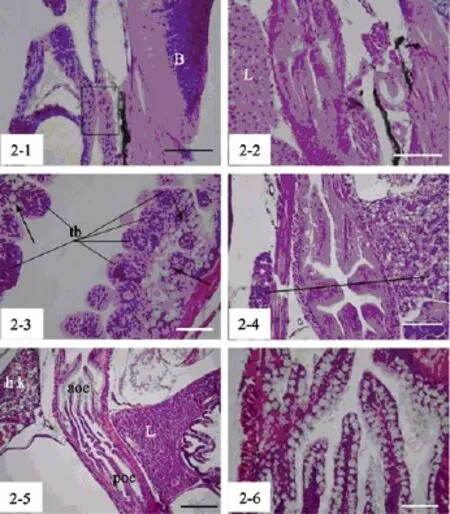
图2 条石鲷食道发育过程Fig. 2 The ontogeny of esophagus in Oplegnathus fasciatus
15日龄, 随着食道味蕾的出现和杯状细胞的增多, 环行肌肉层进一步增厚(图2-3)。此时, 随纵行皱褶向食道后段延伸, 食道的复层扁平上皮在接近胃前体处逐渐转变为单层立方上皮或矮柱状上皮, 黏液细胞消失, 环行肌肉层过渡为平滑肌, 但是肌肉层厚度变化不大(图2-4)。此后一直到胃腺大量出现前(28~30日龄), 食道无明显分段的组织学结构, 仅仅是黏液细胞数量增多, 皱褶的加深及肌肉层的增厚。在28~30日龄, 随着胃体向消化腔纵深的拉长和延伸以及胃腺的大量出现, 食道逐渐开始延长, 并在组织学结构上明显分为两部分:杯状细胞和味蕾密集分布的前段以及杯状细胞稀少, 无味蕾的后段(图2-5, 图2-6)。
2.3 胃的形成
3日龄仔鱼, 食道后段膨大处形成胃原基, 黏膜层由单层矮柱状上皮细胞构成, 细胞核中位, 外部直接由食道延续下来的很薄的肌肉层包裹, 无结缔组织发生, 其腹下方为正在吸收中的卵黄囊(图3-1)。6~7日龄, 胃原基近肠端出现纵形褶皱, 黏膜层单层矮柱状细胞转化为柱状上皮, 核中下位, 出现结缔组织层和浆膜层, 同时肌肉层有所增厚(图3-2)。14~16日龄, 胃原基出现纹状缘, 柱状上皮进一步拉长, 转变为高柱状上皮, 细胞核以下位为主, 可见零星分布杯状细胞。胃肠连接处的肌肉层骤然增厚, 为分化中的幽门括约肌(图3-3)。
22日龄, 胃贲门部出现微小紧缢, 其肌肉层的加厚(即贲门括约肌)与食道分界明显, 使胃在形态上成为一个独立的器官。胃黏膜层的柱状上皮进一步增高, 胃幽门部的上皮褶皱明显增高, 肌肉层亦加厚。同时在胃底部出现少量由实心的细胞团组成的初始胃腺。
28~30日龄, 整个胃体形态开始卷曲, 胃体明显分化为3部分:胃贲门部、胃底部和胃幽门部。胃底部的黏膜下层开始大量出现胃腺原基, 大部分胃腺原基仍然为实心的细胞团, 少量胃腺原基分化成管腺状结构。肌肉层较薄, 在幽门部括约肌增厚明显(图3-4)。
45日龄, 大部分胃腺分化成熟, 除少量分布在贲门胃部分外, 大部分集中于胃底部, 而幽门部完全缺乏胃腺。胃体肌肉层开始增厚, 尤其是幽门胃部分, 胃腺消失处的肌肉层十分发达, 同时在上皮分布一定数量的杯状细胞, 此时胃体已经具有幼鱼和成鱼的J形结构(图3-5)。
2.4 肠的形成
初孵仔鱼肠道十分简单, 尚未分化, 直管状, 后端具腔。2日龄仔鱼肠与食道相通。3日龄(2.56~2.89 mm)仔鱼开口摄食, 肠壁上皮由单层柱状细胞组成(图4-1)。4日龄仔鱼, 肠道分化为前肠和后肠, 后肠上皮细胞胞质内出现嗜伊红颗粒(图4-2)。7日龄仔鱼小肠中部形成微小紧缢, 此后形成肠瓣将小肠分化为前肠和中肠, 后肠形成纹状缘。此时小肠仅形成低矮平滑的褶皱。10日龄, 仔鱼肠道盘曲, 形成肠圈。前中肠上皮细胞胞质内的空泡样结构(图4-3)。
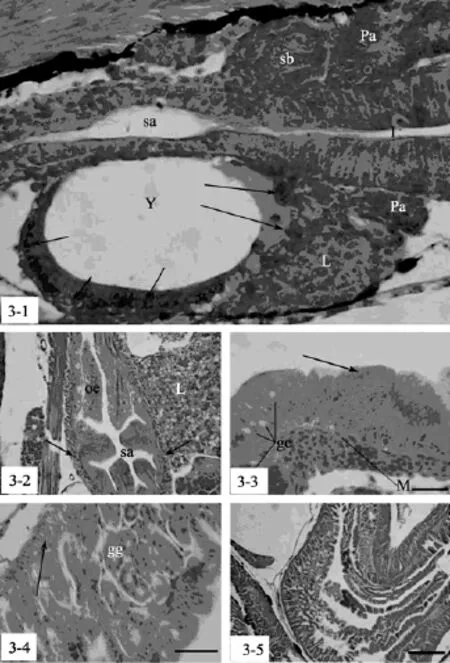
图3 条石鲷胃的发育过程Fig. 3 The ontogeny of stomach in Oplegnathus fasciatus
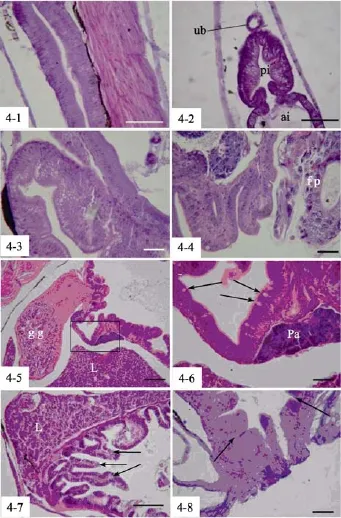
图4 条石鲷肠道发育过程Fig. 4 The ontogeny of intestine in Oplegnathus fasciatus
17 日龄, 肠柱状上皮及褶皱明显增高, 细胞顶端稍平整, 前肠和中肠开始形成纹状缘。肠道上皮可见少量杯状细胞的存在(图4-4)。26 日龄, 首先在接近幽门部的前肠附近形成囊状的凹陷, 为分化中的幽门盲囊(图4-5)。随后在肠曲内侧, 与弥散的胰脏临近的位置亦发生幽门盲囊。幽门盲囊的组织学结构与小肠类似, 其上皮分布有杯状细胞, 只是在发生初期不具有上皮褶皱(图4-6)。
嗜伊红颗粒和空泡样结构一直持续到 28~30日龄, 胃腺大量形成后, 虽然个别个体在胃腺完全成熟后(45日龄), 仍然在中前肠存在空泡样结构。此后,随着鱼体发生的进行, 肠道的杯状细胞增加, 黏膜褶皱增高, 结缔组织增厚, 已初具成鱼的特征(图4-7)。4 日龄, 后肠的末端由立方上皮构成的直肠与后肠的区别明显, 缺乏嗜伊红颗粒。而且在整个实验的过程中, 直肠既无嗜伊红颗粒和空泡样结构发生,也一直缺乏杯状细胞的分布(图4-8)。
2.5 肝脏和胰脏的形成
2日龄仔鱼肝胰脏原基出现, 为微嗜碱性的实心的细胞团。3日龄仔鱼, 肝胰脏分化。4日龄, 仔鱼开口摄食, 肝脏出现大量的空泡样结构, 预示着对营养物质(脂肪)的储存(图5-1)。10日龄,肝脏分叶,15 日龄仔鱼, 肝细胞呈索状排列, 空泡结构逐渐增多, 肝细胞的大部分细胞质被空泡结构占据, 细胞核被挤到一个周边的位置, 肝索窦间散布少量红细胞。此后, 随着仔鱼的生长, 肝门脉系统的进一步完善, 成熟, 内充斥大量红细胞(30日龄, 图5-2)。3日龄仔鱼, 肝胰脏分化, 胰脏实质已经出现大量酶原颗粒。4日龄仔鱼, 嗜碱性较强的胰脏, 开始在消化腔内分散分布, 胰脏主体分布于胃原基和小肠的背腹面之间, 其他分散的胰脏组织分散在脾脏、胆囊以及后肠等附近(图5-3)。10 日龄, 胰脏中出现胰岛。胰脏主要以腺泡结构存在, 内含大量的酶原颗粒具有强嗜酸性(图5-4)。胰脏的腺泡细胞具有强嗜碱性的细胞质, 同时少量胰脏组织侵入肝脏组织, 形成肝胰脏。
3 讨论
类似于大多数暖温性硬骨鱼类, 条石鲷消化道最主要的形态学变化也是发生在开口前, 即 1~3日龄。在这3 d内, 仔鱼的消化系统迅速分化。口腔和肛门开通, 肝脏和胰脏从组织学上区分开来, 同时胰脏组织出现酶原颗粒, 预示其能进行外源营养物质的消化和吸收。这与一些温水性海水种类类似, 如牙鲆(Paralichthys olivaceus)[9]、真鲷(Pagrus major)[10]等。

图5 条石鲷消化腺发育过程Fig. 5 The ontogeny of digestive glands in Oplegnathus fasciatus
一般来说, 硬骨鱼类颌齿(包括上颌齿和下颌齿)的出现(发生)和分化要早于咽齿。正如本实验观察到的结果, 类似的其他报道还有夏鲆(Paralichthys dentatus)[11], 三长棘赤鲷(Pagrus auriga)[12], 绯小鲷(Pagellus erythrinus)[13]。从牙齿功能性的角度来看,牙齿的出现说明鱼类摄食种类和其自身营养模式的转变[11]。这正符合了海水鱼类从开口到最终变态结束变为成体其饵料组成的变化趋势, 经典的饵料流程变化模式为:轮虫/贝类幼体—卤虫无节幼体—卤虫成体—桡足类—鱼糜, 最终为配合饵料。
条石鲷的颌齿出现在12日龄, 咽齿出现在16日龄, 但 30日龄仍然埋在口咽腔上皮内, 并没有完全执行其功能, 说明牙齿功能尚不完善; 此时的胃腺刚出现, 亦没有开始执行胃腺的功能。与其他鲷科鱼类比较, 条石鲷的牙齿的出现要晚许多, 如三长棘赤鲷的上下颌齿出现于 3~5日龄, 而咽齿出现于 6日龄; 但是却早于夏鲆[11]等鲆鲽类。所有鱼类的牙齿出现一般都是早于胃腺, 而且其功能的完善化都发生在胃腺形成阶段, 这也许能很好的说明, 如果胃腺的出现是饵料转换的必要条件的话, 牙齿的完善发育则是饵料转换的不可或缺的前提条件; 这是因为饵料的硬度和在水中的保持形状的特性永远也达不到活饵料的生物学特性。
实际上, 这些发育时序的不同主要是受遗传因素的影响, 而不是其他的外界条件, 像温度、盐度等环境因素。换句话说, 外界的影响因子对早期发育的影响不会超出科的范畴, 更具体地说, 就是在种属的适合的外界条件内, 可以纵向地影响同种或同属的发育速度。如本实验中的孵化温度是 22~23℃,比三长棘赤鲷 (19~22℃)高一些, 但是, 条石鲷的早期发育要比三长棘赤鲷晚许多, 不仅仅限于牙齿的发育, 同时也包括胃腺和幽门盲囊等其他重要的消化器官[14]。
关于胃腺发育的报道有很多, 而且一般认为,胃腺的出现预示着胃功能的成熟, 主要就是指胃腺分泌的胃蛋白酶的活性, 使蛋白消化的机制从胞饮作用以及细胞内消化[15-18]转化为细胞外消化和膜质转运。
虽然有的学者认为胰腺酶不能完全消化蛋白[19],但是Zambonino等[20]在1994年的报道却指出:胃腺的缺乏并不影响蛋白的消化, 海鲈的胰腺和肠道已经分泌了足够的酶来水解和消化蛋白质。这很有可能是无胃鱼类和有胃鱼类在面对蛋白消化(长期的饮食习惯)出现的适应性进化所至。具体来说, 无胃鱼,除了没有胃腺(胃蛋白酶外), 其胰腺和肠道的蛋白酶对蛋白的消化能力也很弱。而有胃鱼类则完全不同, 即使在没有胃蛋白酶的情况下, 其胰腺和肠道的蛋白酶能够很好地消化蛋白质。从这一点上来看,这完全是两种鱼类在长期选择食物种类的基础上进化的结果所至。并且许多营养学的实验已经证明:在胃腺出现前, 有些海水鱼类能成功地进行饵料转换,例如:海鲈(Dicentrarchus labrax)等[21-22]。甚至可以在开口时就进行饵料转化, 在这一点上与淡水鱼很像。
从另一个方面来说, 胃腺的出现也并不代表它们具有功能。例如:欧鳎(Solea solea), 胃腺首先出现在22日龄[23], 但是在200日龄才检测到蛋白酶的活性[24], 这种典型的功能滞后也很可能和其短期内饮食史的变化相关, 这里涉及到进化的层面, 超出本文讨论的范围, 不再赘述。类似的报道也见于其他硬骨鱼类, 如大菱鲆(Scophthalmus maximus)[25]和短须石首(Umbrina cirrosa)[26]等。因此, 从功能学的角度来看, 应该把蛋白酶的活性的出现作为稚鱼向幼鱼转化的标志, 而不是胃腺或幽门盲囊[4,10-11,27]。
本研究中, 条石鲷仔鱼胃腺最早出现于22日龄,与其他鲷科鱼类相比要晚许多, 仅仅早于鲷科中的大西洋王鲷(Sparus auratus)[28](胃腺出现在 60日龄左右)。
幽门盲囊的数量和发生时序因种而异, 而且幽门盲囊以及胃腺的出现一般被指定为稚鱼期向幼鱼期转化的标志。但是, 关于幽门盲囊的具体功能仍在讨论中:目前的研究表明其功能主要有两个, 分别是⑴ 增加消化道营养吸收的表面积[29]; (2)具有渗透压调节功能[30]。 条石鲷幽门盲囊首先出现在24~26日龄, 稍晚于胃腺的出现, 这与一般硬骨鱼类胃腺和幽门盲囊的发育模式相同[4,28]。但也有相反的报道,如欧鲈(Dicentrarchus labrax)[31]和杂交鲆[32]等。
作为养殖业的新品种, 在条石鲷的育苗过程中也出现了几个死亡高峰期, 也就是养殖临界点。第一个发生在开口摄食阶段, 原因是口径的规格小, 只适合摄食小型轮虫, 类似的报道也见于夏鲆, 虽然后者是由于颌骨的发育畸形所致。第二个死亡高峰发生在 12日龄左右, 可能与其鳔不充气相关, 如在其他硬骨鱼类中发现的情况[33-36]。最后, 就是条石鲷在25日龄开始出现的自残现象, 一直持续到幼鱼初期, 除去自身遗传的自残天性外, 这主要是由于鱼苗体长以及口裂的差异生长以及饵料的匮乏所导致的现象。而且, 由于鳔不充气而导致的仔鱼脊椎畸形等, 如脊椎前屈症[36], 降低仔鱼的游泳能力导致同样能增大被残食的几率, 结构导致死亡率升高。
[1]Calzada A, Medina A, Canales M L G. Fine structure of the intestine development in cultured sea bream larvae[J].Journal of Fish Biology, 1998, 53(2):340-365.
[2]Dhert P, Divanach P, Kentouri M, et al. Rearing techniques of difficult marine fish larvae[J].World Aquaculture, 1998, 29(1):48-55.
[3]Cataldi E, Albano C, Boglione C, et al.Acipenser naccarii:fine structure of the alimentary canal with references to its ontogenesis[J].Journal of Applied Ichthyology, 2002, 18:329-337.
[4]Hamlin H J, Herbing I H, Kling L J. Histological and morphological evaluations of the digestive tract and associated organs of haddock throughout post-hatching ontogeny[J].Journal of Fish Biology, 2000, 57(3):716-732.
[5]Shan X, Quan H, Dou S. Effects of delayed first feeding on growth and survival of rock breamOplegnathus fasciatuslarvae[J].Aquaculture, 2008, 277(1-2):14-23.
[6]Biswas A K, Seoka M, Ueno K, et al. Growth performance and physiological responses in striped knifejaw,Oplegnathus fasciatus, held under different photoperiods[J].Aquaculture, 2008, 279(1-4):42-46.
[7]辛俭, 薛利建, 毛国民. 条石鲷的胚胎发育观察[J].浙江海洋学院学报(自然科学版), 2005, 24(1):31-36.
[8]常抗美, 毛建平, 吴剑锋. 条石鲷胚胎及仔稚鱼的发育[J].上海水产大学学报, 2005, 14(4):401-405.
[9]张孝威, 何桂芬, 沙学绅. 牙鲆和条鳎卵子及仔、稚鱼的形态观察[J].海洋与湖沼, 1965, 7(2):158-174.
[10]Sarasquete M C, Polo A, Yufera M. Histology and histochemistry of the development of the digestive system of larval gilthead seabream,Sparus aurataL[J].Aquaculture, 1995, 130(1):79-92.
[11]Bisbal G A, Bengtson D A. Development of the digestive tract in larval summer flounder[J].Journal of Fish Biology,1995, 47(2):277-291.
[12]Sanchez-Amaya M I, Ortiz-Delgado J B, Garcia-Lopez A,et al. Larval ontogeny of redbanded seabreamPagrus aurigaValenciennes, 1843 with special reference to the digestive system. A histological and histochemical approach[J].Aquaculture, 2007, 263(1-4):259-279.
[13]Micale V, Garaffo M, Genovese L, et al. The ontogeny of the alimentary tract during larval development in common pandoraPagellus erythrinusL[J].Aquaculture, 2006,251(2-4):354-365.
[14]Falk-Petersen I B. Comparative organ differentiation during early life stages of marine fish[J].Fish & Shellfish Immunology, 2005, 19(5):397-412.
[15]Watanabe Y. Morphological and functional changes in rectal epithelium cells of pond smelt during postembryonic development[J].Bulletin of the Japanese Society of Scientific Fishery, 1984, 50:805-814.
[16]Walford J, Lam T J. Development of digestive tract and proteolytic enzyme activity in seabass (Lates calcarifer)larvae and juveniles[J].Aquaculture, 1993, 109(2):187-205.
[17]Zambonino Infante J L, Cahu C L. Ontogeny of the gastrointestinal tract of marine fish larvae[J].Comparative Biochemistry and Physiology Part C:Toxicology &Pharmacology, 2001, 130(4):477-487.
[18]Mai K, Yu H, Ma H, et al. A histological study on the development of the digestive system ofPseudosciaena crocealarvae and juveniles[J].Journal of Fish Biology,2005, 67(4):1 094-1 106.
[19]Jany K O. Studies on the digestive enzymes of the stomachless bony fish,Carassius auratus[J].Comparative Biochemistry and Physiology, 1976, 536:31-38.
[20]Zambonino Infante J L, Cahu C L. Influence of diet on pepsin and some pancreatic enzymes in sea bass(Dicentrarchus labrax) larvae[J].Comparative Biochemistry and Physiology Part A:Physiology, 1994, 109(2):209-212.
[21]Gatesoupe F J. Weaning of sole,Solea solea, before metamorphosis, achieved with high growth and survival rates[J].Aquaculture, 1983, 32(3-4):401-404.
[22]Cahu C L, Infante J L Z, Barbosa V R. Effect of dietary phospholipid level and phospholipid:neutral lipid value on the development of sea bass (Dicentrarchus labrax) larvae fed a compound diet[J].British Journal of Nutrition, 2003,90(1):21-28.
[23]Boulhic M, Gabaudan J. Histological study of the organogenesis of the digestive system and swim bladder of the Dover sole,Solea solea(Linnaeus 1758) [J].Aquaculture, 1992, 102(4):373-396.
[24]Clark J, Murray K R, Stark J R. Protease development in Dover sole [Solea solea(L.)][J].Aquaculture, 1986,53(3-4):253-262.
[25]Segner H, Storch V, Reinecke M, et al. The development of functional digestive and metabolic organs in turbot,Scophthalmus maximus[J].Marine Biology, 1994, 119(3):471-486.
[26]Zaiss M M, Papadakis I E, Maingot E, et al. Ontogeny of the digestive tract in shi drum (Umbrina cirrosaL.) reared using the mesocosm larval rearing system[J].Aquaculture,2006, 260(1-4):357-368.
[27]Govoni J J, Boehlert G W, Watanabe Y. The physiology of digestion in fish larvae[J].Environmental Biology of Fishes, 1986, 16:59-77.
[28]Elbal M T, Garcia Hernandez M P, Lozano M T, et al.Development of the digestive tract of gilthead sea bream(Sparus aurataL.). Light and electron microscopic studies[J].Aquaculture, 2004, 234(1-4):215-238.
[29]Buddington R K, Diamond J M. Pyloric ceca of fish:a“new” absorptive organ[J].American Journal of Physiology, 1987, 252(1):65-76.
[30]Veillette P A, White R J, Specker J L, et al.Osmoregulatory physiology of pyloric ceca:regulated and adaptive changes in chinook salmon[J].Journal of Experimental Zoology, 2005, 303A(7):608-613.
[31]García H M P, Lozano M T, Elbal M T, et al. Development of the digestive tract of sea bass (Dicentrarchus labraxL).Light and electron microscopic studies[J].Anatomy and Embryology, 2001, 204(1):39-57.
[32]Yu D, Xiao Z, Liu Q, et al. Ontogeny of gastrointestinal tract in hybrid flounder jasum,Paralichthys olivaceus×P.dentatus[J].Journal of the World Aquaculture Society,2010, 41(3):344-357.
[33]Chatain B. La vessie natatoire chezDicentrarchus labraxetSparus auratus.The swimbladder inDicentrarchus labraxandSparus auratus. II. Influence of development anomalies on larval growth :II. Influence des anomalies de developpement sur la croissance de la larve[J].Aquaculture, 1987, 65(2):175-181.
[34]Chatain B. Abnormal swimbladder development and lordosis in sea bass (Dicentrarchus labrax) and sea bream(Sparus auratus) [J].Aquaculture, 1994, 119(4):371-379.
[35]Chatain B, Dewavrin G. Influence des anomalies de developpement de la vessie natatoire sur la mortalite deDicentrarchus labraxau cours du sevrage. The effects of abnormalities in the development of the swim bladder on the mortality ofDicentrarchus labraxduring weaning[J].Aquaculture, 1989, 78(1):55-61.
[36]Bein R, Ribi G. Effects of larval density and salinity on the development of perch larvae (Perca fluviatilisL.) [J].Aquatic Sciences, 1994, 56(2):97-105.
Histological study of the ontogeny of the digestive tract inOplegnathus fasciatus
MA Dao-yuan1, YU Dao-de2, XIAO Yong-shuang1, LIU Qing-hua1, XU Shi-hong1,LI Jun1, XIAO Zhi-zhong1
(1. Institute of Oceanology, Chinese Academy of Sciences, Qingdao 266071, China; 2. Mariculture Institute of Shandong Province, Qingdao 266002 , China)
May, 26, 2010
Oplegnathus fasciatus; digestive tract; gastric gland; acidophilic supranuclear vesicles
Under artificial culture conditions, the developments of the digestive system and its associated glands were examined histologically inOplegnathus fasciatusfrom the first day until the 45th day post hatching (dph).The digestive tube of the first hatching larva was undifferentiated and straight. On the 1st dph, the rudimentary digestive lumen formed as the larve developed. On the second dph (TL, 2.61~2.98 mm), the intestine began to connected with the oesophagus. On the third dph (TL, 2.56~2.89 mm), the upper and lower jaw moved with the mouth and anus opening, indicated the first external feeding. At this time, the digestive tract, consisting of buccopharynx, oesophagus, stomach anlage, intestine and rectum, and the digestive glands, including liver and pancreas, being accompanied by the gas bladder anlage, formed. On the 4th dph (TL, 2.73~3.05 mm), the yolk sac was almost completely absorbed, with residual oil globule, and the acidophilic supranuclear vesicles were seen in the rectum. On the 22 dph, the the gastric gland began to differentiate and was not functional until the 45th dph.
Q954.6 文献标识码:A 文章编号:1000-3096(2011)12-0028-08
2010-05-26;
2010-06-20
国家农业科技成果转化资金项目(05EFN2166000453); 中国科学院创新前沿项目(KSCX2-YW-N-47-08); 青岛市科技发展计划项目(05-1-HY-79)
马道远(1964-), 男, 山东青岛人, 主要从事海洋鱼类的繁育及相关生物学研究, 电话:0532-82898717, E-mail:madaoyuan1@163.com; 肖志忠, 通信作者, 电话:0532-82898729,E-mail:xzz@qdio.ac.cn
谭雪静)
