关于医学生学习有机化学的思考
2011-01-06刘承蔚延君丽
刘承蔚,延君丽
(成都大学化学生化教研室,四川 成都 610015)
关于医学生学习有机化学的思考
刘承蔚,延君丽
(成都大学化学生化教研室,四川 成都 610015)
医学院校学生学习有机化学的问题,历来为教师和学生困惑,有机化学学习任务重,所安排的课时少,为更好的处理这个问题,本文作者运用电子效应和空间效应解释了烯烃的加成反应活性,苯环取代基的定位效应,不同醇与水的反应活性顺序,有利于学生更快掌握有机化学的学习规律。
有机化学;电子效应;空间效应
有机化学是医学生的一门基础课程,该课程学习内容多,而学时少,多数学生对有机化学中数量巨大、种类繁多的有机化合物及复杂、多样的有机反应感到不知所措,无从下手[1]。在对各类有机化合物的性质的解释及对各类有机反应活性、反应取向、反应机理等化学性质的解释和规律性总结中,正确运用电子效应和空间效应的影响,可以简单明了解释有机化学反应的规律性,有利于学生对有机化学性质的掌握。本文运用电子效应和空间效应解释了烯烃的加成反应活性,苯环取代基的定位效应,不同醇与水的反应活性顺序。
有机化学的学习是以化学结构为理论核心的,要学好有机化学就必须掌握结构与性质之间的辩证关系。有机分子可以看成是由功能不同而又相互联系的两部分构成:一是反应中心,它是分子中最活跃的部分,化学反应多发生于此处;二是分子母体或取代基,它是反应中心之外的部分,它通过电子效应(诱导、共轭)和立体效应影响分子的反应性[2]。
1 电子效应的含义
电子效应包括诱导效应、共轭效应和超共轭效应,是三种效应的综合结果。
1.1 诱导效应(Ⅰ):在多电子分子中,一个键的极性将影响到分子中的其它部分,使分子中的电子云分布发生改变,从而影响到分子的性质,见图1:
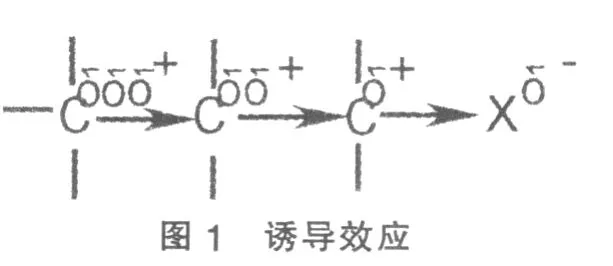
这种由成键原子电负性不同使成键电子对偏向一方引起键的极性改变,并通过静电引力沿分子链由近及远依次传递,致使分子的电子云密度分布发生改变的现象称诱导效应。诱导效应是由邻键的极化而引起某个键的极化,它是近距离作用。
诱导效应有吸电子诱导效应(-I)和给电子诱导效应(+I)。与氢原子相比,绝大多数取代基是吸电子的,只是某些带负电荷的基团是给电子。烷基一般被认为也是给电子的,见图2:

-I效应:-X、-OR、-NO2、-C=C、
+I效应:-CH3、-CH2CH3、-CH(CH3)2、-C(CH3)3-R(一般为饱和烃基)
1.2 共轭效应(C):由三个或三个以上P轨道平行重叠形成了共轭π键,那么由共轭π键形成而带来的电子云的离域效应叫共轭效应。
在1.3一丁二烯中CH2=CH—CH=CH2,每个碳原子均以sp2杂化,杂化轨道与相邻碳原子和氢原子形成三个σ键,每个碳原子上还有一个未杂化的P轨道,P轨道上有一个单电子,P轨道间相互平行并与分子所在的平面垂直,见图3、图4:
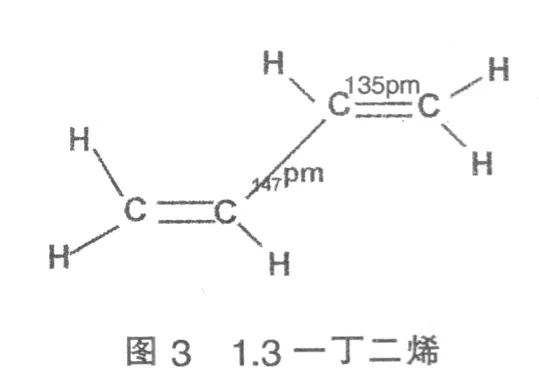
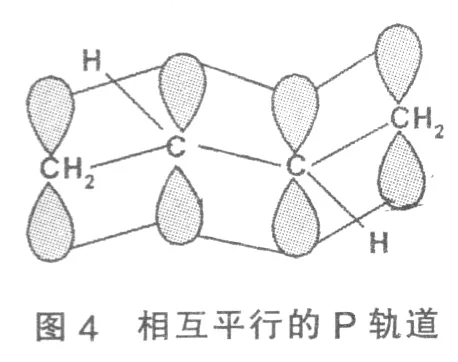
不仅在C1和C2,C3和C4之间发生了P轨道的相互重叠,而且在C2和C3之间的P轨道也发生了部分重叠。也就是说,分子中的电子云并不是像结构式所示定域在C1一C2和C3一C4之间,而是扩展到了整个分子中,发生了键的离域,这就是共轭效应。
共轭效应可使电子云分布均匀化,键长平均化,根据静电学,共轭体系使体系的能量降低,稳定性增强[3]。
共轭效应是由共轭体系内取代基引起的共轭体系的电子云密度的变化,因而对分子的偶极矩产生影响。共轭效应有吸电子共轭效应(-C)和给电子共轭效应(+C)。一般负离子,或与共轭体系直接相连的原子上有孤对电子的取代基是给电子基;与共轭体系直接相连的原子以不饱和键与电负性大的原子相连的取代基为吸电子基。如:-NH2,-OH,-SH,-X是给电子基,-NO2,-CN,-COOH是吸电子基。
1.3 超共轭效应:由碳氢σ键相邻的π电子或P轨道部分重叠而形成的。σ键与P轨道的相互重叠而引起的电子云离域效应叫超共轭效应[4]。
因为只有碳原子和极小的氢原子形成σ键,对电子云的屏蔽效应很小,电子对受核的吸引到一定距离时又受到同一个碳原子上其它几个电子对排斥,如果相邻有π键和P轨道,这时σ键电子就偏离原来的轨道,而趋向于π键或P轨道,使σ轨道与π键或P轨道呈现部分重叠,其结果是使共轭的范围扩大(或电荷分散),体系稳定[5]。超共轭效应的大小与π键或P轨道相邻碳上的c—Hσ键多少有关,c-Hσ键越多,超共轭效应愈大。超共轭效应属于共轭效应,都是由电子云的离域引起的。但由于P轨道与σ轨道不平行,重叠程度小,故比共轭效应小的多,超共轭效应的方向电子由σ轨道到P轨道,相当于烷基有一个给电子效应。
形成超共轭体系必须具备两个条件,一是有π键或P轨道,二是有相邻碳氢的σ键电子,两者缺一不可。超共轭效应一般是给电子的,超共轭效应比共轭效应弱得多。
2 电子效应的应用
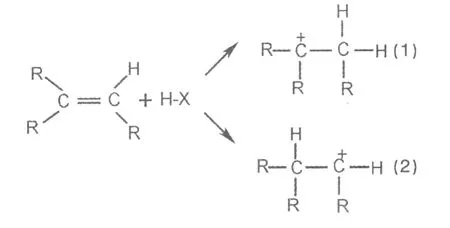
2.1 马氏规则的解释:马氏规则,不对称烯烃与不对称试剂加成时,试剂中带正电荷的部分总是加在含氢较多的双键碳上,带负电荷的部分则加到含氢较少的双键碳上。
不对称烯烃在发生亲电加成反应时具有区域选择性.所谓区域选择性,是指当反应的取向有可能产生几个异构体时,只生成或主要生成一个产物的反应,利用马氏规则可以正确地预测许多反应的主产物,同时对于初步接触有机化学的学生,马氏规则也起到了很重要的指导作用,反应式如下:

上述反应中,由于乙基碳原子是sp3杂化,而双键碳原子是sp2杂化,在杂化轨道理论中有一个重要的结论,即电负性:Psp3 所以当乙基与双键碳原子直接相连接时,乙基表现出向双键碳原子供电子的性质,结果使与乙基直接相连的双键碳原子(即含氢较少的碳原子)显有正电荷,另一个双键碳原子(即含氢较多的碳原子)显有负电荷.加成反应时,HBr离解出来的H+首先加到显有负电荷的双键碳原子上,生成(CH3)CH+,然后Br一加到含氢较少的双键碳原子上,生成主产物2一溴丁烷[6]。 马氏规则的解释:烯烃与不对称试剂加成时,可生成下面两种碳正离子中间体(1)和(2): 研究证明,带正电荷的碳原子连有的烷基越多,效应越强,使正电荷越分散,体系能力越低,碳正离子越稳定。 故碳正离子的稳定性顺序:叔碳正离子>仲碳正离子>伯碳正离子>甲基碳正离子即 所以(2)碳正离子中间体更稳定,然后X-离子加到(2)上,生成主产物[7]。 烯烃与卤化氢等亲电试剂进行的加成反应是离子型亲电加成反应,对烯烃的亲电加成反应机理进行研究后会发现,烯烃及亲电试剂的极性对反应取向有决定性的影响,而烯烃及亲电试剂的极性又是由电子效应来决定的。因此,从实质上讲,马氏规则的产物是反应物和亲电试剂在电子效应作用下的必然结果。即:不对称烯烃与不对称试剂进行亲电加成反应时,试剂的负性部分加到带正电荷(或部分正电荷)的双键碳上,正性部分加到带负电荷(或部分负电荷)的双键碳上[8]。 2.2 苯环取代基的定位效应:取代基对苯环的诱导效应,导致苯环上的π键与带取代基的碳原子电子云发生移动,使一些电子云密度相对较大的位置上活性较大。亲电取代反应主要发生在这些部位上,即为新导入的取代基确定了位置。苯环上原有取代基也叫定位基,如-OH是吸电子基,电子流向羟基一方。同时苯环中大π键与-OH中氧原子孤对电子的P轨道形成P-π共轭,电子流向苯环一方。由于共轭效应的强度比诱导效应大,总的结果是苯环的电子云密度增高,在邻对位尤为明显,使苯环活化,取代反应比苯易于进行。 常见的邻对位定位基有:-NH2、-OH、-NHCOCH3、CH3(-R)、-X。一般邻对位定位基与苯环直接相连的原子具有未共用电子对(如0、N、卤素)或烷基。同样,也可解释如-NO2,这类间位定位基一般使苯环钝化,取代反应比苯难于进行。取代反应主要发生在间位上。常见的间位定位基:-NO2、-CN、-SO3H、-CHO、-COOH、-NR+等,这类取代基直接和苯环相连。取代基上一般有不饱和键或带有正电荷[9]。 电子效应能说明有机化合物的很多性质和规律,用电子效应贯穿整个课程,可使医学生对有机化学理论有更简明和直观的印象,有利于他们学习,但有些性质需用空间效应来解释。因此电子效应是影响有机化合物性质的一个方面,而不是全部。另外有机化学结构理论不只是电子效应,还有共振论和分子轨道理论,有时用共振论来解释一些性质比用电子效应来得直观,而分子轨道理论则更深入地揭示化学结构的本质,但就大专层次的有机化学用电子效应则较合理,不必过深地讲共振论和分子轨道理论,因此电子效应不失为一种简单而实用的理论。 [1] 李乐庆,唐 玲.试论我院医学化学教学中存在的问题与对策[J].川北医学院学报,2007,22(6):626-628 [2] 荣国斌.大学有机化学基础[M].上海:华东理工大学出版社,2000.278-279 [3] 王茹林.有机化学中的电子效应[J].基础医学教育,2002,4(3):18 [4] 徐景达.有机化学[M].北京:人民卫生教育出版社,1994.45-46 [5] 刑其毅.基础有机化学[M].北京:高等教育出版社,1992.5-6 [6] 沈丽丽.不对称烯烃加成反应中的马氏规则和反马氏规则[J].河南教育学院学报(自然科学版),2005,14(4):54-55 [7] 陈洪超.有机化学[M].成都:高等教育出版社,2009.40-41 [8] 刘景君.从电子效应的影响看马氏规则的实质[J].武警学院学报,2005,21(6),84-85 [9] 蒋益花.浅谈有机化学中的电子效应[J].卫生职业教育,2004,6(22):36 1005-3697(2011)01-0109-03 G640 B 刘承蔚(1964-),女,江苏人,讲师,理学学士,主要从事化学教学及科研工作。 2010-11-30 (学术编辑:冉 利)