高中原子结构教学中几个概念的深入认识
2020-12-17刘鹏张洪违
刘鹏 张洪违
摘 要 本文笔者对“原子结构”有关的几个相关概念进行了详细阐述,有助于读者对微观粒子有关的概念深入理解,避免教学中进入误区,对于教师的教学具有一定的指导价值,也可以作为学生学习的课后延伸。
关键词 原子结构;电子自旋;电子云;原子轨道;构造原理金属性
中图分类号:G632 文献标识码:A 文章编号:1002-7661(2020)32-0097-02
物质结构是一门理论性比较强的学科,它与其它学科一样来源于实践,来源于对实验现象的分析、思考,且要用实践来检验其结论是否正确。由于它的研究对象是微观质点的运动规律,与宏观运动有质的差异,又有密切联系,因此学习中学生往往会感到虚无缥缈,产生错误的认识。教学中教师要对微观粒子有关的概念深入理解,才能在教学中对学生进行正确的指导。笔者选取了在“原子结构”教学中容易产生错误认识的几个概念进行讨论。
一、电子自旋非自旋
为了解释实验发现的光谱双线结构问题,1925年G.Uhlenbeck和S.Goudsmit提出电子具有不依赖于轨道运动的、固有的磁矩假说,并把这个磁矩看成由电子固有的角动量形成的,他们把这个内在的固有角动量形象化地用电子的“自旋”运动来描述,于是电子自旋的概念由此产生。电子自旋可以认为是电子固有的特性,它可能顺着轨道运动产生的磁场取向,也可能逆着这个磁场而取向。可见,所谓电子“自旋”,早先是为了形象描述电子的固有角动量而出现的字眼。由于电子是微观粒子,因此电子自旋是无法用经典概念所能描述的,它是一种量子化运动,通常要用相对论量子力学才能解释。一个电子绕其一个轴旋转(自旋)的图象不能反映物理的真实性,所以不应该用“地球的自转”这样宏观的模式去摸拟微观世界电子的行为。“顺时针和逆时针两种状态”与“上下箭头”的描述也只是一种形象化的字眼,是人们所赋予微观世界的电子自旋运动一个容易想象的直观模型,仅仅是用来表示电子自旋的两种状态或两种取向的“用语”。
二、电子云非电子
在教学中,很多教师对于电子云的概念也比较模糊,认为所谓电子云就是电子以高速绕核运动,就好像在原子核周围笼罩上了一层带负电荷的云,所以把它称为电子云。这种错误理解,必然会对学生的进一步深入学习造成困难。
对于微观物体的运动,根据“测不准原理”,量子力学给出了这两个量无法同时准确测定的结果,所以像电子这类微观粒子运动时的轨迹就无法描出。研究电子运动,不是研究它的运动过程,而是研究它的在空间某处出现的几率或几率密度。在核外运动着的电子,决不会成云,所以把电子的运动想像成云是错误的。电子云的正确意义并不是说电子真的像云那样分散,不再是一个粒子,而只是电子行为统计结果的一种形象表示。但是,概率密度大不代表概率大,因为越靠近原子核,同样厚度的球壳空间体积也越小。
三、原子轨道非轨道
学生刚接触到原子轨道的概念时,很容易联想到宏观物体运动时的轨迹,不自觉地会想到电子也像人造地球卫星绕地球旋转那样,处于一定的轨道上作圆周运动。原子轨道是描述基态原子中核外电子的运动状态的数学函数,原子轨道的轨道并不是轨迹。那么为什么用轨道这一概念呢?这是因为历史原因。在经典力学中,对于宏观物体,它的运动轨道就等于轨迹,进入原子结构的旧量子论以后,玻尔首先提出原子軌道的问题,他把原子轨道与运动状态联系了起来,玻尔用的是经典力学,到量子力学后,电子的运动状态用波函数描写,但是基于习惯,还是把这些继承了下来。
原子轨道的含义并不等于电子的概率分布,更不等于电子云。电子在一定的空间运动状态除了有一定的概率分布以外,还有一定的其它物理性质,而电子云只是电子在空间出现概率密度分布的形象化表示。
很多时候,用一个圆圈表示ns电子,用“8”表示np电子的意义已经不是宏观经典轨道,也不是玻尔的量子轨道,而是具有波粒二象性的电子运动状态方便而简明的一种表示方法。
四、构造原理非原理
由以上概念可以看出,能量最低原理中的能量最低指的是原子的能量最低。核外电子排布的决定因素是这个体系中电子如何排布能够使原子(离子)体系的能量最低,每个电子的能量最低不代表原子(离子)的能量最低。根据光谱实验数据发现了诸多元素的基态原子的核外电子排布方式,然后再用相关理论去解释的过程中发现了构造原理。因此,在教学中我们应该首先引导学生承认实验事实,不能拿事实去适应原理。与任何原理一样,构造原理也具有相对的近似意义,尚需要发展。
其实,原子核外电子是一个整体,多电子原子的核外电子排布不是按照顺序组个进入各个能级的,只不过光谱实验的事实告诉人们哪样的核外电子排布更加稳定(能量最低)。在原子这个体系中,核外电子与原子核之间因电荷不同产生的引力和核外电子之间因电荷相同产生的斥力构成了一个相对的统一体,这个统一体在基态时趋于最低能态的排列方式。换句话说,4s轨道与3d轨道的能量哪个低,是动态可变的,与核电荷数、电子数、电子所处的状态有关。第四周期,K和Ca的3d轨道能量大于4s,但是根据1986年徐光宪教授带领他的团队首次计算并编制了1~100号元素中性原子各轨道能量的数值可以看出,21号元素往后4s轨道能量大于3d,但是为了满足能量最低原理的要求,这些元素的中性原子基态仍是先填充4s轨道。这就能解释为什么填充电子时按构造原理,原子失去电子时,却往往先失去外层电子? 因为究竟先电离哪个电子,仍然取决于哪种方式使离子的总能量最低。其实,离子与原子的计算方式也不相同。
虽然高等学校教材利用“能级交错”“屏蔽效应”“贯穿效应”对构造原理进行了解释,但是笔者认为,在高中教学中我们不能无谓地给学生增加负担,应按照课程标准要求进行教学。
五、金属性非金属活动性
中学教材中没有给出元素的金属性的具体概念,在大学化学中对此有明确的说明:元素的金属性通常被认为是元素的性质之一,描述的是元素气态基态原子失去电子变成气态阳离子趋势的大小。电离能可以比较元素金属性的强弱,这是因为利用电离能可以定性比较气态基态原子失去电子的难易,电离能越大,原子失去电子就越困难,其金属性就越弱。反之,电离能越小,原子失去电子就越容易,金属性就越强。电离能的数值大小主要取决于原子的有效核电荷、原子半径以及原子的电子构型。
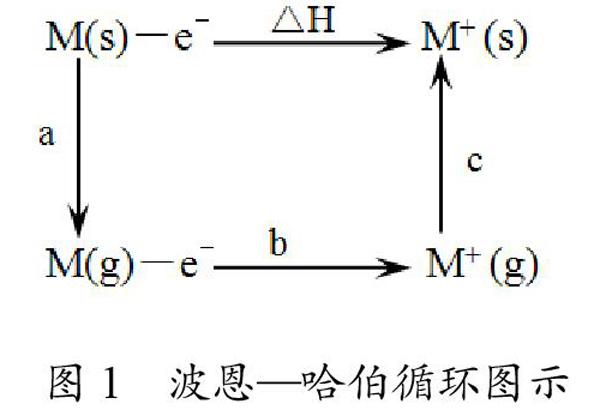
金属活动性的强弱通常被认为是金属原子在水溶液中失电子形成水合阳离子能力的强弱。金属的活动性以金属的标准电极电位为依据,反映金属在水溶液里形成水合离子倾向的大小,也就是反映金属在水溶液里失去电子发生氧化反应的难易。金属的电极电位越低,金属越容易失去电子变成水合离子,即该金属在水溶液中越活泼。金属晶体要经过三个过程才能转化成水合离子(如图1),它们分别是:1.金属原子转变为气态金属原子,这个过程需要克服金属键(即金属的原子化热或升华能);2.金属气态原子变成气态离子失去电子的过程(电离能 I );3.金属气态离子变为水合离子的过程(离子水合能)。其中a、b、c分别代表升华、电离、水合过程的能量变化,△H为电极反应的焓变。
从波恩—哈伯循环图示可看出△H=a+b+c,因此,电离能只是电极反应过程中能量变化的一部分。电离能大小、金属升华能(克服金属键)大小、水合能大小等因素都会影响电极电势。
通过以上讨论,可以发现金属活动性与金属性不同,教学中教师一定要避免把它们混淆使用。受学生知识水平限制,中学教材一些有化学概念具有一定的局限性。因此,在课堂用语、处理教材、教学设计时要注意语言的科学性,防止学生在高中化学的学习中混淆概念以至于形成错误的概念。
参考文献:
[1]化学课程教材研究开发中心.物质结构与性质[M].北京:人民教育出版社,2009.
[2]顾晔等.谈高中化学选修模块中核外电子排布的教学[J].化学教学,2014,(7):50.
