莓叶委陵菜黄酮与三萜类成分提纯与HPLC条件的初步研究
2011-01-06闵运江张正喜
闵运江,张正喜
(1.皖西学院生物与制药工程学院,安徽六安237012;2.安徽省植物生物技术实训中心,安徽六安 237012)
莓叶委陵菜黄酮与三萜类成分提纯与HPLC条件的初步研究
闵运江1,2,张正喜1
(1.皖西学院生物与制药工程学院,安徽六安237012;2.安徽省植物生物技术实训中心,安徽六安 237012)
在适宜的工艺条件下,即采70%乙醇,料液比为1:25,5次回流,水浴回流时间为2h,对莓叶委陵菜(Potentillafragarioides)中黄酮类、三萜类化合物进行了粗提取,经大孔树脂纯化,得到精制黄酮类、三萜类化合物溶液。然后探究其高效液相色谱分析的条件并在此条件下进行定性定量分析。结果表明:在流动相为乙腈和0.2%冰醋酸(体积比60:40),流量为1.0mL/min,检测波长为280nm的色谱条件下,样品溶液与标准溶液的峰均较好,且峰形对称,芦丁和熊果酸有不同的Rf值,说明两者在此条件下可以很好的分离。该方法测定简便,分离效果好,重复性好,灵敏度高。
莓叶委陵菜;黄酮类化合物;三萜类化合物;高效液相色谱;提取与纯化
莓叶委陵菜(PotentillafragarioidesL.)又名雉子筵,系蔷薇科委陵菜属(PotentillaL.)多年生草本植物,为中药雉子筵的基源植物,根及全草药用,其性甘、温,益中气,补阴虚,有清热解毒,止血止痢等作用;内服治痢疾,外用治疥疮;制剂雉子筵止血片,临床用于子宫肌瘤出血,月经过多,功能性子宫出血,产后出血等;根含α-儿茶素等鞣质,可提制栲胶[1](P75-76)[2](P393-394)[3]。委陵菜属植物中含有黄酮、三萜类等生物活性成分[4-8]。黄酮类化合物广泛分布于植物界,是泛指两个苯环(A与B环)通过三个碳原子相互联结而成的一系列化合物,其基本的碳架为C6-C3-C6。其具有诸多药理作用,在心脑血管的保健、更年期综合症的治疗等方面均有显著的疗效,因此受到广泛重视[9][10]。萜类化合物广泛存在于动植物体中,如植物香精油、植物及动物的某些色素等,它们的共同点是分子中的碳原子数都是5的倍数,三萜是由六个异戊二烯单位以头尾相连结合而成的。它具有许多生理活性,有保肝排毒、抗氧化、抗菌消炎、抗HIV-1等作用[11][12]。
莓叶委陵菜自然分布广,资源丰富,且因其根系发达而易繁殖栽培,其叶丛繁茂,花色鲜黄而艳丽,在城市园林绿化中,值得推广使用。然而,莓叶委陵菜中的黄酮类和三萜类等生物活性成分的研究尚未见报导。
目前,对黄酮类、三萜类的分析方法主要有分光光度法、高效液相色谱法(HPLC法)、液相色谱-质谱法(LC/MS法)、毛细管电泳法(MECC法)、气相色谱法(GC法)和薄层扫描法(TLC法)等[13]。分光光度法测定三萜化合物含量基于三萜苷元和香草醛的颜色反应,缺点是样品中如含有C3位羟基的甾醇和胆酸等同样也可能产生颜色反应,易引起误差;LC/MS法和MECC法测定需要的仪器复杂;GC法需要对待测组分衍生化才能检测,在使用上都受到一定的限制;薄层扫描法主要问题是所有检测样品的平衡性;本文采用HPLC法同时对莓叶委陵菜中黄酮类、三萜类进行定性、定量分析,方法快速、简便、可靠,可为莓叶委陵菜药用产品的开发及质量评定提供较实用的方法借鉴。
1 材料与方法
1.1 材料
莓叶委陵菜(PotentillafragarioidesL.)采自六安市小华山阳坡荒地,洗净后100℃烘箱干燥,常温储藏,备用。
1.2 仪器与试剂
主要仪器:Waters1525高效液相色谱仪,Waters2487紫外检测器,KF-C18系列色谱柱(中科院大连化学物理研究所),手动进样器,FA1004电子天平(上海精科天平),101AS-2型不锈钢数显电热鼓风干燥箱(上海浦东跃欣科学仪器厂),RE-52D旋转蒸发器(上海浦沪仪器厂),KQ-500B型超声波清洗器,HH-4数显恒温水浴锅(国华电器有限公司),标准检验筛(40目,浙江省上虞县纱筛厂),AB-8型大孔吸附树脂(天津市光复精细化工研究所),索氏提取器,层析柱(15×200mm)等。
主要试剂:芦丁(Rutin,上海化学试剂公司),熊果酸标准品(上海时代生物科技有限公司),0.2%冰醋酸,乙腈等,其中乙腈为色谱纯,其余试剂为分析纯。
1.3 黄酮及三萜类成分的提取
1.3.1 样品处理
称取一定重量的莓叶委陵菜干样品,将其剪碎置于研钵中研成粉末,过40目筛后收集粉末于烘箱中103℃烘至恒重,在干燥器中冷却后备用。
1.3.2 脱脂
取莓叶委陵菜干粉用折成筒状的滤纸包好,细线扎紧,封口处加少许脱脂棉,置于索式提取器的浸提管内,滤纸包长不超过虹吸管,索氏抽提法除去脂溶性杂质,即以无水乙醚为脱脂剂,于45℃下脱脂20h,充分除去样品中脂类和脂溶性色素。取出样品滤纸包先用电吹风吹干,再将滤纸包置烘箱中103℃烘2h后备用。
1.3.3 浸提
称取脱脂后干粉一定量,置于三角烧瓶中加入70%乙醇回流提取总黄酮和三萜类,第一次浸提加入干粉重量50倍体积的70%乙醇,即固液比=1:50,以后每次浸提固液比=1:25,第一次浸提时间为3h,以后每次浸提时间为2h,浸提温度为70℃,直到乙醇浸提液基本无色,共浸提5次,每次浸提液均经漏斗滤纸过滤至三角烧瓶内,合并5次提取液,将粗提液经旋转蒸发器蒸去其中乙醇并对乙醇进行回收,蒸去乙醇后的粗提物水溶液保存待用。
1.4 黄酮、三萜类的纯化
1.4.1 大孔树脂预处理
用40目筛在水中筛选出大小合适,颗料均匀的树脂,先用体积分数95%乙醇充分浸泡24h后装柱,然后用95%乙醇洗至洗出液加适量水无白色浑浊,再用去离子水洗至无醇味后加入大约4倍体积的5%HCl浸泡3-4h,用去离子水洗至中性,再加入大约4倍体积的5%NaOH浸泡3-4h,最后用去离子水洗至中性。
1.4.2 大孔树脂装柱
取层析柱(15×200mm),剪与柱口等面积的滤纸用水带至柱底部,平盖住底部的石英沙隔板,或是用脱脂棉用玻棒压平盖住底部,在柱中有一定量水的情况下挤出层析柱下端的空气,大孔树脂分散在水中用玻棒引流入柱中(装柱150mm),注意柱子中水面要始终漫过大孔树脂,否则柱中树脂间会有气泡,影响后来吸附效果。
1.4.3 粗提物纯化
将粗提物水溶液调节pH至2,上柱的吸附速率为1.0mL/min,待吸附充分后,先用蒸馏水洗至无色,然后用体积分数70%乙醇洗脱,洗脱速度1.0 mL/min,洗脱至无色,收集洗脱液即纯化后精黄酮、三萜类的醇溶液,备用。
2 HPLC条件[14][15]与检测结果
2.1 检测波长的选择
取芦丁和熊果酸标准对照品适量,以乙睛-0.2%冰醋酸(60:40)溶解,于紫外分光光度计上在200-400nm进行扫描,其中芦丁的最大吸收峰280nm;熊果酸的最大吸收峰在205nm,并且在280nm和252nm分别有次吸收峰。因此,紫外吸收检测波长确定为280nm。
2.2 色谱条件
以乙腈-0.2%冰醋酸水溶液(60:40)为流动相,1.0mL/min的流速,用KF-C18色谱柱,用Waters2487紫外检测器在280nm波长下分析检测,柱温为室温。所有组分在20min内出完。
2.3 流动相的选择
根据待分析的理化性质及参考文献,本文选用乙腈-0.2%冰醋酸为流动相,并且对两液体的不同配比条件下的组分出峰情况进行了反复对比研究,结果表明,在2.2项的色谱条件下,乙腈:0.2%冰醋酸水溶液=60:40时,等度洗脱组分分离效果较好,样液中的芦丁峰和熊果酸峰与其它相邻杂质峰能达到基线分离,峰形对称(图1-图3),与同等色谱条件下测得的标准品的色谱峰对照,保留时间分别是芦丁为1.913min,熊果酸为2.092min。
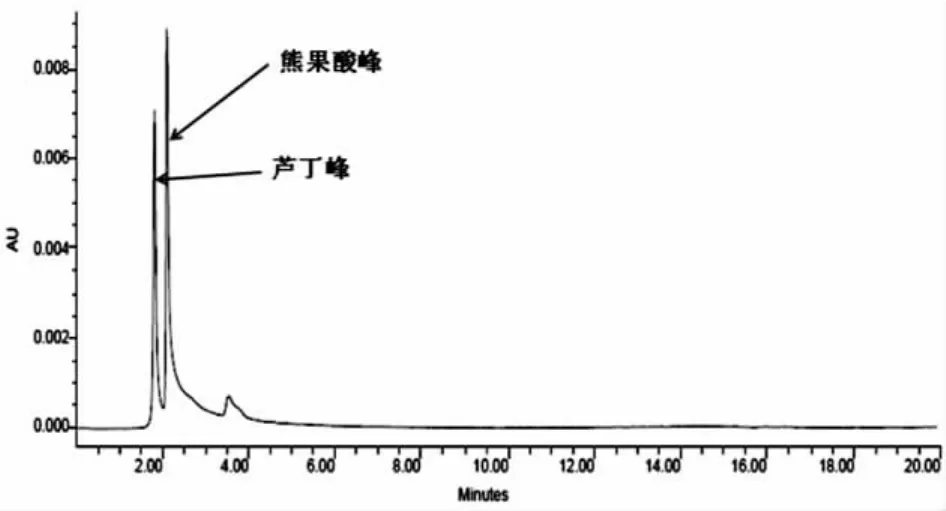
图1 精制莓叶委陵菜黄酮和三萜类HPLC图谱

图2 标准芦丁HPLC图谱

图3 标准熊果酸HPLC图谱
3 分析与讨论
3.1 定性、定量分析
根据HPLC的定性、定量分析的原理,在相同色谱条件下,保留时间相同的为同一物质,而其峰面积比即是其含量比。因此,参照标准芦丁、熊果酸标准品的色谱图,图1中保留时间为1.913min的峰为芦丁峰,保留时间为2.092min的峰为熊果酸峰,有较好的分离效果,基本上能与其周围其他峰达到基线分离。
3.2 精密度实验
以配制好的标准品溶液进样,体积为10ul,分别含芦丁1.0ug、熊果酸1.4ug,分别于上述色谱条件下重复进样6次,分别测定芦丁、熊果酸的含量,记录保留时间,进行统计学分析(见表1、表2),结果表明,保留时间与芦丁的RSD以及熊果酸的RSD均在5%以下,表明在该实验条件下同一组分出峰时间有良好的重现性,说明色谱条件适宜。

表1 芦丁精密度实验
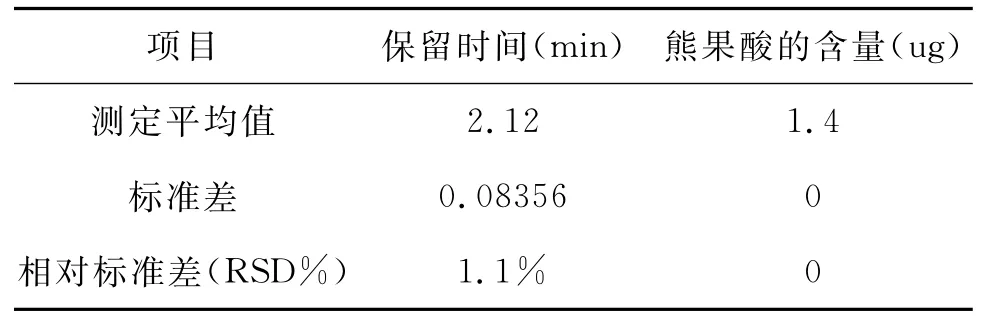
表2 熊果酸精密度实验
3.3 高效液相色谱中工作波长的确定
在实验过程中分别以254nm、260nm、280nm、335nm、360nm的波长进行检测,结果表明,用280nm波长检测出峰效果较好。
3.4 高效液相色谱中流动相的选择
在实验过程中选用了乙腈-0.2%冰醋酸等度洗脱如100:0、75:25、60:40、50:50和梯度洗脱几种方式。结果表明,以2.3下系统较好。
本次研究对莓叶委陵菜中芦丁和熊果酸进行高效液相色谱条件的初步分析,从实验的结果看,芦丁和熊果酸虽有较好的峰分离,但测出的的含量均较低,明显低于其他方法研究测得的含量[9],因此色谱分析的条件还需要进一步的深入研究探讨。另外,虽然莓叶委陵菜在其他液相色谱条件下有不少色谱出峰,但各峰所代表的成分种类等都尚待进一步研究。
[1]《安徽植物志》协作组.安徽植物志(第三卷)[M].北京:中国展望出版社,1990.
[2]俞德俊,陆玲娣,谷粹芝,等.中国植物志(第37卷)[M].北京:科学出版社,1985.
[3]Li CL,Ikeda H,Hideaki.Potentilla in Flora of China[M].Science Press and Missouri Botanical Garden Press(Volume9),2003,9:291-327.
[4]Tomczyk M.,Latte K.P.Potentilla—a Review of Its Phytochemical and Pharmacological Profile[J].Journal of Ethnopharmacology,2009,122(2):184-204.
[5]Yang J,Chen XQ,Liu XX,et al.Structural Determination of Two New Triterpenoids from Potentilla Discolor Bunge by NMR Techniques[J].Magnetic Resonance in Chemistry,2008,46(28):794-797.
[6]Zhao YL,Cai GM,Hong X,et al.Anti-hepatitis B Virus Activities of Triterpenoid Saponin Compound from Potentilla Anserine L[J].Phytomedicine,2008,15(4):253-258.
[7]Li PL,Lin CJ,Zhang ZX,et al.Three New Triterpenoids from Potentilla Multicaulis[J].Chemistry &Biodiversity,2007,4(26):17-24.
[8]Xue PF,Zhao YY,Wang B,et al.Simultaneous Determination of Seven Flavonoids in Potentilla Multifida by HPLC[J].Journal of Chromatographic Science,2007,45(4):216-219.
[9]闵运江,张银萍,高琼,等.安徽产10种委陵菜植物总黄酮的提取工艺与含量研究[J].食品与发酵工业,2008,(6):176-179.
[10]李楠,刘元.黄酮类化合物的功能特性[J].食品研究与开发,2005,26(6):139-141.
[11]洪艳平,尹忠平,上官新晨,等.光皮木瓜总三萜化合物提取和含量测定[J].江西农业大学学报,2007,29(2):55-57.
[12]王庆贺,李志勇,沈阳,等.委陵菜三萜类化学成分研究[J].中国中药杂志,2006,31(17):1434-1436.
[13]董文庚,邓晓丽.HPLC法测定银杏叶中黄酮的含量[J].CA理化检测-化学分册,2005,41(8):536-565.
[14]方从兵,宛晓春.葛根药用成分异黄酮的HPLC指纹图谱分析[J].热带作物学报,2005,26(2):39-44.
[15]毛淑杰,朱景宁,顾雪竹,等.香椽药材高效液相指纹图谱研究[J].中药材,2007,30(8):933-936.
A Preliminary Study on the Extraction and Purification and HPLC Conditions of Flavonoids and Triterpene Compounds in Potentilla Fragarioides
MIN Yun-jiang,ZHANG Zheng-xi
(1.BiologicalandPharmaceuticalEengineeringCollege,WesternAnhuiUniversity,Lu’an237012,China;2.AnhuiPlantBiotechnologyTrainingCentre,Lu’an237012,China)
In the optimum conditions,i.e.,70%ethanol was used,the ratio of material and liquid was 1:25,5times of the backflow,and the time of backflow was 2hours,the flavonoids and triterpene compounds in Potentilla fragarioides were extracted.The flavonoids and triterpene compounds solution were purified with macroporous resin.The conditions of high performance liquid chromatographic analysis(HPLC)were explored and then qualitative and quantitative analyses of the liquid samples were made under the HPLC conditions.The results showed that:The mobile phase were acetonitrile and 0.2%acetic acid and its volume ratio was 60:40,the flow rate was 1.0ml/min.The detection wavelength was 280nm.Under this chromatographic conditions,both the Rutin and Ursolic Acid in the sample solution and standard solution reached good HPLC peaks and these peaks were separated enough.So HPLC is a simple method which can make good separating effects,repeat and have high sensitivity.
Potentilla fragarioides L.;flavonoids;triterpene compounds;high performance liquid chromatography(HPLC);extraction and purification
Q5-33
A
1009-9735(2011)05-0001-03
2011-10-01
安徽高校省级自然科学研究重点项目(KJ2010A327);国家自然科学基金(41072251)。
闵运江(1963-),男,安徽金寨人,博士,教授,研究方向:植物生态、植物资源开发。
