乳清多肽的分离纯化及体外抗氧化活性研究
2011-01-04包怡红李锐达
包怡红,李锐达
(东北林业大学 林学院,哈尔滨 150040)
乳清多肽的分离纯化及体外抗氧化活性研究
包怡红,李锐达
(东北林业大学 林学院,哈尔滨 150040)
采用乳酸菌发酵乳清制备乳清多肽,利用超滤和凝胶Sephadex G-25分离纯化乳清多肽,并研究了超滤后乳清多肽对羟自由基、氧自由基和DPPH自由基的清除作用。结果表明,超滤后乳清多肽主要包含两个级分,分子量分别为2 031 u和328 u,对羟自由基、氧自由基和DPPH自由基具有清除作用。
乳清多肽;分离纯化;抗氧化
0 引 言
随着生活水平的提高,人们对食品安全的关注度日益升高,天然抗氧化剂越来越受到人们的青睐,近年来,关于蛋白水解物抗氧化性的研究已有许多报道,如大豆蛋白[1]、玉米蛋白[2]、猪血蛋白等[3]。
乳清是生产干酪或干酪素时的副产品,含有15%以上的蛋白质[4],是一种来源广泛的蛋白资源。随着具有各种生物活性短肽的不断发现,对乳清多肽的研究和开发日益受到人们的关注,目前已有关于乳清蛋白水解物抗氧化作用的研究报道[5-7]。本课题前期工作中采用乳酸菌水解乳清蛋白制备乳清多肽[8],本实验采用超滤、凝胶层析对发酵液进行分离纯化,并研究其体外抗氧化活性,进一步了解乳清多肽结构与功能的关系,从而为乳清生物活性肽作为新型抗氧化剂的开发和利用提供理论依据和技术支持。
1 材料与方法
1.1 材料与试剂
脱盐乳清粉;保加利亚杆菌L34.5;嗜热链球菌SP1.1;还原型谷胱甘肽;氧化型谷胱甘肽;VB12;Sephadex G-25;Tris;其他试剂均为国产分析纯。
1.2 仪器与设备
数控自动部分收集器;HL-2B蠕动泵;TP10-20超滤设备;T6新世纪紫外分光光度计;722S可见分光光度计。
1.3 方法
1.3.1 乳清蛋白多肽的制备[8]
乳清粉按10%(质量分数)复原后,采用保加利亚杆菌和嗜热链球菌(菌种比1∶1)复合发酵,发酵条件:初始pH值为6.4,发酵温度37℃,接种量5%,发酵时间14 h。发酵完毕后,沸水浴3 min灭酶,冷却,4 000 r/min离心10 min取上清液,待用。
1.3.2 超滤分离纯化
在一定的操作压力、操作温度下,选用截留相对分子质量为6 ku的聚砜类中空纤维膜进行超滤,收集滤过液,经真空浓缩、冷冻干燥得超滤预分离的乳清多肽,用作进一步实验使用。
1.3.3 SephadexG-25柱层析分离纯化[9]
(1)凝胶色谱测定条件。紫外检测波长λ=285 nm;洗脱液:蒸馏水;流速:0.6 mL/min;温度为室温23℃;样品质量浓度为40 g/L;加样量为1 mL。
(2)分析方法。取铬酸钾、还原型谷胱甘肽、氧化型谷胱甘肽、VB12各10 mg,分别溶于1 mL洗脱液中,制成标准溶液。
将已处理好的交联葡聚糖凝胶Sephadex G-25(1 cm×45 cm)装柱,在前述凝胶色谱测定条件下操作,用记录仪记录流出液吸收情况。洗脱液洗脱至基线平稳,加入标准溶液或3%的样品溶液1 mL,用量筒记录最大吸收峰出现时洗脱液的流出体积(mL),以流出体积为纵坐标,标准分子量的对数(lgM)为横坐标绘制标准曲线。
1.3.4 羟自由基清除率的测定[10]
在试管中分别加入0.5 mL浓度为10 mmol/L的水杨酸-乙醇溶液、0.5 mL样液、0.5 mL浓度为10 mmol/L的FeSO4溶液、3.5 mL蒸馏水,最后加入5 mL浓度为100 mmol/L的H2O2启动Fenton反应,摇匀后于510 nm处测定吸光度Ai;取0.5 mL蒸馏水代替浓度为10 mmol/L的FeSO4溶液,测得的吸光度为Aj;取0.5 mL蒸馏水代替酶解液,测得的吸光度为A0。
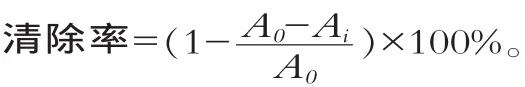
1.3.5 氧自由基清除率的测定[11]
采用邻苯三酚自氧化法测定。在试管中依次加入4.5 mL浓度为0.1 mol/L的Tris-HCl(pH值为8.2,内含浓度为2 mmol/L的EDTA)缓冲溶液,4.2 mL双蒸水,于25℃恒温20 min后加入25℃预热过的0.3 mL浓度为3 mmoL/L邻苯三酚溶液(以浓度为10 mmol/L的HCl配制,对照管用浓度为10 mmol/L盐酸代替),迅速摇匀,立即倾入比色皿中,在波长325 nm处每30 s测定一次吸光值A,计算线性范围内每分钟A的增值,此即为邻苯三酚的自氧化速率A0。乳清抗氧化肽活性测定按上述操作,加入邻苯三酚前,先加入一定量样液,并减少同体积双蒸水,其他操作均与上述相同,所测吸光度为Ai。
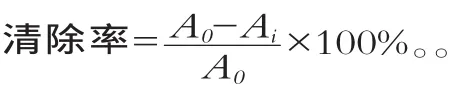
2 结果与讨论
2.1 超滤对乳清水解产物抗氧化活性的影响
乳清蛋白水解产物在操作压力0.04 MPa(操作温度25℃)下通过超滤膜。超滤前后乳清蛋白多肽的氧自由基清除率比较如图1所示。
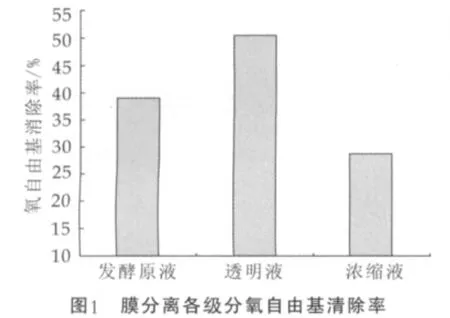
为了将乳清多肽混合物进行有效分离,本研究选用了超滤作为初步的分离手段。有研究[12]发现低分子量的乳清蛋白酶解物(小于6 ku)具有较好的抗氧化活性,因此实验采用截留相对分子量为6 ku的纤维膜对发酵液进行超滤处理。由图1可以看出,透过液的氧自由基清除率与超滤前相比有了明显提高,同时与浓缩液相比接近于两倍,透过液的氧自由基清除率得到提高也可能与抗氧化肽通过超滤得到了浓缩有关。
2.2 SephadexG-25凝胶层析分析
2.2.1 肽分子量标准曲线的确定
2.2.2 乳清多肽的凝胶层析分析
Sephadex G-25的上限截留分子量为5 000 D,超滤后的乳清水解液经Sephadex G-25凝胶过滤色谱分离结果如图3所示。
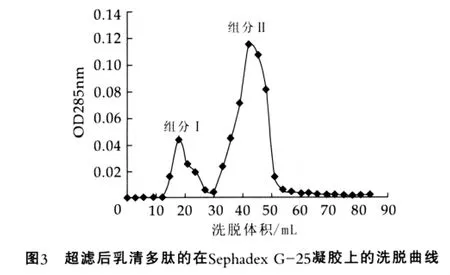
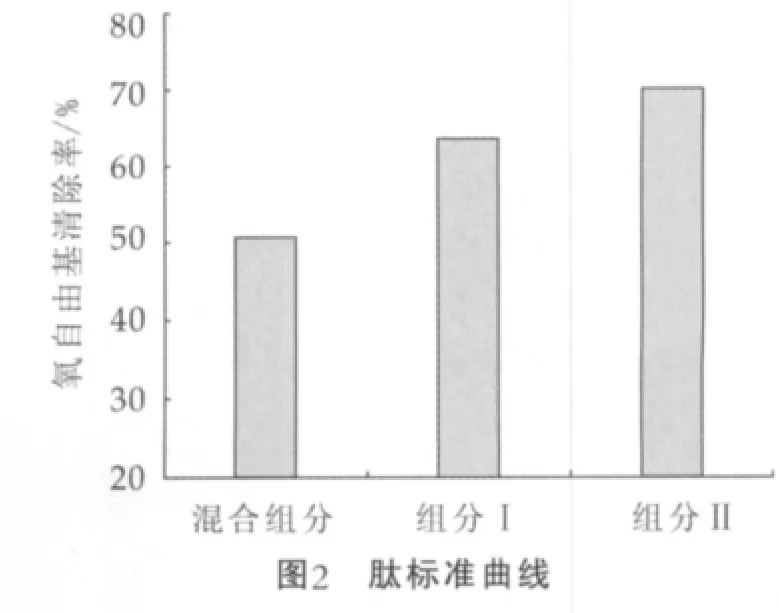
随着洗脱的进行分离得到的洗脱液紫外吸收度呈上升趋势,当达到一个最大值后又均呈下降趋势,当洗脱液体积达到60 mL左右时,多肽可被最大程度地洗出。组分Ⅱ峰高明显大于组分Ⅰ,说明组分Ⅱ在超滤混合物中所占比例较大。根据肽标准曲线直线方程y=-30.29x+118.19计算得组分Ⅰ和组分Ⅱ的相对分子量分别为2031 u和328 u,进一步说明水解物主要是一些小肽的混合物。
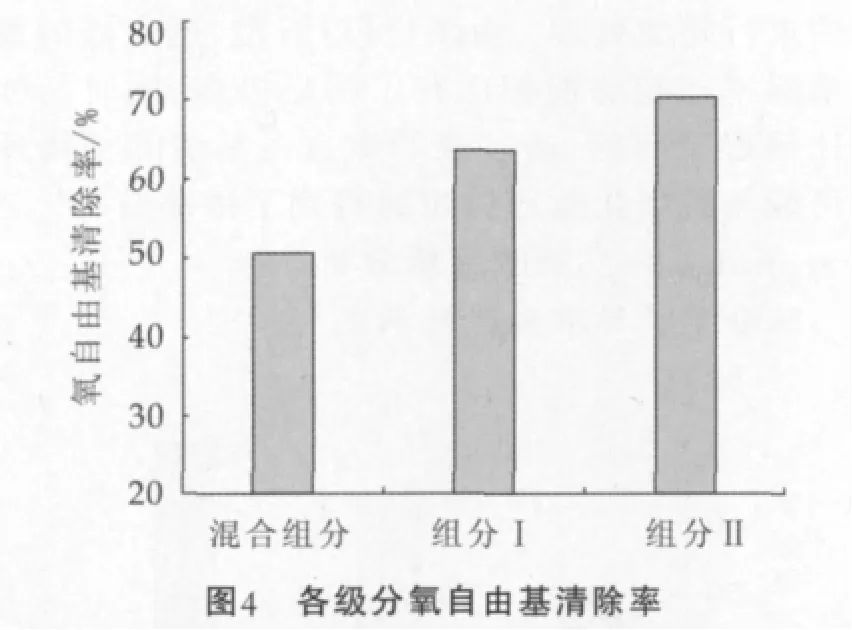
将分离后的组分Ⅰ和组分Ⅱ进行抗氧化活性比较,从图4可以看出,分离组分Ⅱ的氧自由基清除率大于组分Ⅰ,与透过液相比两者的氧自由基清除率都有显著提高,这可能与凝胶层析过程中产品中一些小分子糖类、游离氨基酸、无机盐等成分被逐渐分离,肽得到进一步浓缩有关。
2.3 超滤产物乳清多肽的抗氧化活性
2.3.1 清除羟自由基作用
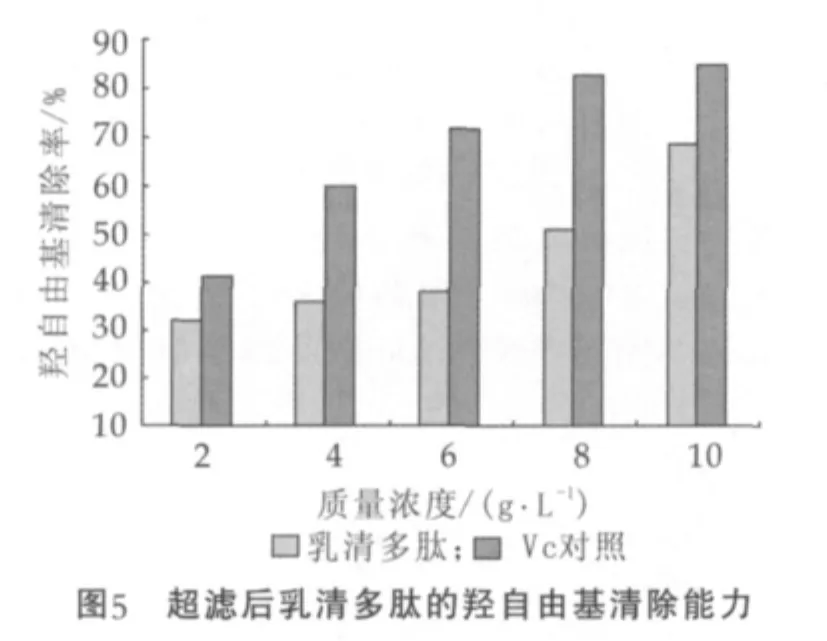
由图5可知,乳清多肽对羟自由基具有清除作用,其对羟自由基的清除率随着浓度的增加而明显增强,说明乳清多肽具有抗氧化作用,但清除效果低于同浓度条件下的VC,其半数抑制质量浓度IC50为6.31 g/L。
2.3.2 清除氧自由基作用
由图6可以看出,乳清多肽的氧自由基清除能力呈现量效关系,随着浓度的增加逐步增强,但均小于同浓度条件下的VC溶液,其半数抑制质量浓度IC50为6.59 g/L。结果表明乳清多肽具有抗氧化性,能够抑制氧自由基引起的氧化损伤。

2.3.3 清除DPPH自由基作用
实验比较了不同浓度的乳清多肽和VC对DPPH自由基的清除能力,由图7可以看出乳清多肽具有一定的DPPH自由基清除能力,且随其浓度的增大而增大,但清除效果明显低于VC,其半数抑制质量浓度IC50为6.07 g/L。

3 结 论
采用超滤法与凝胶过滤色谱相结合的实验方法对乳清蛋白发酵产物进行了分离并获得两个级分,超滤后的乳清多肽具有一定的自由基清除能力,显示了抗氧化活性。乳清多肽的抗氧化活性不如它的阳性对照物,但由于乳清多肽是一种天然抗氧化剂,成本低廉,因此对它的研究开发具有很好的经济价值和应用潜力。
[1]吴永沛,刘明,倪辉.大豆抗氧化活性肽固态发酵工艺优化[J].中国食品学报,2007,7(6):52-57.
[2]刘爱文,陈忻,王同文.酶法从玉米蛋白粉中提取短肽的初步研究[J].食品科学,2007,7(6):409-411.
[3]孙骞,罗永康.猪血红蛋白抗氧化活性肽的分离及脱色技术研究[J].肉类研究,2009(2):18-20.
[4]蔡永敏,曹志军,李发虎.乳清在食品工业中的应用[J].今日科苑,2007(6):43.
[5]VIRTANEN T,PIHLANTO A,AKKANEN S,et al.Development of Antioxidant Activity in Milk Whey during Fermentation with Lactic acid Bacteria[J].Journal of Applied Microbiology,2007,102:106-115.
[6]BLANCA H L,BEATRIZ M,LOURDES A,et al.Identification of Antioxidant and ACE-Inhibitory Peptides in Fermented Milk[J].Journal of the Science of Food and Agriculture,2005,85:1041-1048.
[7]彭新颜,孔保华,熊幼翎.乳清蛋白水解物抗氧化活性的研究[J].食品科学,2009,30(3):167-172.
[8]包怡红,李锐达,王戈,等.微生物发酵法制备乳清抗氧化肽的研究[J].中国乳品工业,2009,37(10):11-14.
[9]田波,迟玉杰.蛋清蛋白水解物的水解程度与分子量关系的研究[J].食品工业科技,2002,23(11):14-15.
[10]李艳伏,徐怀德,陈金海,等.木瓜蛋白酶酶解核桃粕蛋白产物抗氧化活性研究[J].中国食品学报,2008,8(5):8-13.
[11]邹国林,桂兴芬,钟晓凌,等.一种SOD的测活方法[J].生物化学与生物物理进展,1986,4:71-73.
[12]刘志东,郭本恒,王荫榆,等.乳源抗氧化肽的研究进展[J].食品科学,2009,30(1):282-283.
Study on purification and antioxidation of whey protein peptides
BAO Yi-hong,LI Rui-da
(College of Forestry,Northeast Forestry University,Harbin 150040,China)
Whey protein peptides were prepared by the Latic Acid Baceria Fermentation and then purified with ultrafiltration and Sephadex G-25 column,the scavenging rate of OH·,O2·-and DPPH·of whey protein peptides purified with ultrafiltration were also studyed.The results showed that whey protein peptides purified with ultrafiltration contain two fractions mainly,their relative molecular weight were 2031 D、328 D respectively,it displayed a scavenging activity to the OH·,O2·-and DPPH·.
whey protein peptides;purification;antioxidation
Q516
A
1001-2230(2011)10-0012-03
2011-08-20
黑龙江省博士后科研启动资金项目(LBH-Q08142)。
包怡红(1970-),女,教授,研究方向为功能食品与食品发酵。
