农药高效氯氰菊酯对小鼠肾细胞氧化损伤的研究
2011-01-02丁书茂秦龙娟张亚然
马 萍,丁书茂,秦龙娟,张亚然,杜 娟,杨 旭**
(1.咸宁学院 基础医学院,湖北 咸宁 437100;2.华中师范大学 生命科学学院,武汉 430079)
高效氯氰菊酯(beta-cypermethrin,β-CP)是目前国内最常用一种高效、广谱、速效的杀虫剂,属于拟除虫菊酯类农药,其活性比普通的氯氰菊酯(cypermethrin,CP)高1倍,被广泛应用于农业害虫、卫生害虫、畜牧害虫、储粮害虫等的防治.随着β-CP使用范围的不断扩大和使用量的增加,长期低浓度接触β-CP引发的人类的安全性问题日益受到人们的关注,对其毒性作用的研究表明,它对人和动物神经系统、消化系统、血液系统、免疫系统和生殖系统都有影响[1-2].李海峰等以家兔为试验材料,安丽等以大鼠为试验材料,都发现β-CP有生殖毒性[3-4].安丽等发现,β-CP对雄性小鼠体液免疫功能有抑制作用,此种作用可能与该农药对脾脏B淋巴细胞的氧化损伤有关[5].佟俊旺等通过彗星实验证明CP的染毒浓度80mg/kg时,能够造成小鼠外周血淋巴细胞DNA损伤[6].到目前为止,对该杀虫剂氧化损伤的研究报道较少,本研究特采用目前最常用的4.5%β-CP乳油对小鼠进行染毒,通过对小鼠肾脏ROS、GSH和DPC系数的测定研究其氧化损伤,为β-CP的生产、使用和管理提供理论依据.
1 材料与方法
1.1 主要仪器与试剂
F-4500型荧光分光光度计(日本日立公司),荧光酶标仪(FLx 800,Bio-Tek Instrument Inc,USA),酶标仪(日本岛津),低温冷冻离心机(Eppendorf-5415R),三用电热恒温水箱(北京市长源实验仪器厂),H2DCF-DA 荧光染料(Sigma公司),蛋白酶K(Merk公司),Hoechst33258荧光染料(Sigma公司),十二烷基硫酸钠(SDS),三羟基氨基甲烷盐酸盐(Tris-HCl),5,5′-二硫代二硝基苯甲酸(DTNB).
1.2 受试农药
4.5 %高效氯氰菊酯乳油,南京红太阳股份有限公司生产.
1.3 实验动物
选用湖北省实验动物研究中心提供的SPF级雄性昆明小鼠24只,体重为30±2g,饲养1周后实验.
1.4 分组和染毒
24只昆明小鼠随机分为1个阴性对照组和3个β-CP染毒组,每组6只.参考文献[6-8],染毒组分为低、中、高剂量组,确定染毒剂量分别为10、20和40mg/kg 3个剂量水平,β-CP以蒸馏水稀释成1、2和4mg/ml 3种浓度的使用液.由于β-CP难溶于水,故稀释液需现用现配,使用时在旋涡混悬仪上充分混匀.阴性对照组用蒸馏水.均经口灌胃给予,灌胃量为10mg/kg,每天1次,连续染毒7d,分别于实验前称小鼠体重,小鼠可以自由进食,进水.
1.5 肾脏匀浆和细胞悬液的制备
染毒结束后将小鼠颈椎脱臼处死,立即取出肾脏,在冰冷的PBS(pH=7.5)中漂洗,滤纸拭干,称重.肾细胞分成两部分,一部分取肾脏0.2g加2mL PBS制成10%匀浆液,低温离心后取上清,用于ROS和GSH的检测.另一部分肾脏剪成糜状,过滤后将细胞滤液离心去上清,再用PBS重悬细胞,用于DPC系数的检测.
1.6 实验方法
1.6.1 活性氧(ROS)的测定 取10%匀浆液2μL,加入398μL PBS作200倍稀释.取100μL稀释液于酶标板中排列,并加入100μL荧光染料DCFA染色,避光反应5min,用荧光酶标仪检测.
1.6.2 谷胱甘肽(GSH)的测定 取10%匀浆液200μL于EP管中,加入50μL10%TCA,混匀后置冰上10min.10 000g离心5min,取上清,将50μL上清加50μLPBS并调节pH至7.5.取50μL样品加入酶标板,分别加入150μL浓度为60μg·mL-1的 DTNB显示液,室温避光5min,用全波长酶标仪在412nm波长下测吸光值,根据标准曲线求得GSH的浓度(以n mol/L表示).
1.6.3 DNA-蛋白质交联(DPC)系数的测定 DPC
采用 KCl-SDS沉淀法进行检测[9-10].首先向样品中加入SDS,使之与DPC及蛋白质结合,然后加入KCl溶液使DPC和蛋白质沉淀,而游离的DNA留在上清液中.将上清液转移后,再向沉淀中加入蛋白酶K除去蛋白质,使DPC中的DNA游离出来,用荧光法测定此DNA的含量A(交联DNA)以及原液中 DNA 的含量 B(游离 DNA),计算DPC系数η(η=A/A+B).
1.7 统计分析
实验数据均采用Mean±se表示,采用Origin 7.0统计分析软件进行数据处理,并进行t检验并绘图.
2 实验结果
2.1 ROS含量的变化
不同剂量的β-CP染毒小鼠后,其肾脏ROS含量的变化如图1所示.从图1可看出,随着β-CP染毒剂量的升高,ROS含量逐渐上升,呈一定的剂量-效应关系.低剂量组(≤10mg/kg)与对照组无显著差异(p>0.05),中、高低剂量组(≥20mg/kg)与对照组有显著差异(p< 0.05).以上结果表明,较高剂量的β-CP能造成ROS含量的上升.
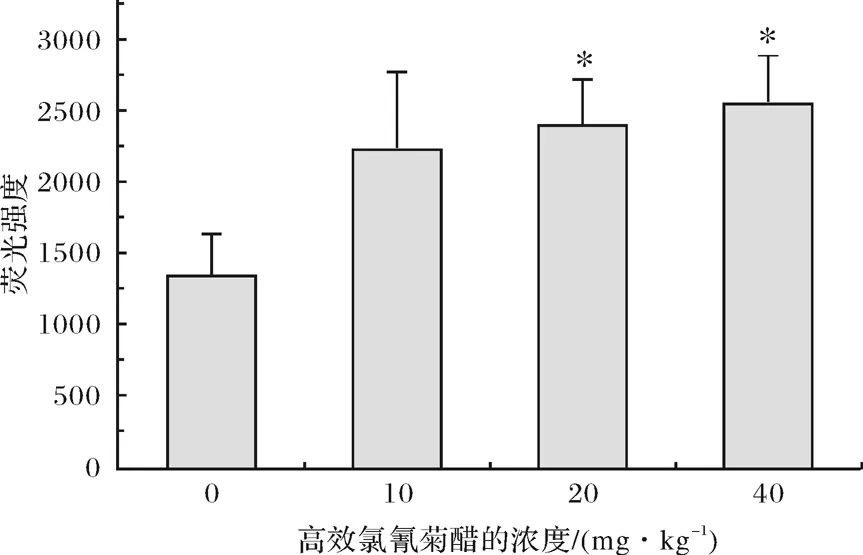
图1 不同剂量的高效氯氰菊酯染毒小鼠肾脏ROS含量(*:与对照组相比较,p<0.05)Fig.1 ROS content in mouse kidney induced by different dose of beta-cypermethrin

图2 不同剂量的高效氯氰菊酯染毒小鼠肾脏GSH含量(**:与对照组相比较,p<0.01)Fig.2 GSH content in mouse kidney induced by different dose of beta-cypermethrin
2.2 GSH含量的变化
不同剂量的β-CP染毒小鼠后,其肾脏GSH含量的变化如图2所示.从图2可看出,随着β-CP染毒剂量的升高,GSH含量逐渐下降,呈一定的剂量-效应关系.低剂量组(≤10mg/kg)与对照组无显著差异(p> 0.05),中、高剂量组(≥20mg/kg)与对照组有极显著差异(p <0.01).以上结果表明,在较高剂量的β-CP作用下,小鼠肾脏的GSH含量有明显的下降.
2.3 DPC系数的变化
用KCl-SDS沉淀法检测DPC系数,其肾脏DPC系数变化如图3所示.从图3可看出,随着β-CP染毒剂量的升高,DPC系数逐渐上升,呈一定的剂量-效应关系.低剂量组(≤10mg/kg)与对照组无显著差异(p>0.05),中、高剂量组(≥20mg/kg)与对照组有显著差异(p<0.05).
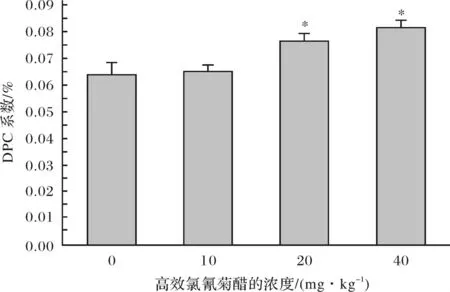
图3 不同剂量的高效氯氰菊酯染毒小鼠肾脏DPC系数(*:与对照组相比较,p <0.05)Fig.3 DPC coefficient in mouse kidney induced by different dose of beta-cypermethrin
3 讨论
我国是农药生产和使用大国.长期以来,我国农药的使用表现为总量大、杀虫剂比例大、过量和不合理使用、农药残留超标现象突出等特点.农药通过食物、职业接触和居住环境接触等途径被人体吸收,严重危害人类健康[11].高效氯氰菊酯是目前国内最常用一种杀虫剂,本研究用小鼠肾脏作ROS、GSH和DPC系数的检测来评价其氧化损伤是非常有必要的.
反映细胞内氧自由基水平的主要指标是细胞中ROS含量,机体的正常代谢可以产生一定水平的ROS,组织细胞中活性氧的主要产生者是线粒体[12].正常细胞中,一些ROS能够被抗氧化机制所中和,比如还原型的GSH可以和ROS结合形成硫代半缩醛,氧化与抗氧化水平保持动态平衡.如果ROS生成过量,会导致GSH耗竭,机体天然的抗氧化机制将被破坏.活性氧还可通过攻击脱氧核糖、攻击胸腺嘧啶碱基、增高细胞内游离ca2+浓度,激活Ca2+依赖的核酸内切酶和攻击修复DNA链断裂的酶来导致DNA链断裂[11].氧自由基对细胞的氧化损伤作用还会引起DNA-蛋白质交联[13].DNA-蛋白质交联难以修复,对参与DNA复制、转录和修复的蛋白质活动起阻碍作用.
在本研究中,随着β-CP染毒剂量的升高,ROS含量逐渐上升,GSH含量逐渐下降,DPC系数逐渐上升,各项指标呈一定的剂量-效应关系.β-CP染毒剂量≥20mg/kg时,ROS和DPC系数有显著差异(p< 0.05),GSH 有极显著差异(p<0.01).说明在较高剂量的β-CP诱导之下细胞内产生了过量的ROS,受到ROS攻击,细胞的抗氧化能力下降,DNA和蛋白质交联增多,造成了小鼠肾脏的氧化损伤.
4 结论
本研究结果表明,β-CP染毒剂量≥20mg/kg时,造成了小鼠肾脏的氧化损伤,且损伤程度与β-CP剂量浓度有一定的剂量-效应关系,但β-CP造成氧化损伤的机制还需进一步探讨.
[1]冯 坚.具有光学活性的拟除虫菊酯杀虫剂开发概况[J].农药,2000,39(2):1-6.
[2]李海斌,李 君.高效氯氰菊酯毒作用研究进展[J].环境与健康杂志,2007,24(5):372-374.
[3]李海峰,李五福,魏学良,等.高效氯氰菊酯对雄兔睾丸及精液的生殖毒性[J].环境与职业医学,2006,23(3):246-248.
[4]安 丽,鲍 清,靳翠红,等.乙体氯氰菊酯对雄性大鼠睾丸的损伤作用[J].卫生毒理学杂志,2003,17(3):146-147.
[5]安 丽,蔡 原,吕相征,等.高效氯氰菊酯对雄性小鼠免疫功能的影响[J].中国公共卫生,2002,18(4):444-445.
[6]佟俊旺,王 颖.氯氰菊酯和溴氰菊酯对雄性小鼠淋巴细胞DNA的损伤[J].环境与健康杂志,2008,25(8):705-707.
[7]王鲜忠,吴建云,孙 燕,等.高效氯氰菊酯通过E R K1/2影响小鼠睾丸睾酮合成[J].畜牧兽医学报,2007,38(9):920-925.
[8]赵 越,安 丽,刘儒曦,等.乙体氯氰菊酯致小鼠脑组织Glu-G1n环路紊乱的实验研究[J].中国工业医学杂志,2007,20(1):44-45.
[9]刘丹丹,王 博.气态甲醛致雌性小鼠生殖细胞DNA-蛋白质交联的研究[J].生态毒理学报,2006,1(3):249-252.
[10]彭光银,杨 旭,赵 玮.液态甲醛致小鼠肝和睾丸DPC研究[J].医学研究杂志,2006,11(35):9-12.
[11]崔 永.农药毒死蜱和氯氰菊酯的遗传毒性研究[D].2006,浙江大学:35-40.
[12]Raha S,Robinson B H.Mitochondria,Oxygen free radicals,disease and ageing[J].Trends Biochem Sci,2000 25(10):502-508.
[13]黄思佳.纳米四氧化三铁与HeLa细胞生物相容性的研究[D].华中师范大学,2010.
