大麦提取物体外抗氧化活性检测
2011-01-02刘国安杨庆明冯筱璐
刘国安,郑 炜,杨庆明,冯筱璐,韩 潇,杨 红,丁 兰
(西北师范大学 生命科学学院,兰州 730070)
大麦提取物体外抗氧化活性检测
刘国安*,郑 炜,杨庆明,冯筱璐,韩 潇,杨 红,丁 兰
(西北师范大学 生命科学学院,兰州 730070)
用丙酮抽提了大麦的酚类成分并检测了总酚含量以及提取物对羟自由基、超氧阴离子的清除作用,测定了还原力和对大鼠肝微粒体脂质过氧化的一致活性.结果表明,大麦提取物能有效清除由Fenton反应产生的羟自由基及邻苯三酚自氧化产生的超氧阴离子,其活性高于Trolox;有较强的还原力和对脂质过氧化的抑制作用.结果提示大麦提取物在体外有较强的抗氧化活性.
大麦;提取物;抗氧化活性;清除自由基
大麦是世界范围内的重要农作物,中国大麦种植面积和总产量居水稻、小麦、玉米和粟之后第5位,主要作为饲料和酿酒原料.大麦中含有多种酚类化合物,主要包括:阿魏酸、香草酸、丁香酸、花色素苷等[1].其中多酚类物质的含量较高并且比较稳定,总多酚含量可以达到1 200~1 500mg/kg[2].有关大麦的大量研究主要集中在其遗传多样性和啤酒酿造制麦工艺方面.近年来国内外学者开始关注其生理活性,研究发现大麦由于富含酚类化合物而具有较强在体外清除自由基的能力,抗氧化活性是大麦生理功能的重要组成部分[3-4].
细胞在正常状态下不断地产生一定浓度的活性氧,体内主要产生于具有免疫活性的细胞和众多协同配合的信号传导通路中.但过多的活性氧,会造成生物大分子的损伤,进而影响机体正常的生物功能.多种癌症、衰老及其他很多疾病的发生发展都和氧化胁迫有关.因此,抗氧化剂的摄入可能预防或治疗相关疾病.本文检测了大麦的丙酮抽提成分中总酚含量,并对其多种常见氧自由基的清除作用和抑制脂质过氧化活性进行了检测,以期揭示大麦提取物抗氧化作用的机理,为大麦进一步在保健品及医学领域的开发利用提供基础数据.
1 材料与方法
1.1 材料、试剂与仪器
大麦(Hordeum vulgare L.)由甘肃黄河啤酒股份有限公司提供.BHT和Trolox为Sigma产品;其余试剂均为国产分析纯.
旋转蒸发仪(EYELAN-1000,日本);紫外分光光度计(HITACHI U-1800,日本);冷冻干燥器(LGJ-18S,北京松源华兴科技发展有限公司);高速冷冻离心机(Beckman L-860M);紫外可见分光光度计(HITACHI U-1800).
1.2 大麦中酚类成分提取
取200g干燥大麦,粉碎后加石油醚脱脂2次后,室温下用2L80%丙酮萃取3次(每次24h),其间超声提取1h,用Whatman No.1滤纸过滤后合并滤液,减压回收丙酮得浓缩液,将浓缩液在40℃真空干燥,之后转至-70℃真空冷冻干燥,所得干燥物以DMSO配制50mg/mL储备液于4℃保存,备用.Folin-Ciocalteu比色法[5]测定总酚含量.
1.3 清除超氧阴离子能力的测定
参照陈美珍等[6]改良的邻苯三酚自氧化法.取0.5mL不同浓度样品,加入4.43mL 50mmol/L pH8.2磷酸缓冲液及70μL 10mmol/L邻苯三酚溶液,在反应启动后每隔30s测相应A325,至4.5min止.对照管用70μL(10mmol/L)盐酸代替邻苯三酚溶液,计算邻苯三酚及每个样品的平均自氧化速率.超氧阴离子清除率%)=[1-(A1-A2)/A0]×100,其中,A0为未加清除剂时的自氧化速率;A1为加入清除剂时的自氧化速率;A2为未加邻苯三酚时对照.
1.4 清除羟自由基能力的测定
根据刘立明等[7]分光光度法,稍加修改.在一系列10mL试管中分别加入1.0mL甲基紫溶液(1.03×10-5mol/L)、1.0mL FeSO4溶 液(1×10-3mol/L)、1.0mL H2O2(1.6mol/L)溶 液、1.0mL不同浓度的样品溶液,用Tris-HCl溶液调节pH4.7,稀释到5mL并摇匀,放置5min后,在波长582nm处测定吸光值.羟自由基清除率(%)= [1-(A0-A2)/(A0-A1)]×100%,其中,A0为未加Fe2+和H2O2时的吸光值;A1为未加清除剂时的吸光值;A2为加入清除剂时的吸光值.
1.5 还原力的测定
抗氧化物质将三价铁(Fe3+)还原成二价铁(Fe2+)后,Fe2+与铁氰化钾生成可溶性蓝色配合物KFe[Fe(CN)6],在700nm处有最大吸收.还原力越强,KFe[Fe(CN)6]越多,吸光度越大,故吸光度与还原力呈正比关系.
采用Oyaiuz测定还原力的方法[8],稍加修改.取一定浓度的受试样品溶液1mL,加人0.2mol/L pH 6.6的磷酸盐缓冲液和1% 铁氰化钾(K3Fe(CN)6)溶液各2.5mL并混合均匀,置于50℃水浴中保温20min,然后加入2.5mL 10%的三氯乙酸,混合物在3 000×g下离心10min.吸取上清液2.5mL,加入2.5mL蒸馏水和1mL 0.1%的三氯化铁溶液,静止10min后在700nm处测定吸光值.反应物的吸光值越大表明还原力越强.
1.6 抑制脂质过氧化作用的检测
大鼠微粒体的制备及脂质过氧化检测见Yang等的方法[9].测定抑制作用时,取鼠肝微粒体于pH7.5的磷酸钾缓冲液中,37℃振荡孵育,其蛋白终浓度为0.3~0.5mg/mL,加入0.1mmol/L的Fe2+/Vc启动反应,受试组分别加入不同浓度的样品.1h后,15%三氯醋酸终止反应,并加入0.67%的硫代巴比妥酸于沸水浴中反应30min,离心后取上清于532nm处比色测定.空白组加入启动剂后加入三氯醋酸,以不加受试化合物组为阳性对照.测定各浓度组的光吸收值.以计算样品对丙二醛产生的抑制率.以上所有实验,每组重复3次,结果以均值±标准差表示.
2 结果与分析
2.1 大麦提取物中酚类成分测定
200g大麦经丙酮提取,得到8.65g干物质,得率为4.325%.总酚含量达3.11g/kg干重.(表1).此结果高于以前报道[4,10],这可能与大麦产地、品种等有关,另外本实验延长了丙酮提取时间,并通过超声辅助提取,获得了更多的酚类化合物.

表1 大麦提取物得率及总酚含量Tab.1 Total phenolic content and extraction yield of barley
2.2 提取物对超氧阴离子的清除能力
O-·2在细胞内可直接导致DNA损伤并可使过氧化氢酶、谷胱甘肽过氧化物酶和肌酸激酶失活.因而对O-·2的清除至关重要.
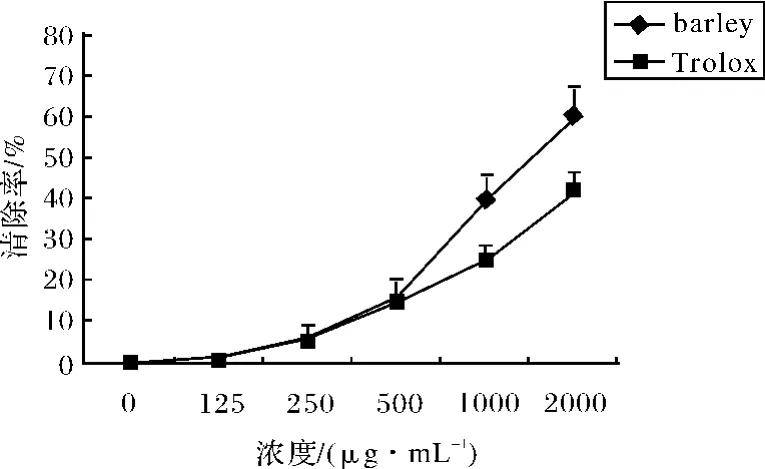
图1 大麦2取物和Trolox清除超氧阴离子的能力Fig.1 The hydroxyl radical scavenging capacity of barley extract and Trolox
有多种体系可以在体外诱发产生超氧阴离子,本实验采用邻苯三酚自氧化体系产生O-·2,检测大麦提取物的清除能力.如图1所示,在低浓度(<500μg/mL)时,和人工合成的抗氧化剂Trolox的活性相近,但随着浓度的增高,显示出区别.大麦在1 500.0μg/mL时清除率达到50%,而Trolox达50%清除时所需的浓度为2 468.9μg/mL,大麦提取物清除效果明显优于Trolox.
2.3 提取物对羟自由基的清除能力
羟自由基是氧化能力极强的自由基,能很容易地氧化各种有机物和无机物,氧化效率高,反应速度快.它是造成动植物体内细胞质过氧化、核酸、蛋白质和多糖分解的重要活性氧.
Fenton反应是产生羟自由基的经典体系,被认为能模拟人体内产生羟自由基的过程,以H2O2/Fe2+体系产生OH·,检测受试化合物的清除能力.结果如图2所示,大麦提取物和Trolox活性均随浓度升而高加强,呈浓度依赖性.而大麦提取物对羟自由基有很好的清除效果,在114.9μg/mL时达到50%的清除率,与Trolox的117.1μg/mL非常接近.
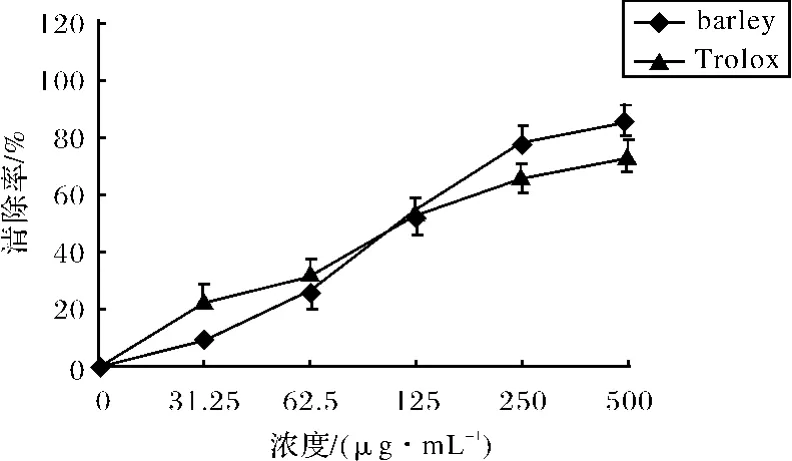
图2 大麦提取物和Trolox清除羟自由基的能力Fig.2 The superoxide radical scavenging capacity of barley extract and Trolox
2.4 提取物的还原力
还原力的测定,是检验样品是否为一良好的电子提供者.还原力强的样品应为良好的电子供应者,其供应的电子除了可使Fe3+还原为Fe2+外,也可参与自由基反应,使自由基成为稳定的物质,因此具有强的抗氧化活性.

图3 大麦提取物和Trolox的还原力Fig.3 Reducing power of barley extract and Trolox
大麦提取物的还原力检测结果见图1,在测试浓度范围内,其活性约为Trolox的1半,相对较弱.但鉴于Trolox的特性,大麦提取物的活性也不低.
2.5 提取物抑制脂质过氧化的作用
微粒体,尤其是其中的光滑内质网含有大量的不饱和脂肪酸,极易在自由基引发剂和氧存在的条件下发生过氧化反应,经常作为研究氧胁迫和抗氧化作用的模型.微粒体中富含有自由基反应所需的细胞色素C、P450、NADPH、黄素蛋白等组成,且是分离的亚细胞结构,这样就排除了大体积器官水平实验中可能出现的复杂性,因而采用一定的激发剂与微粒体构成的脂质过氧化模型是目前研究脂质过氧化、筛选抗氧化剂的理想方法[11].丙二醛(MDA)是脂质过氧化的主要降解产物,因此,通过测定生物体MDA含量可间接指示脂质过氧化的水平.
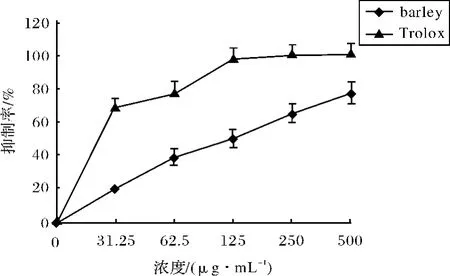
图4 大麦提取物和Trolox对脂质过氧化的抑制作用Fig.4 Inhibition of lipid peroxidation by barley extract and Trolox
本实验利用体外VitC/Fe2+激发体系与微粒体构成的脂质过氧化模型,检测提取物的抑制脂质过氧化作用.从结果(图4)可看出,相比Trolox的IC50 22.7μg/mL,大麦提取物IC50为124.9μg/mL,显示出较弱的抑制作用.在脂质过氧化体系中,引起脂类氧化损伤的也是OH·,这一结果与上述羟自由基的清除能力不一致,究其原因可能与Trolox较好的脂溶性而酚类的水溶性较好有关.
3 讨论
已有的报道表明,大麦有较强的还原力和金属离子螯合能力,可清除DPPH自由基、抑制亚油酸自氧化,其中不同溶剂提取物的抗氧化活性有所差异,相对来说丙酮提取物具有优异的抗氧化效果[4,10].同时,大麦麸皮提取物也有较好的抗氧化性和抗突变性,可抑制亚油酸自氧化,抑制生物膜脂质过氧化作用,有消除DPPH自由基和超氧化物的能力,可降低Ames致突变试验致突变性能力[12].
由于不同的抗氧化剂作用机理不同,因此在不同的反应体系中抗氧化能力有所差异,甚至同一种抗氧化剂在一种体系有很强的抗氧化活性,但在另一种体系中会无活性或是表现出促氧化活性,可见用单一指标来评价物质的抗氧化活性有很大的片面性.大部分已报道的大麦提取物活性是在DPPH或亚油酸体系中检测的,本文采用羟自由基、超氧阴离子、还原力和脂质过氧化体系,更接近体内的氧化胁迫状态,并与已知抗氧化剂Trolox对照,对其抗氧化活性进行了较为全面的检测及评价.结果表明,大麦提取物在体外具有较强的抗氧化活性,其大多数抗氧化指标与Trolox相近,有部分活性甚至强于Trolox,如在清除超氧阴离子和羟自由基的体系中.物质的还原能力可以看作为其潜在抗氧化性能的重要体现,还原力的强弱在一定程度上表示了物质抗氧化活性的强弱.检测结果显示,大麦提取物具有一定还原力.和OH·是最常见、最主要的两种氧自由基,在机体内自由基链中最早产生.在需氧生物体中,线粒体、内质网中细胞色素P450以及核膜的电子传递链都能使生物体内普遍存在的氧分子获得一个电子还原生成.产生的形式有非酶与酶促反应两种.其在体内主要通过超氧化物歧化酶(SOD)催化歧化为 H2O2,逐步分解.在细胞内可直接导致DNA损伤并可使过氧化氢酶、谷胱甘肽过氧化物酶和肌酸激酶失活.OH·是已知毒性最强的活性氧,对二者清除作用的研究有重要的意义.大麦提取物能有效清除超氧阴离子和羟自由基,大麦提取物在1500.0μg/mL和114.9μg/mL时,对邻苯三酚自氧化产生的和Fenton反应产生的OH·的清除率达到50%,它对两种自由基的清除能力甚至强于Trolox.
脂类是各种生物膜的主要成分,因此脂类的氧化性损伤直接影响到细胞的正常功能.脂质过氧化是自由基引起的一种最常见的生物分子损伤.微粒体脂质过氧化是检测脂类物质被氧化状态最常用的指标.MDA为脂质过氧化的终产物之一,因此测定脂质过氧化终产物MDA的变化能较好地反映脂质过氧化的水平[13].从本实验结果中可以看出,在Vit/Fe2+诱发的微粒体脂质过氧化体系中,大麦提取物的IC50为124.9μg/mL,表明对脂质过氧化有较好的保护作用.
以上各反应系统基于不同作用机理,反映提取物不同方面的抗氧化活性,但综合个体系结果表明,从大麦分离出的化合物具有很强的抗氧化活性,可以作为筛选天然抗氧化剂、食品添加剂的有效来源,或作为保健品、医药用品的候选材料.
[1]凌俊红,王金辉,王 楠,等.大麦芽的化学成分[J].沈阳药科大学学报,2005,22:267-270.
[2]McMurrough I,Loughrey M J,Hennigan G P.Content of(+)-catechin and proanthocyanidins in barley and malt grain[J].Journal of Science and Food Agriculture,1983,34:62-72.
[3]师成斌,张 晓,田艳花,等.黑麦芽类黑精体外抗氧化活性的研究[J].食品工程,2007,1:56-59.
[4]Liu Q,Yao H Y.Antioxidant activities of barley seeds extracts[J].Food Chemistry,2007,102:732-737.
[5]刘 清,李 玉,姚惠源.Folin-Ciocalteu比色法测定大麦提取液中总多酚的含量[J].食品科技,2007,4:175-177.
[6]陈美珍,余 杰,龙梓洁,等.龙须菜多糖抗突变和清除自由基作用的研究[J].食品科学,2005,26:219-222.
[7]刘立明,刘丽虹,宋功武,等.分光光度法测定Fenton反应产生的羟自由基[J].湖北大学学报:自然科学版,2002,24:326-328.
[8]Oyaizu M.Studies on products of browning reactions:Antioxidative activities of products of browning reaction prepared from glucosamine[J].Japanese Journal of Nutrition,1986,44:307-315
[9]Yang Qingming,Pan Xianhui,Kong Weibao,et al.Antioxidant activities of malt extract from barley(Hordeum vulgare L.)toward various oxidative stress in Vitro and in Vivo[J].Food Chemistry,2010,118(1):84-89
[10]Zhao H F,Dong J J,Lu J,et al.Effects of extraction solvent mixtures on antioxidant activity evaluation and their extraction capacity and selectivity for free phenolic compounds in barley(Hordeum vulgare L.)[J].Journal of Agriculture and Food Chemistry,2006,54:7277-7286.
[11]Cai Y J,Fang J G,Ma L P,et al.Inhibition of free radicalinduced peroxidation of rat liver microsomes by resveratrol and its analogues[J],Biochim Biophys Acta,2003,1637:31-38.
[12]履 新.大麦麸皮多酚类提取物抗氧化活性和抗突变性[J].粮食与油脂,2004,6:9-12.
[13]李嘉琳,海春旭,梁 欣,等.红景天与葛根水提取物对微粒体LPO模型的影响[J].第四军医大学学报,2006,27:1220-1222.
Evaluation of in vitro antioxidant activities of Barley extracts
LIU Guoan,ZHENG Wei,YANG Qingming,FENG Xiaolu,HAN Xiao,YANG Hong,DING Lan
(College of Life Science,Northwest Normal University,Lanzhou 730070)
In the present study the phenolics were extracted with 80%acetone and the total phenolics were determined.The antioxidant activities of barley extract in vitro were determine by measuring scavenging effects on the hydroxyl radical and superoxide radi-cal,reducing power,inhibition of rat liver microsome lipid peroxidation .The result showed barley extract exhibited high scavenging effects on the hydroxyl radical and superoxide radical,even more efficient than Trolox;it has effective reducing power and inhibition in lipid peroxidation.All these imply barley extract possess high antioxidation in vitro and these will be helpful to further studies of antioxidative mechanism and extensive use.
Barley;extracts;antioxidative activities;free radical scavenging
Q946
A
1000-1190(2011)04-0612-04
2011-07-02.
国家自然科学基金项目(30960464);甘肃省教育厅研究生导师项目(0901-05).
*E-mail:liuguoan@nwnu.edu.cn.
