花烛胚性悬浮细胞玻璃化超低温保存条件研究
2010-12-31王更亮许传营王广东
王更亮,许传营,王广东
花烛 (AnthuriumandraeanumL ind.)又名红掌、安祖花,为天南星科 (A raceae)花烛属 (AnthuriumSchott)多年生常绿草本植物[1],因其花型独特、花色艳丽、周年开花而备受人们喜爱,是具有较高观赏和经济价值的花卉之一。花烛属植物种类丰富(约 550余种),且经过长期的种间杂交已培育出大量栽培品种,截至 20世纪 90年代已培育出 100余个优良的花烛栽培品种[2]。目前,花烛种质资源的保存主要采用传统的田间资源圃和组织培养保存法。传统的种质资源保存方法不仅需要大量的人力、物力及土地,还受到栽培环境的影响,在保存过程中易发生变异进而导致花烛种性退化和丢失,最终影响优良种质资源的利用。因此,建立一种操作简便并能长期稳定保存花烛种质资源的方法至关重要。
超低温保存是植物种质资源保存的有效方法之一。常规超低温保存多采用两步法,但需要程序降温仪等专业设备,且保存效果不稳定、存活率低,不同种类间的保存效果存在差异,在实际应用过程中存在较多问题[3]。玻璃化超低温保存技术则克服了上述缺点,植物材料经冷冻保护剂处理后可以直接于液氮中保存,无论是成本还是冻后存活率均有较大改进,是目前植物种质资源长期保存最为有效而简便的方法,具有较广的应用前景[4]。目前采用玻璃化超低温保存法已成功保存了荔枝 (LitchichinensisSonn.)[5]、枇杷〔Eriobotryajaponica(Thunb.)L ind l.〕[6]及长鞭红景天〔Rhodiolafastigiata(Hook.f.et Thom s.)S.H. Fu〕[7]等多种植物的悬浮细胞系。
在已获得花烛胚性悬浮细胞培养体系的基础上,作者对花烛胚性悬浮细胞的玻璃化超低温保存条件(包括继代培养时间、渗透调节剂种类和浓度及预培养时间、装载液种类和预处理时间、冷冻保护剂 PVS2脱水时间和超低温保存后的化冻温度)进行了比较研究,筛选出适宜的保存条件,以期为花烛种质资源的长期保存提供实验数据。
1 材料和方法
1.1 材料
以花烛品种‘Am igo’叶片为外植体,采用辛伟杰等[8]的方法诱导形成胚性愈伤组织;将胚性愈伤组织接种于 250 m L三角瓶中,参照文献[9]的液体培养方法进行增殖培养;用机械方法将增殖状态良好的胚性愈伤组织细胞团破碎成颗粒状,网筛过滤,筛选出2mm的悬浮细胞团作为实验材料。
1.2 方法
1.2.1 基本培养流程 选取继代培养 3 d的直径2mm的花烛胚性悬浮细胞团 (0.2 g),用 1/2M S液体培养基 (含 80 g·L-1蔗糖,pH 5.8)预培养 2 d后,置于 4℃冰箱中低温处理 24 h;参照 Sakai等[10]的配方配制装载液 PVS2,在室温条件下用体积分数 25%的 PVS2预处理 10m in,然后用预冷至 0℃的体积分数100%的 PVS2在0℃条件下脱水 7.5m in,随即投入液氮中冷冻保存;冻存 6 h后,将细胞团置于 37℃水浴中化冻。
化冻后,迅速移除 PVS2,室温条件下用 1/2M S液体培养基 (含 1.2mo l·L-1蔗糖,pH 5.8)将细胞洗涤 3次,每次 10m in,然后将细胞首先转移到含80 g·L-1蔗糖的 1/2M S液体培养基 (pH 5.8)中,置于 25℃培养箱中暗培养 3 d后,转到含 40 g·L-1蔗糖的 1/2M S液体培养基(pH 5.8)中继续暗培养 2 d,最后转移至正常液体继代培养基(含 1.0m g·L-12, 4-D、0.5m g·L-1KT和 30 g·L-1蔗糖的 1/2M S培养基,pH 5.5)中振荡培养,转速为 100 r·m in-1,散射光,培养温度 25℃~28℃。恢复培养 5 d后测定细胞的相对存活率。
1.2.2 单因素实验设计 在预实验基础上,采取逐步优化方法对影响超低温保存效果的各种因素 (包括继代培养时间、渗透调节剂的种类和浓度及预培养时间、装载液种类及预处理时间、PVS2脱水时间和化冻温度)进行单因子实验,除对待优化因素进行不同设置外,其他条件均与基本培养流程相同。
继代培养时间设置 5个处理:1、3、5、7和 9 d;预培养过程中的渗透调节剂分别为蔗糖和山梨醇,蔗糖质量浓度设置 4个梯度:60、80、100和 120 g·L-1,山梨醇浓度设置 3个梯度:0.3、0.5和 0.7 mo l· L-1,二者均分别设置 5个预培养时间:0、1、2、3和 4 d;预处理中使用的装载液分别为体积分数 25%、60%和 80%的 PVS2以及混合液 (包含 2mo l·L-1甘油和 0.4mo l·L-1蔗糖),处理时间分别设置为 0、5、10、15和20 m in;用体积分数100%PVS2脱水的时间设置 7个处理:0、5、10、15、20、25和 30 m in;化冻温度设置 6个处理:10℃、20℃、30℃、40℃、50℃和 60℃。各处理的悬浮细胞团用量均为 0. 2 g,各 3次重复。
1.2.3 细胞活力测定 采用氯化三苯四氮唑(TTC)法检测恢复培养 5 d后花烛胚性悬浮细胞的细胞活力,用吸收值 (TTC值)表示超低温保存后细胞的存活率[11-12],并据此计算细胞的相对存活率,计算公式为:细胞相对存活率 =(处理后细胞的 TTC值/未处理细胞的 TTC值)×100%。
2 结果和分析
2.1 继代培养时间对悬浮细胞相对存活率的影响
对于玻璃化超低温保存技术来说,保存材料的生理状态与其抗寒性、耐干燥及脱水能力有关,是影响玻璃化超低温保存效果的重要因素之一。继代培养时间不同的花烛悬浮细胞经玻璃化超低温保存后的相对存活率见表 1。由表 1可看出,继代培养 1 d的花烛悬浮细胞经冷冻保存后的相对存活率较低,仅为13.5%;继代培养时间延长,细胞相对存活率也逐渐提高,细胞的抗冻能力有所增强。继代培养 3 d的悬浮细胞相对存活率最高,达到 20.4%;继代培养 5 d的细胞相对存活率也较高,为 19.7%。继代培养时间超过 5 d后,随继代培养时间的进一步延长,悬浮细胞的相对存活率呈下降趋势,继代培养 9 d的花烛悬浮细胞的相对存活率最低,仅为 8.7%,细胞的抗冻能力最差。造成这一现象的原因可能是培养 3~5 d的悬浮细胞正处于指数生长期,处于此时期的细胞冻存后能保持分裂能力的细胞占有较高比例,并且大部分细胞体积较小、细胞质较浓、细胞壁较薄、无液泡,比具有液泡或细胞壁较厚的悬浮细胞更耐冻。差异显著性分析结果表明,经冷冻保存后,继代培养3和 5 d的悬浮细胞的相对存活率极显著高于继代培养1、7和 9 d的悬浮细胞(P<0.01),因而,继代培养3~5 d的花烛胚性悬浮细胞是玻璃化超低温保存的理想材料。
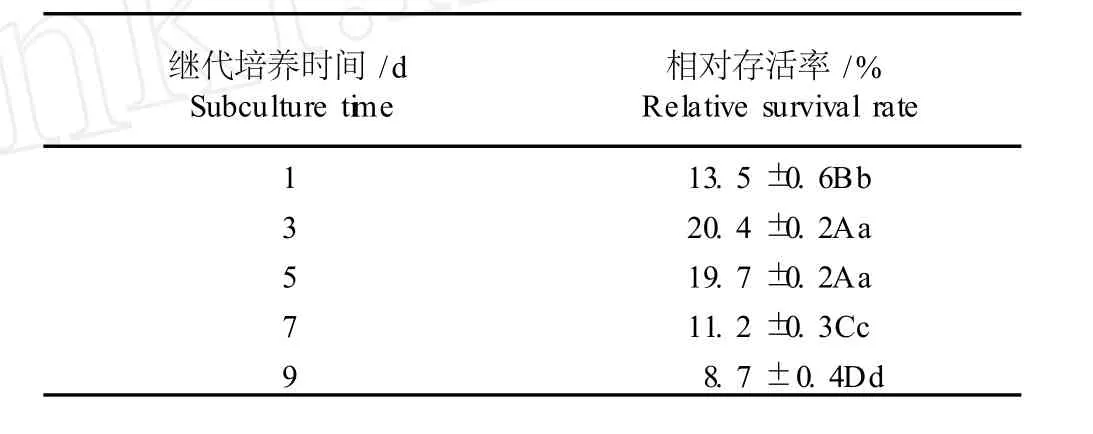
表 1 不同继代培养时间对玻璃化超低温保存后花烛胚性悬浮细胞相对存活率的影响1)Tab le 1 Effect of d ifferen t subcu lture tim es on rela tive surv iva l ra te of em bryon ic suspen sion cells of An thu rium and raeanum L ind.after v itr ifica tion cryopreserva tion1)
2.2 渗透调节剂对悬浮细胞相对存活率的影响
用含不同渗透调节剂 (蔗糖和山梨醇)的 1/2M S液体培养基对继代培养 3 d的花烛胚性悬浮细胞进行不同时间的预培养,悬浮细胞的相对存活率见表2。结果表明,未经预培养的悬浮细胞活性极低,抗冻能力较弱,恢复培养后的生长状态较差,细胞相对存活率仅约 5%;而用含有不同质量浓度蔗糖或山梨醇的 1/2M S液体培养基预培养的悬浮细胞活性明显增强,细胞相对存活率显著增加,但预培养超过一定时间后,相对存活率开始下降。总体来说,经含有不同浓度蔗糖或山梨醇的 1/2M S液体培养基预培养 2 d,悬浮细胞的抗冻能力最强,相对存活率最高。
2.2.1 蔗糖的影响效应 由表 2可见,用含有不同质量浓度蔗糖的 1/2M S液体培养基对花烛悬浮细胞进行预培养,经过玻璃化超低温冷冻保存后花烛悬浮细胞的相对存活率有一定的波动。用含 80 g·L-1蔗糖的 1/2M S液体培养基预培养的悬浮细胞相对存活率大幅度增加,用含 100 g·L-1蔗糖的 1/2M S液体培养基预培养的花烛悬浮细胞相对存活率较高,而用含 120 g·L-1蔗糖的 1/2M S液体培养基预培养的悬浮细胞相对存活率则有所降低。
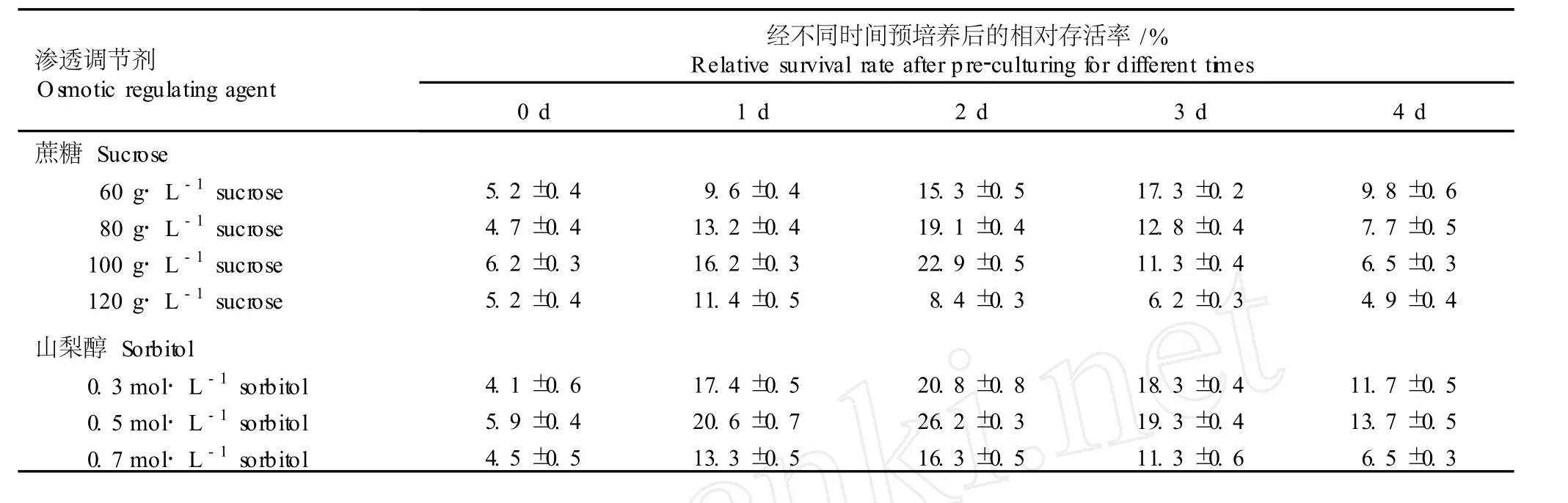
表 2 渗透调节剂和预培养时间对玻璃化超低温保存后花烛胚性悬浮细胞相对存活率的影响Tab le 2 Effectsof osm otic regu la ting agen tsand pre-cu lture tim e on rela tive surv iva l ra te of An thu rium andraeanum L ind.em bryon ic suspen sion cellsafter v itr ifica tion cryopreserva tion
在蔗糖质量浓度相同的条件下,延长预培养时间,各处理组悬浮细胞的相对存活率并不因预培养时间的延长而增加,预培养 2或 3 d的悬浮细胞相对存活率最高,超过适宜的预培养时间,各处理组花烛悬浮细胞的相对存活率均下降。用含 60 g·L-1蔗糖的1/2M S液体培养基预培养 3 d,悬浮细胞的相对存活率最高;分别用含 80和 100 g·L-1蔗糖的 1/2M S液体培养基预培养 2 d,悬浮细胞的相对存活率最高;而用含 120 g·L-1蔗糖的 1/2M S液体培养基预培养1 d,悬浮细胞的相对存活率即达到最大值。这可能是由于蔗糖质量浓度的升高和培养时间的延长均可导致细胞过度脱水,产生渗透胁迫,不利于花烛悬浮细胞的生长。实验结果表明,用含 100 g·L-1蔗糖的1/2M S液体培养基预培养 2 d,经过玻璃化超低温保存后,花烛胚性悬浮细胞恢复活力的效果较好。
2.2.2 山梨醇的影响效应 由表 2还可看出,预培养基中添加的山梨醇浓度与预培养时间对经过玻璃化超低温保存后花烛胚性悬浮细胞的相对存活率也有较大影响。预培养时间相同,花烛悬浮细胞的相对存活率随山梨醇浓度的提高表现出一定的波动变化趋势,其中,用含 0.5 mo l·L-1山梨醇的 1/2M S液体培养基进行预培养,悬浮细胞的相对存活率最高。
在山梨醇浓度相同的条件下,延长预培养时间,花烛悬浮细胞的相对存活率并不因预培养时间的延长而提高,而是在适宜预培养时间达到最高,超过该时间则降低。经过 2 d的预培养,在玻璃化超低温保存后花烛悬浮细胞的相对存活率均最高。
综合分析后可看出,以山梨醇作为渗透调节剂对花烛悬浮细胞进行预培养,经玻璃化超低温保存后悬浮细胞的相对存活率优于以蔗糖作为渗透调节剂进行预培养的细胞,最高可达 26.2%。因而,在花烛悬浮细胞玻璃化超低温保存过程中,适宜的预培养基为含 0.5mol·L-1山梨醇的 1/2M S液体培养基,最佳预培养时间为2 d。
2.3 装载液预处理对悬浮细胞相对存活率的影响
用不同装载液对花烛胚性悬浮细胞进行不同时间的预处理,经过玻璃化超低温保存后悬浮细胞的相对存活率见图 1。由图 1可见,未经装载液预处理的悬浮细胞经玻璃化超低温保存后的相对存活率较低。而用装载液预处理不同时间,经玻璃化超低温保存后悬浮细胞的相对存活率有一定的差异,基本变化趋势是在一定时间内预处理时间越长悬浮细胞的相对存活率越高,但超过适宜预处理时间,悬浮细胞的相对存活率则降低,这可能是由于预处理时间过长,装载液则对悬浮细胞产生毒害作用,致使悬浮细胞的相对存活率下降。

图 1 装载液种类及预处理时间对玻璃化超低温保存后花烛胚性悬浮细胞相对存活率的影响F ig.1 Effects of load ing solution types and pre-trea tm en t tim e on rela tive surv iva l ra te of A n thu rium and raeanum Lind.em bryon ic suspen sion cellsa fter v itr ifica tion cryop reserva tion
用不同装载液对悬浮细胞进行相同时间的预处理,悬浮细胞的相对存活率有一定的差异,其中,用体积分数 25%PVS2处理 15 m in,经玻璃化超低温保存后花烛胚性悬浮细胞的相对存活率最高,达到29.0%。因此,用装载液对花烛悬浮细胞预处理的最适条件为用体积分数 25%PVS2室温预处理 15m in。
2.4 脱水时间对悬浮细胞相对存活率的影响
以体积分数 100%PVS2为冷冻保护剂,对花烛胚性悬浮细胞进行不同时间的脱水处理,经过玻璃化超低温保存后悬浮细胞的相对存活率见图 2。结果表明,未经体积分数 100%PVS2脱水处理的悬浮细胞相对存活率较低,仅为 7.7%;用体积分数 100%PVS2处理 10 m in的胚性悬浮细胞相对存活率最高,达到32.1%;处理时间超过 10 m in,悬浮细胞相对存活率呈现下降趋势。这可能是因为处理时间低于 10m in,细胞脱水不充分,在降温过程中不能迅速达到玻璃化状态,因而不易成活;而处理时间超过 10m in,细胞受到 PVS2的毒害作用,相对存活率也有所下降。

图2 体积分数100%PVS2处理不同时间对玻璃化超低温保存后花烛胚性悬浮细胞相对存活率的影响F ig.2 Effect of d ifferen t trea tm en t tim es of 100%PVS2 on rela tive surv iva l ra te of A n thu rium and raeanum L ind.em bryon ic suspen sion cellsafter v itr ifica tion cryopreserva tion
2.5 化冻温度对悬浮细胞相对存活率的影响
经过玻璃化超低温保存后再用不同温度水浴化冻,花烛胚性悬浮细胞的相对存活率见图 3。结果表明,化冻温度低,悬浮细胞的相对存活率也较低;化冻温度为 40℃,悬浮细胞的相对存活率最高,达到32.1%;化冻温度超过 40℃,悬浮细胞的相对存活率则逐渐下降。造成这一现象的原因可能是因为化冻温度过低时细胞易发生次生结冰现象,致使细胞受到伤害;而化冻温度过高又易使悬浮细胞受到化学毒害。所以,经过玻璃化超低温保存后花烛胚性悬浮细胞水浴化冻的最适温度为 40℃。
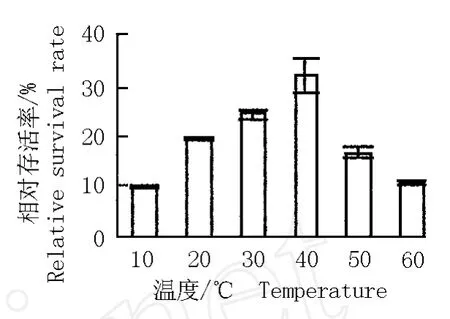
图 3 化冻温度对玻璃化超低温保存后花烛胚性悬浮细胞相对存活率的影响F ig.3 Effect of thaw ing tem pera ture on rela tive surv iva l ra te of A n thu rium and raeanum Lind.em bryonicsuspen sioncells a fter v itr ifica tion cryopreserva tion
3 讨论和结论
通过上述实验,对花烛胚性悬浮细胞玻璃化超低温保存过程中各步骤的适宜条件进行了比较分析,初步建立的适宜于花烛品种‘Am igo’胚性悬浮细胞玻璃化超低温保存和化冻流程为:将继代培养 3~5 d、直径 2mm的悬浮细胞团在含 0.5mo l·L-1山梨醇的1/2M S液体培养基中悬浮培养 2 d后,置于 4℃条件下处理 24 h,然后用体积分数 25%PVS2预处理15m in,再于 0℃条件下用体积分数 100%PVS2脱水10m in,迅速投入液氮中冻存;冻存后的悬浮细胞在40℃水浴中化冻 3m in,然后用含 1.2mo l·L-1蔗糖的 1/2M S液体培养基洗涤 3次,每次 10m in,洗涤后的悬浮细胞即可转至恢复培养基中进行恢复培养。
实验结果显示,细胞的生理状态、预培养、预处理和脱水处理是决定花烛胚性悬浮细胞玻璃化超低温保存能否成功的重要因素。其中,预培养可以减少细胞内的自由水含量,提高细胞的束缚水含量,增强细胞抗冻性。此外,用适宜浓度的山梨醇进行预培养,其效果优于蔗糖,这可能与“在液体培养基中添加山梨醇可以极大地降低冰晶的形成温度和形成速率”[13]有关。
花烛悬浮细胞的含水量较大,预培养后仍需经过脱水处理以降低细胞内的含水量,而用高浓度冷冻保护剂直接进行脱水容易对细胞造成物理和化学毒害,因此,如何减少高浓度冷冻保护剂对细胞的伤害是玻璃化超低温保存成功与否的关键[14]。研究结果表明,在用冷冻保护剂脱水前采用低浓度保护剂进行预处理,可以获得较好的效果。可能的原因是在急速脱水前用冷冻保护剂进行预处理具有一定的缓冲效果,减轻了剧烈脱水对细胞的伤害,保持了细胞膜的完整性[15-16];预处理后的悬浮细胞再经脱水处理,可以进一步降低细胞含水量,促进低温时玻璃化状态的形成,从而减少冰晶形成过程中对细胞膜造成的伤害[17]。但关于预处理的作用机制目前尚未见相关报道。
一般来说,保存材料在高浓度糖中长期培养会产生高渗伤害,悬浮细胞长时间浸于玻璃化溶液中也会造成脱水过度,因此保存材料的耐胁迫性及适宜的处理时间对植物悬浮细胞玻璃化超低温保存至关重要[18]。而保存材料对环境胁迫的耐受能力与植物的基因型以及不同阶段的生理状态等因素有关[17],尤其是对不耐寒的热带和亚热带植物进行玻璃化超低温保存时,更应选择生理状态最佳的材料。
超低温保存过程中,保存材料在液氮中保存时间的长短对保存效果影响较小,例如:保存 1 d和保存10个月的樱桃〔Cerasuspseudocerasus(L ind l.)G. Don〕在保存效果上无明显区别[19]。目前,多采用35℃~40℃水浴对超低温保存材料进行化冻,花烛胚性悬浮细胞玻璃化超低温保存后需要经过 40℃水浴快速化冻才能保持较高的相对存活率,但木本植物的冬芽超低温保存后必须在 0℃低温下慢速化冻才能达到最好的效果[20]。可见,冷冻保存的植物种类不同,其化冻温度也不同。
值得注意的是,恢复生长后花烛胚性悬浮细胞的实际再生率低于用 TTC法检测的悬浮细胞的相对存活率。一方面可能是由于 TTC法检测是以脱氢酶的活力为标准,不能完全反映保存材料经超低温处理后的损伤程度;另一方面也可能是在超低温保存后细胞未达到恢复生长的要求。此外,超低温保存后保存材料的再生能力也可能与植物本身的抗寒性有关,因此,不同品种花烛胚性悬浮细胞的适宜保存条件有一定的差异,应分别进行进一步的深入研究。
[1]中国科学院中国植物志编辑委员会.中国植物志:第十三卷第二分册[M].北京:科学出版社,1979:9-10.
[2]毛洪玉.花烛[M].北京:中国林业出版社,2004:1-14.
[3]陈 勇,陈娴婷,王君晖.瓯柑愈伤组织的玻璃化法超低温保存研究[J].浙江大学学报:理学版,2004,31(2):197-201.
[4]Engelm ann F.Plantcryop reservation:p rogressand p rospects[J].In Vitro Cellular and Developmental B io logy:Plant,2004,40(5): 427-433.
[5]谢玉明,曾继吾,张秋明,等.玻璃化法超低温保存荔枝胚性悬浮细胞[J].热带作物学报,2008,29(5):622-625.
[6]王家福,刘月学,林顺权.枇杷茎尖二步玻璃化法超低温保存的研究[J].植物资源与环境学报,2006,15(2):75-76.
[7]郭燕霞,刘玉军.长鞭红景天悬浮培养细胞的玻璃化法超低温保存研究[J].西北植物学报,2006,26(8):1605-1611.
[8]辛伟杰,徐 彬,王广东,等.花烛体细胞胚胎发生及植株再生研究[J].园艺学报,2006,33(6):1281-1286.
[9]许传营.花烛体胚液体培养体系建立及体胚发生相关生理特征研究[D].南京:南京农业大学园艺学院,2008:31-41.
[10]SakaiA,KobayashiS,O iyama I.Cryop reservation of nucellar cells of navelorange(CitrussinenesisOsb.var.brasiliensisTanaka)by vitrification[J].PlantCellReports,1990,9(1):30-33.
[11]刘贤旺,杜 勤.杜仲愈伤组织超低温保存的研究[J].生物学杂志,1996,13(4):21-24.
[12]罗士伟,唐 惕.植物组织和细胞的超低温保存及种质库建立的研究现况[J].细胞生物学杂志,1983,5(1):1-7.
[13]Chen T H H,Kartha K K,Constabel F,et al.Freezing characteristicsof cu lturedCatharanthusroseus(L.)G.Don cells treated w ith dim ethylsulfoxide and sorbitol in relation to cryop reservation [J].Plant Physiology,1984,75:720-725.
[14]M atsumoto T,Sakai A,Yamada K.Cryop reservation ofinvitrogrown ap icalmeristem s of wasabi(Wasabiajaponica)by vitrification and subsequent high p lant regeneration[J].Plant Cell Reports,1994,13(8):442-446.
[15]Jitsuyama Y,Suzuki T,Harada T,et al.U ltrastructural study on mechanism of increased freezing tolerance due to extracelluar glucose in cabbage leaf cells[J].Cryo-Letters,1997,18:33-44.
[16]Steponkus P L,Langis R,Fu jikawa S.Cryop reservation of p lant tissue by vitrification[M]∥Steponkus P L.Advances in Low Temperature B iology:Vol.1.London:JA IPress,1992:1-61.
[17]N iino T,SakaiA,Yakuwa H,et al.Cryop reservation ofinvitrogrown shoot tipsof app le and pear by vitrification[J].PlantCell, Tissue and O rgan Cu lture,1992,28(3):261-266.
[18]TakagiH,Thinh N T,Islam O M,et al.C ryop reservation ofin vitro-grow n shoot tipsof taro〔Colocasiaesculenta(L.)Schott〕by vitrification.1.Investigation of basic conditions of the vitrification p rocedure[J].PlantCellReports,1997,16(9):594-599.
[19]N iino T,Tashiro K,SuzukiM,etal.Cryop reservation ofinvitrogrown shoot tipsof cherry and sweet cherry by one-step vitrification [J].Scientia Horticu lturae,1997,70(2/3):155-163.
[20]王君晖,黄纯农.玻璃化法——园艺作物茎尖和分生组织超低温保存的新途径——文献综述[J].园艺学报,1994,21(3): 277-282.
